不同培养体系中施万细胞对BMSCs分化及分泌功能的影响
赵富生,武庚★,张晓莉,张际绯,石学魁,刘志新,李玉婷,杨晓丹,戴安
(1.牡丹江医学院,黑龙江 牡丹江 157011;2. 西双版纳州人民医院,云南 西双版纳 666100)
0 引言
施万细胞(Schwann cells, SCs),又称神经膜细胞,是周围神经系统中的一种胶质细胞,它包绕在外周神经系统神经纤维轴突的周围,形成髓鞘,在神经损伤再生过程中发挥着重要作用[1]。当损伤神经远端发生瓦勒变性时,SCs 迅速分裂、增殖,参与吞噬变性的轴突与髓鞘碎屑。同时,形成Büngner 带,引导再生轴突延伸,并分泌多种神经生长因子调控轴突再生和髓鞘形成过程[2,3]。骨髓基质干细胞(Bone stromal stem cells, BMSCs)是骨髓内一种非造血成体干细胞,具有自我更新及多向分化潜能[4]。研究表明,在不同诱导条件下,BMSCs可分化为软骨细胞、骨细胞、脂肪细胞等多种组织细胞[5]。此外,BMSCs 可自体分离扩增,有效地避免了移植引起的免疫排斥反应,为一种理想的种子细胞[6]。本实验旨在探讨在不同培养体系中,SCs形成的微环境对BMSCs 分泌以及分化特性的影响,为应用BMSCs 修复外周神经损伤提供理论依据。
1 材料
1.1 动物
SPF 级1 月龄SD 大鼠30 只,雌雄不限,体质量90~120g,由哈尔滨医科大学实验动物中心提供,许可证号:SCXK(黑)2012-010,昼夜12h 交替光照,自由食水,室温(20±2)℃条件下饲养。实验过程中对动物的处置符合医学伦理学标准。
1.2 药物、试剂和仪器
胰蛋白酶、DMEM、DMEM/F12 培养基、胎牛血清(Gibico 公司);CD44、CD90 兔抗大鼠单克隆抗体、S-100 兔抗大鼠多克隆抗体(Abcam 公司);FITC 标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司);PKH26、DAPI(Sigma 公司);ELISA 试剂盒(上海西唐生物科技有限公司);Transwell(Corning公司);体式显微镜(SMZ745 型,Nikon 公司);酶标仪(2013A70D,Thermo Fisher 公司)。
2 方法
2.1 SCs 分离培养及鉴定
用10%水合氯醛(0.35mL/100g)麻醉大鼠,无菌条件下切断坐骨神经远端,术后第7 天,取长约2cm 预变性坐骨神经,剥离神经外膜,剪成1mm 小段,用0.125%的胰蛋白酶(含0.02%EDTA)和0.08%Ⅳ型胶原酶混合液(2∶1,V/V)消化30min,离心,弃上清。将神经段植于35mm 培养皿,以SCs 培养液常规培养,第3 天半量更换培养液。培养第6、12天,将神经段移于涂有多聚赖氨酸培养皿中,更换含10%FBS 的SCs 培养液。当SCs 铺满培养皿约80%时,传代培养,行S-100 免疫荧光鉴定[7]。
2.2 BMSCs 分离培养及鉴定
大鼠乙醚麻醉后处死,无菌条件下分离股骨和胫骨,用10mL BMSCs 培养液冲洗骨髓腔,以120 目无菌筛网过滤,接种于35mm 培养皿中,常规培养,每3 天更换培养液1 次,当BMSCs 汇合至80%~90%时传代培养。取第2 代BMSCs,行CD44、CD90 免疫荧光鉴定[7]。
2.3 BMSCs 标记及实验分组
BMSCs 标记:取第3 代BMSCs,制备1×105个/mL 细胞悬液,无血清培养基洗涤1 次,离心。用0.5mL溶液C 重悬细胞,加0.5mLPKH26 工作溶液,孵育1min,用等量的血清终止反应,离心,弃上清,调细胞浓度至1×105/个/mL,备用。
实验分组:如图1 所示,根据培养方式的不同 分 为3 组:A 组, 取0.5mL 第3 代SCs(1×105个/mL)与等量PKH26 标记的第2 代BMSCs 种植于Transwell 下室接触共培养;B 组,取0.5mL 第3 代SCs(1×105个/mL)种植于Transwell 上室,将等量PKH26 标记的第2 代大鼠BMSCs 植于Transwell下室,细胞间隔PET 膜;C 组将0.5mL 第3 代SCs(1×105个/mL)植于Transwell 上室单独培养,将等量PKH26 标记的BMSCs 植于另一Transwell 下室单独培养。培养基均为BMSCs 培养基。

图1 不同培养体系示意图
2.4 S-100 蛋白表达检测
培养第7 天,各组随机选取3 个Transwell 中SCs 和BMSCs,弃培养液,PBS 冲洗3 次,加细胞裂解液冰上放置30min,收集细胞裂解液,离心,取上清,BCA 法测定上清液蛋白定浓度。取适量上清液与2×loading buffer 混合,4℃沸水中煮5min,上样(30μg/每孔),12%SDS-PAGE 凝胶电泳后转移至PVDF 膜上,室温下用5%脱脂奶粉封闭2h,滴加TBST 稀释的山羊抗兔S-100 一抗,4℃孵育过夜,次日TBST 漂洗PVDF 膜3 次,滴加辣根过氧化酶标记的山羊抗兔二抗,室温孵育2h,TBST 漂洗膜3 次,DAB 显色,凝胶成像,采用Quantity One 软件分析实验数据。
2.5 神经营养因子NT-3 含量检测
细胞于接种第0、3、6、9、12、15 天上午8∶00,各组随机收集3 个Transwell,中培养液上清,根据ELISA 试剂盒的操作说明,测定各组培养基中神经营养因子3(neurotrophins-3,NT-3)的含量。
2.6 统计学方法
采用SPSS 16.0 统计软件对实验数据进行统计学分析,数据均以mean±SD 表示。多组间比较采用单因素方差分析。两组之间比较使用最小显著性差异检验(LSD)。P<0.05 认为具有统计学差异。
3 结果
3.1 SCs 培养及鉴定
SCs 培养第3 天,有细胞从坐骨神经段边缘爬出;培养第7 天,可见典型SCs,细胞细长呈极性生长;培养第14 天,细胞数量明显增多,呈线状排列,细胞端端相接连成长串。传代培养后,SCs 增殖旺盛,呈梭形或三角形,排列呈涡流状(图2A)。第3 代SCs 免疫荧光染色呈S-100 阳性,细胞两端伸出纤长突起,相互重叠呈网状(图2B)。
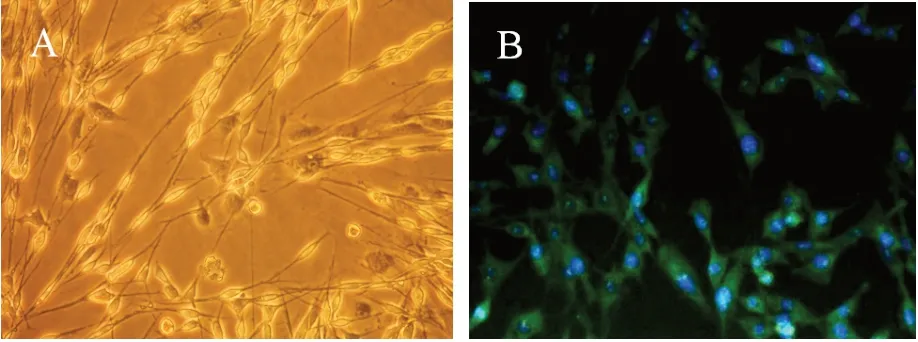
图2 SCs 原代培养及鉴定(×100)
3.2 BMSCs 培养及鉴定
接种第1 天,BMSCs 呈球形,悬浮于培养液中。培养3~5 天后,BMSCs 呈不规则形、多角形或有小突起,贴壁生长。培养5~12 天,BMSCs 增殖明显增快,细胞呈束状或旋涡样排列(图3A)。当BMSC 铺满培养培养皿约80%~90%时,进行传代培养。传代后BMSC 体积较原代细胞大,形态趋于同一。如图3B 和C 所示,免疫荧光染色鉴定BMSC 呈CD44、CD90 表达阳性。
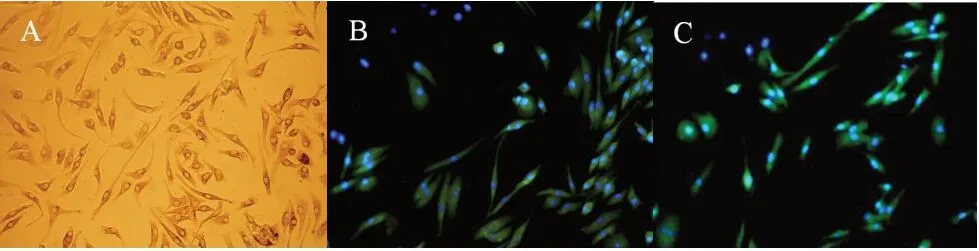
图3 BMSC 原代培养及鉴定(×100)
3.3 S-100 蛋白表达
细胞培养第7 天,取各组细胞检测S-100 蛋白表达水平。如图4 所示,与C 组相比较,A、B 组S-100 蛋白表达显著增加(P<0.05);与B 组相比较,A 组S-100 蛋白表达水平显著升高(P<0.05)。结果提示,SCs 与BMSCs 直接和间接共培养均可促进BMSCs 向SCs 向胶质样细胞分化,以直接培养体系效果更为显著。
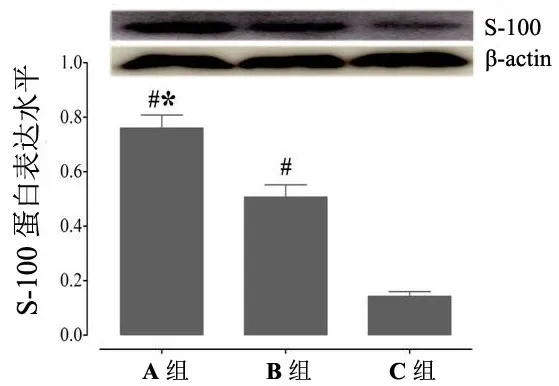
图4 不同培养体系中S-100 蛋白表达水平比较
3.4 NT-3 含量比较
在细胞培养不同时间点,取各组细胞培养上清液检测NT-3。如图5 所示,在细胞培养第0 天,A、B 和C 组中NT-3 含量无显著性差异(P>0.05);从培养第3 天开始,A 组和B 组中NT-3 含量均呈现时间依赖性增加,以培养第9 天最为显著。与C 组相比较,A 组和B 组中NT-3 含量均明显增高(P<0.05);与B 组相比较,A 组培养液上清中NT-3 含量显著增加(P<0.05)。结果提示,在直接共育体系中SCS能够有效促进BMSCs 合成NT-3。
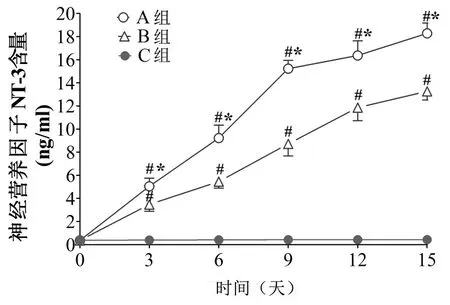
图5 不同培养体系中NT-3 含量比较
4 讨论
在临床中,外周神经组织损伤大约占创伤患者的2.8%[8],往往导致不可逆性神经功能障碍,甚至造成永久性残疾,给社会和家庭带来沉重的经济负担。近年来随着组织工程技术的发展,采用以干细胞为种子细胞的组织工程方法修复周围神经损伤成为神经科学研究热点[9,10]。
近年来,许多学者致力于BMSCs 分化的研究。研究表明,在不同诱导条件下,BMSCs 具有不同的分化能力和分化方向,可被定向诱导成为成骨细胞、破骨细胞、脂肪细胞和神经元样细胞[11,12]。体外BMSCs 可定向诱导分化为SCs 样外周胶质细胞,并能够分泌脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、神经生长因子(nerve growth factor, NGF)和NT-3 等多种营养因子。研究报道,将人BMSCs 进行定向诱导分化为类SCs,并以基质胶为载体将SCs 以2×107个/mL 细胞浓度移植到可渗透性导管中,修复大鼠坐骨神经缺损,能有效促进大鼠坐骨神经轴突再生和髓鞘形成[13]。
中枢神经系统损伤后,引起神经元凋亡以及轴突脱髓鞘等病理变化,导致不可逆性功能障碍。因此,研究者试图通过移植干细胞来替代坏死凋亡神经元,促进神经功能恢复。在临床中,自体神经干细胞来源有限,异体移植存在免疫排斥反应,限制了其在临床中的应用。BMSCs 易于获取、可自体移植,有效的避免了组织移植排斥反应发生[14]。研究显示,以白藜芦醇、刺五加或以碱性成纤维细胞生长因子均可诱导BMSCs 分化为神经元[15-17]。为探讨BMSCs 在SCs 形成的不同微环境中的分化及分泌功能是否存在差异,本研究以不同的培养体系取代了传统的化学诱导方法。将BMSCs 与SCs 直接接触培养或培养于同一双层培养皿中,中间以微孔网膜相隔,细胞不能从微孔中通过,而SCs 分泌的一些成分则可以通过网孔作用BMSCs,来模拟体内不同的神经微环境。我们研究结果显示,SCs 与BMSCs 直接接触培养可有效诱导BMSCs 向外周胶质细胞分化。
为验证分化后BMSCs 的分泌功能,我们选择了NT3 作为研究对象。结果显示,SCs 与BMSCs 接触共培养组上清液中NT-3 含量明显高于其它两组。NT-3是由神经元和神经胶质细胞分泌的信号蛋白,具有刺激神经元和神经胶质细胞增殖、分化、促进损伤修复的作用[18]。研究显示,NT-3 的受体存在于细胞膜上,NT-3 与其相应受体结合,可将信号转导至细胞质或细胞核,调节细胞增殖、分化过程[19]。研究者认为,BMSCs 之所以能在不同的微环境中分化为不同的组织细胞,如在肝脏能够分化为肝细胞样细胞[20],在缺氧状态下可转化为神经前体细胞[21],在神经系统不同部位可分化为不同类型的神经样细胞,可能是由于BMSCs 的分化依赖于其所处微环境中的细胞和细胞外基质,这些细胞与BMSCs 形成的紧密接触有助于BMSCs 的锚靠并促进其形态和基因表达模式的改变。
总之,在接触共培养体系中SCs 可有效诱导BMSCs 向外周胶质细胞分化,并促进BMSCs 的分泌功能,但有关 BMSCs 分化的确切机制尚不清楚 , 有待进一步深入研究。

