Zn2+对PPR蛋白锌指结构域原核表达的影响
吴炳男,陈 丽,张云龙,陈 婷,陆昌瑞
(东华大学 化学化工与生物工程学院,上海 201600)
PPR蛋白(pentatricopeptide repeat protein)是由多个以35个氨基酸组成的PPR模体为重复单位串联排列组成的一类蛋白质[1],是迄今为止发现的陆生植物中最大的蛋白质家族之一[2-5],参与RNA的剪接、编辑、稳定和翻译等重要生理过程[6]。DYW亚族是PPR蛋白家族中具有RNA编辑功能的一类蛋白质,从结构上可分为N端PPR串联模体和C端E、E+及DYW结构域[7-10]。N端PPR串联模体中每两个PPR模体反向平行形成螺旋-转角-螺旋结构,多个螺旋-转角-螺旋结构串联排列形成一个凹腔,可与RNA碱基结合,具有识别底物RNA功能[11-15]。C端的DYW结构域因其尾端具有保守的D-Y-W三肽而得名[1],与RNA编辑过程中胞苷脱氨作用(C-U)有关,在其一级序列中包含HXE、CXXCH两个典型的锌指结构序列[16]。在现有文献报道中,DYW结构域十分不稳定,且溶解度很低。所以通过基因重组方式体外获得大量、稳定的DYW结构域蛋白片段存在很大难度[17]。
Zn2+通过与锌指结构位点氨基酸结合从而稳定蛋白质的结构,当去除锌指结构的Zn2+后,结构变得松散;而重新加入Zn2+之后,锌指结构又可逐渐恢复并稳定[18]。因此,在一些体外重组蛋白表达中,通过添加Zn2+可提高相应蛋白质的稳定性,进而提高蛋白质的产量[19]。本实验以DYW族PPR蛋白OTP82的锌指结构域作为研究对象,利用ppSUMO原核表达系统制备该蛋白,通过在培养过程中添加Zn2+,提高了外源表达蛋白的稳定性,并对Zn2+的作用机制进行了初步探索,验证了Zn2+可在蛋白表达时直接作用于锌指结构位点,帮助蛋白表达和折叠,并维持锌指结构的稳定。
1 仪器及材料
1.1 仪器
JN-02C低温超高压连续流细胞破碎仪(JNBIO);BIO-DL移液枪(Therom Fisher);5810 R低温道速离心机(Eppendorf);Gen Pure UF超纯水机(Therom Fisher);Bio Mate 3S分光光度计(Therom Fisher);Mini-PROTEAN Tetra小型垂直电泳槽(Bio-Rad);Mini-Sub cell GT水平电泳仪(Bio-Rad);Trans-Blot SD 半干转印槽(Bio-Rad);Chemi DocTM XRS + Image LabTMsoftware(Bio-Rad)。
1.2 材料
菌株E.coliRosetta(DE3)、DH5α,ppSUMO表达载体,基因(otp82-dyw)均为本实验室自有保存;培养基,限制性内切酶,T4 DNA连接酶,Pfu DNA扩增聚合酶,质粒抽提试剂盒,胶回收试剂盒,Ni-TED亲和纯化介质,PCR产物纯化试剂盒,卡那霉素,氯霉素,异丙基硫代半乳糖苷(ITPG)等[生工生物工程(上海)]。水为超纯水。
1.3 引物
引物名称及序列见表1,由生工生物工程(上海)有限公司合成。
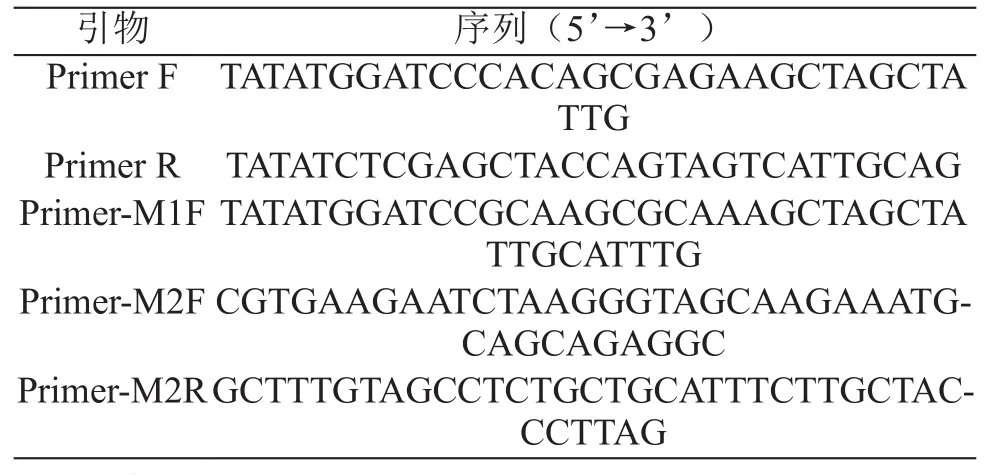
表1 引物名称及序列
2 方法
2.1 溶液的配制
2.1.1 抗生素及诱导剂储存液的配制 取卡那霉素2 g,加入超纯水溶解后定容至40 ml。过滤除菌后得到浓度为50 mg/ml的抗生素储存液;相同方法配制25 mg/ml氯霉素储存液;1 mol/L诱导剂IPTG储存液。
2.1.2 亲和纯化缓冲液的配制 Buffer A(重悬液):取1 mol/L Tris-HCl储存液(pH 8.0)20 ml,1 mol/L NaCl储存液200 ml,1 mol/L 二硫苏糖醇(DTT)储存液1 ml,甘油50 ml,混合后加入超纯水至800 ml后,调pH至8.0,超纯水定容至1 L。Buffer B(平衡液):取1 mol/L Tris-HCl储存液(pH 8.0)20 ml,1 mol/L NaCl储存液200 ml,1 mol/L DTT 储存液1 ml,甘油50 ml,1 mol/L咪唑储存液20 ml,混合后加入超纯水至800 ml,调pH至8.0,超纯水定容至1 L。Buffer W(漂洗液):取1 mol/L Tris-HCl储存液(pH 8.0)20 ml,1 mol/L NaCl储存液200 ml,1 mol/L DTT 储存液1 ml,甘油50 ml,1 mol/L咪唑储存液50 ml,混合后加入超纯水至800 ml,调pH至8.0,超纯水定容至1 L。Buffer E(洗脱液):取1 mol/L Tris-HCl储存液(pH 8.0)20 ml,1 mol/L NaCl储存液200 ml,1 mol/L DTT 储存液1 ml,甘油50 ml,1 mol/L咪唑储存液250 ml,混合后加入超纯水至800 ml,调pH至8.0,超纯水定容至1 L。
2.2 克隆构建、定点突变与菌株保存
2.2.1 表达质粒的构建 取模板基因(otp82-dyw)质粒1 μl,加入浓度为10 μmol/ml的上下游引物Primer F、Primer R各1 μl,然后加入5 μl 10×PCR Buffer及1 μl dNTP和1 μl Pfu酶,用水补齐至50 μl,进行PCR反应(95 ℃预变性3 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,35个循环;最终延伸10 min)。用2%琼脂糖凝胶电泳检测PCR扩增产物,并用PCR产物纯化试剂盒纯化PCR产物。利用限制性内切酶BamH I、Xho I酶切PCR产物及ppSUMO载体(37 ℃,3 h),并采用胶回收试剂盒回收酶切产物。使用T4 DNA连接酶将酶切后的载体与插入片段连接起来(16 ℃,过夜),并转化DH5α感受态细胞,在含卡那霉素的抗性平板上过夜培养。挑取平板上的单克隆菌落,提取质粒并测序鉴定。
2.2.2 定点突变 取野生型基因序列(otp82-dyw)为模板,将突变引物Primer-M1F与下游引物Primer R各1 μl加入PCR反应体系中进行PCR反应(95 ℃预变性3 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,35个循环;最终延伸10 min)。用2%琼脂糖凝胶电泳检测PCR扩增产物,得到突变株M1基因片段。将突变引物(Primer-M2F、Primer R或Primer F、Primer-M1R)各1 μl加入PCR反应体系中进行PCR反应,条件同上。然后将得到的两组产物等比例混合后,取2 μl作为模板,利用引物Primer F/R各1 μl进行PCR反应,得到突变株M2基因片段。然后利用相同方法构建表达克隆,并进行测序。
2.2.3 转化及菌种保存 将测序正确的表达质粒转化入Rosetta(DE3)感受态细胞中,经涂板37 ℃过夜培养后,挑取单克隆菌落37 ℃过夜培养,得到表达单克隆菌株。将培养好的菌液加入等体积80%甘油后,-80 ℃保存。
2.3 外源蛋白的诱导表达与纯化
将37 ℃过夜培养的表达克隆菌株菌液按1:100的比例接入卡那霉素及氯霉素双抗性LB培养基中,37 ℃,225 r/min进行培养。OD600=0.6时加入IPTG至终浓度为0.1 mmol/L,16 ℃,225 r/min,继续培养过夜。5000 r/min离心收集菌体,加入Buffer A重悬(重悬菌液浓度为10%)。将菌体重悬液高压匀浆破碎3次,条件为4 ℃,1300 MPa。细胞匀浆液20 000 r/min速离心,收集上清。采用Ni-TED进行目标蛋白的亲和纯化。首先,重力柱中的亲和纯化介质用5倍柱体积的Buffer B平衡。后加入上清,使上清流经亲和介质2次。之后用30倍柱体积的Buffer W漂洗。最后用5倍柱体积的Buffer E洗脱目标蛋白。各个步骤留取蛋白样品进行Bradford法浓度检测及SDS-PAGE、Western-Blot检测。
2.4 快速诱导表达
将37 ℃过夜培养的表达克隆菌株菌液按1:100的比例接入LB培养基中,37 ℃,225 r/min进行培养。当OD600=0.6时取1 ml培养液留样。之后加入IPTG至终浓度为0.1 mmol/L,37 ℃,225 r/min诱导3 h。取1 ml培养液留样进行SDS-PAGE检测。
2.5 表达菌株加Zn2+培养
将37 ℃过夜培养的表达克隆菌株菌液按1:100的比例接入卡那霉素及氯霉素双抗性LB培养基中,37 ℃,225 r/min进行培养。当OD600=0.6时加入IPTG溶液至终浓度为0.1 mmol/L,并加入ZnCl2溶液至终浓度分别为0,0.125,0.25,0.375,0.5,1 mmol/L。16 ℃,225 r/min,继续培养过夜。5000 r/min离心收集菌体备用。
2.6 亲和纯化
将同一份含Zn2+的上清分成3等份,并在其中加入EDTA使其终浓度分别为0,10,20 mmol/L。将含不同浓度EDTA的上清分别用1 ml Ni-TED(EDTA耐受型)亲和纯化介质进行纯化,并对蛋白样品进行SDS-PAGE检测。
2.7 Zn2+作用时间探索
分别在培养、诱导及细胞破碎时添加Zn2+至终浓度为1 mol/L。高压破碎细胞后,14 000 r/min、4 ℃离心1 h。取上清留取样品进行SDS-PAGE检测。
2.8 不同二价离子作用对比
将37 ℃过夜培养的表达克隆菌株菌液按1:100的比例接入卡那霉素及氯霉素双抗性LB培养基中,37 ℃,225 r/min进行培养。OD600=0.6时加入IPTG溶液至终浓度为0.1 mmol/L,并分别加入ZnCl2、MnCl2及NiSO4溶液至终浓度为1 mmol/L。16 ℃,225 r/min,继续培养过夜。取全细胞留样,进行SDS-PAGE及Western-Blot检测。
3 结果
3.1 不同浓度Zn2+对锌指结构蛋白稳定性的影响
通过分子克隆技术构建蛋白表达质粒ppSUMOOTP82-DYW质粒(ppSUMO-OD)。经诱导表达得到目的蛋白His-SUMO-OTP82-DYW(HSOD)。其理论相对分子质量(Mr)为21.8×103,目的蛋白示意图见图1 A,蛋白中含保守的锌指结构位点HXE、CXXCH,并在目的蛋白N端添加His-SUMO融合标签,用于目的蛋白的表达及纯化。
诱导表达实验结果见图1 B、C。不添加Zn2+时,全细胞样品中目的蛋白降解严重。添加Zn2+后,目的蛋白降解情况被抑制,目的蛋白稳定性随Zn2+浓度的提高而提高。当Zn2+浓度达到1 mmol/L时,目的蛋白最为稳定。Zn2+浓度超过1 mmol/L后,表达菌株生长受到明显抑制,Zn2+浓度超过1.5 mmol/L后,表达菌株生长停滞。图1 D、E表明Zn2+同样可增加上清中可溶性目的蛋白的稳定性。综上,Zn2+可有效提高锌指结构蛋白的稳定性。

图1 Zn2+对锌指结构蛋白稳定性的影响
3.2 Zn2+对目的蛋白亲和纯化效果的影响
通过添加Zn2+,目的蛋白的稳定性得到了明显提升。然而高浓度的Zn2+会影响组氨酸标签(6×His)与亲和介质的亲和能力,使柱结合效率降低,需添加金属离子螯合剂EDTA去除过量的Zn2+,从而提高柱结合效率。结果见图2。由图2可见,不添加EDTA的洗脱液样品中没有出现目标蛋白条带,证明目的蛋白在高浓度的Zn2+存在时难以与亲和介质结合;添加EDTA后,目标蛋白与亲和介质的结合效率明显提高,洗脱液样品中出现明显目的蛋白条带,且EDTA浓度为10 mmol/L时结合效果及纯化效果最佳;EDTA浓度达到20 mmol/L 时,因过量EDTA的竞争性抑制作用,导致目的蛋白与Ni2+的结合能力降低。因此,上清中添加10 mmol/L的EDTA可有效地增加目的蛋白的亲和纯化效率。

图2 Zn2+对目的蛋白亲和纯化效果的影响
3.3 最优条件下融合蛋白亲和纯化效果
根据上述实验结论,确定诱导表达时Zn2+添加浓度为1.0 mmol/L;亲和纯化时上清液中EDTA添加浓度为10 mmol/L。在此条件下,进行了融合蛋白HSOD诱导表达及亲和纯化实验。实验结果表明,融合蛋白的降解情况得到了明显抑制。蛋白纯度及纯化效率也有了明显提高(见图3)。利用考马斯亮蓝染色后进行灰度分析,得蛋白纯度约63%。经计算得到目标蛋白得率为每升菌液7.96 mg。
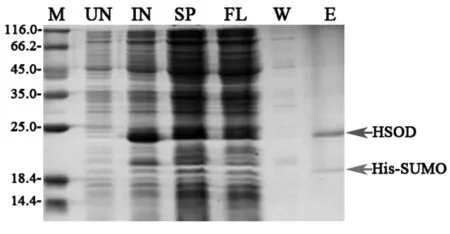
图3 最优条件下目的蛋白的亲和纯化效果
3.4 Zn2+稳定锌指结构蛋白的机制初探
发现Zn2+可明显提高OTP82蛋白DYW锌指结构域的稳定性之后,对Zn2+添加时间、Zn2+作用位点及Zn2+作用的特异性进行了初步探索。
3.4.1 Zn2+作用于蛋白表达过程 Zn2+作用时间点的探索实验结果见图4,在全细胞样品中,相比于不添加Zn2+的样品,培养及诱导时添加Zn2+均可显著提高目的蛋白稳定性;而在上清样品中,破碎时添加Zn2+后,目的蛋白的降解情况并未得到改善。实验结果证明Zn2+在锌指结构蛋白表达时帮助蛋白表达,并稳定其结构。

图4 Zn2+作用时间点实验结果
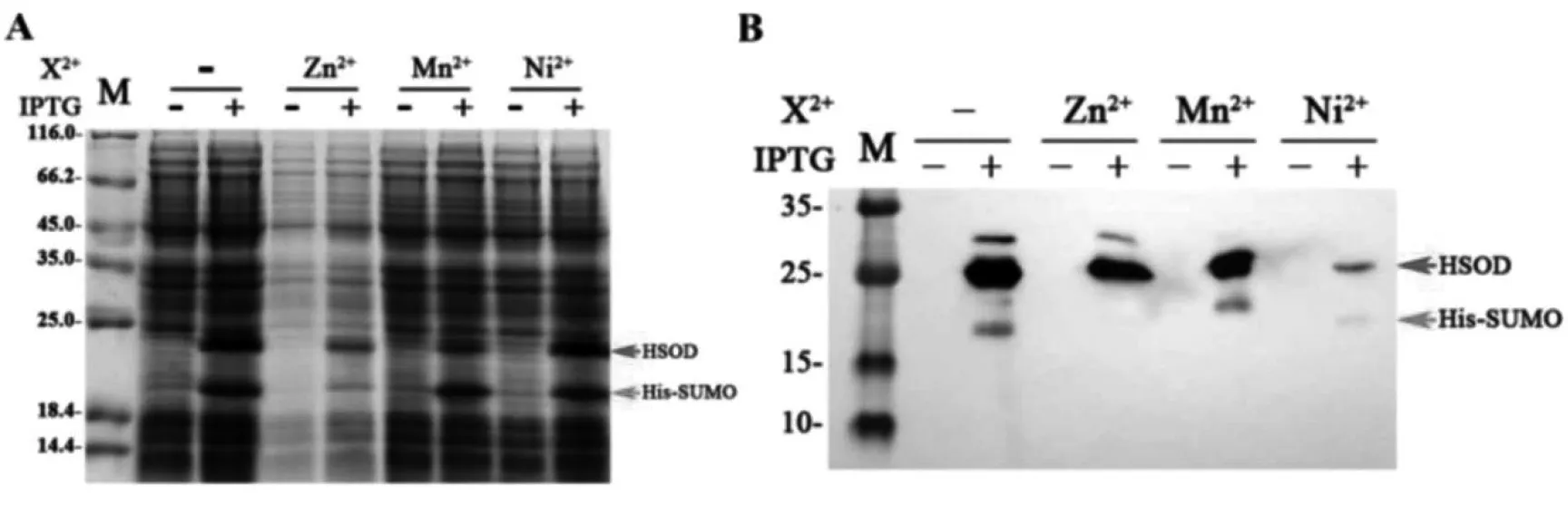
图5 不同二价离子对锌指结构蛋白稳定性的影响
3.4.2 不同二价离子对锌指结构蛋白稳定性的影响Zn2+,Mn2+及Ni2+作用结果见图5。虽然Zn2+、Mn2+及Ni2+同为过渡金属的二价离子,但添加Mn2+、Ni2+均无法稳定目的蛋白,仅Zn2+可有效提高锌指结构蛋白稳定性。
3.4.3 Zn2+作用位点的探索 对两个保守锌指位点进行丙氨酸突变得到突变株M1(HXE→AXA)、M2(CXXCH→AXXAA),见图6A。诱导表达结果见图6 B、C。全细胞样品中,由于突变株破坏了部分锌指结构,Zn2+对蛋白质的稳定性影响要明显弱于野生型菌株。因此,Zn2+只可有效地稳定锌指结构完整的蛋白质。综上所述,Zn2+作用于锌指结构。

图6 Zn2+作用位点的探索
4 讨论
锌指蛋白作为生物界中最重要的功能性蛋白之一,一直是科学界的研究热点。如何对其进行大量、稳定的体外表达纯化也成为锌指蛋白的结构及功能研究的前提。本文以OTP82蛋白中的保守锌指结构域为研究对象,证明Zn2+在锌指结构蛋白的体外表达过程中扮演重要角色。这为其他锌指结构蛋白的体外表达提供了重要参考及依据。
研究中通过添加适量的EDTA,消除过量Zn2+对组氨酸标签亲和纯化效率的负面影响。这也为其他锌指结构蛋白的组氨酸标签亲和纯化或其他需添加金属离子的蛋白质组氨酸标签亲和纯化过程的优化提供新的思路。
Zn2+的作用机制实验结果表明,Zn2+浓度及锌指结构的完整性都直接影响锌指蛋白的稳定性。这也说明在锌指蛋白的表达及纯化体系中,需添加适量的Zn2+以保持蛋白的稳定。同时,也提示Zn2+在锌指蛋白行使功能方面具有重要作用。
锌指蛋白是真核生物中最丰富的转录因子之一,在基因的表达调控、细胞分化、胚胎发育等生命过程中发挥重要作用。而锌指蛋白的结构及功能研究又依赖于体外高效、稳定的表达、纯化。因此,本文实验结果对于锌指蛋白的结构及功能方面的研究有重要的借鉴意义。
5 结论
本文实验结果表明,在蛋白原核表达体系中添加Zn2+可有效提高OTP82蛋白锌指结构域的稳定性。亲和纯化条件优化实验结果证实,细胞上清中添加10 mmol/L EDTA可有效提高融合蛋白HSOD的组氨酸标签与亲和介质的结合效率。Zn2+对锌指结构蛋白稳定性影响机制探究结果显示,Zn2+作用于锌指结构蛋白的表达过程,并稳定其高级结构。与Mn2+等二价离子的对比实验证实,只有Zn2+可有效提高锌指结构蛋白的稳定性。蛋白中保守的锌指结构位点突变后,Zn2+无法显著提升锌指蛋白的稳定性,表明Zn2+通过锌指结构位点提高锌指结构的稳定性。

