桑叶提取物对大鼠体内细胞色素P450酶活性的影响
盛晨鸣,施晓艳,丁泽贤,陈云娜,彭代银,陈卫东
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中医药科学院,安徽 合肥 230012)
桑叶为桑科植物桑(MorusalbaL.)的干燥叶,中医又称“铁扇子”。《神农本草经》最早记载其“气味苦甘寒,有小毒,主寒热出汗”,具有疏散风热的功效,可用于治疗风热感冒[1]。此外,《本草纲目》有明确记载:“桑叶乃手、足阳明之药,治劳热咳嗽,明目长发,止消渴。”现代研究表明,桑叶具有降血糖[2]、降血脂[3]等作用,是临床常见的中药之一。
随着临床上联合用药现象的普遍化,药物间发生相互作用的频率也越来越大。代谢性相互作用主要是由于药物对代谢酶产生诱导或抑制作用所致,细胞色素P450酶(cytochrome P450,CYP450)起着重要作用[4]。药物代谢酶被抑制或者诱导是引发药物相互作用的关键机制。据统计有70%药物相互作用是由于代谢酶被抑制所引起的,代谢酶被诱导的约占23%,其他约占7%[5]。
本研究参考相关文献[6-9],采用“Cocktail”探针药物法研究桑叶水提物(aqueous extract of mulberry leaves,AML)和桑叶醇提物(ethanol extract of mulberry leaves,EML)对大鼠体内CYP450同工酶活性的影响。通过使用安非他酮、非那西丁、双氯酚酸钠这3种探针底物初步探讨桑叶提取物对大鼠体内CYP450酶活性的影响。
1 材料
1.1 仪器 超高液相色谱-质谱联用仪:美国 Agilent 公司;API 4500 3Q/MS,美国AB SCIEX公司。TG16-WS 台式高速离心机:长沙湘仪离心机仪器有限公司;KAB135-S型十万分之一电子天平:德国METTLER TOLEDO公司;XW-80A 微型旋涡混合仪:上海沪西分析仪器厂有限公司;LC-4016 型低速离心机:安徽中科中佳科学仪器有限公司。
1.2 药品与试剂 桑叶采摘于安徽省大别山地区,经安徽中医药大学俞年军教授鉴定为桑科植物MorusalbaL.的干燥叶。非那西丁(纯度≥98.0%,批号 100095-201502)、双氯酚酸钠(纯度≥99.9%,批号 10033-200302)、安非他酮(纯度≥99.9%,批号 100671-200301)标准品:中国食品药品检定研究院;格列本脲标准品(纯度≥98.0%,批号 10238-21-8):上海源叶生物科技有限公司;氯化钠注射液(批号 L216061408):安徽丰原药业有限公司;甲酸:江苏强盛功能化学股份有限公司;盐酸:上海振企化学试剂有限公司;甲醇、乙腈(色谱纯):德国Merck公司。
1.3 实验动物 24只SD雄性大鼠,体质量为(200±20)g ,由安徽医科大学试验动物中心[生产许可证号为SCXK(皖)2011-002]提供。动物饲养环境:相对湿度(50±5)%,温度(25±2)℃。
2 方法
2.1 色谱条件 色谱柱:ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm);流动相:0.1%甲酸水溶液-乙腈;梯度洗脱程序:0.01~1 min,10%~80%乙腈;1~1.3 min,80%乙腈;1.3~2.0 min,80%~95%乙腈;2.0~3.0 min,95%~90%乙腈;3.0~3.5 min,90%乙腈,3.5~5.0 min,90%~10%乙腈。流速:0.2 mL/min;进样体积:2 μL;柱温:30 ℃。
2.2 质谱条件 离子化方式:电喷雾离子化(electron spray ionization,ESI),电多反应离子检测(multiple reaction monitoring,MRM)。毛细管电压:3.60 kV,离子源温度:400 ℃,去溶剂化温度:500 ℃。各成分质谱相关参数,见表1。

表1 探针药物及内标格列本脲的质谱相关参数
2.3 溶液配制
2.3.1 桑叶提取物的制备 AML:取适量桑叶与盐酸水溶液(pH=2)按料液比1∶25,在70 ℃条件下回流提取2次,每次2.5 h,合并滤液,旋转蒸发后进行真空干燥;EML:取适量桑叶与95%乙醇按料液比1∶15,回流提取2次,提取温度为85 ℃,每次1.5 h,合并两次滤液,旋转蒸发仪后真空干燥。临用前AML组用9.0 g/L氯化钠注射液(normal saline,NS),EML组用羧甲基纤维素钠(carboxymethylcellulose sodium,CMC)配制成0.2 g/mL(以桑叶生药量计)备用。
2.3.2 探针底物混合溶液的配制 在避光条件下分别精密称取安非他酮、非那西丁、双氯酚酸钠标准品15.04、15.12、14.99 mg置于50 mL棕色容量瓶中,精密加入0.50 mL无水乙醇,滴加20 μL吐温-80助溶,用生理盐水定容至刻度后混匀,超声,配制成质量浓度为0.3 mg/mL的“Cocktail”混合探针药物溶液,实验当天现配现用。
2.3.3 内标溶液配制 在避光条件下精密称取格列本脲对照品5 mg置于10 mL棕色容量瓶中,用甲醇溶液先溶解后定容至刻度,混匀配制成500 μg/mL的格列本脲储备液。吸取格列本脲溶液适量,用甲醇稀释配制成500 ng/mL的格列本脲内标溶液。
2.4 分组给药及样品采集 将24只SD雄性大鼠随机分为EML组、AML组、NS组、CMC组,每组6只。适应性饲养3 d后于每日早晨按照1 g/kg给药量灌胃桑叶提取物溶液,NS组灌胃相同容积的NS,CMC组灌胃相同容积的0.5% CMC。连续给药14 d,第14天给药30 min后,4组大鼠均尾静脉注射“Cocktail”探针底物混合溶液,给药剂量为1 mg/kg。尾静脉注射探针底物混合溶液后的0.05、0.08、0.17、0.25、0.5、1、2、4、6、8、12 h,眼底静脉丛取血200 μL至已提前备好的肝素化离心管中,3 500 r/min离心15 min,取血浆上清液,放于-80 ℃冰箱保存。
2.5 血浆样品处理方法 本实验采用蛋白沉淀法处理血浆样品,精密吸取90 μL血浆样品置1.5 mL离心管中,精密加入10 μL已配制的格列本脲内标溶液,再加入300 μL甲醇溶液,1 500 r/min涡旋5 min,12 000 r/min高速离心10 min,取80 μL上清液置于进样小瓶中进样分析。
2.6 统计学方法 根据在不同时间点采血后得出的各组探针药物的血药浓度,使用Origin 8.0软件对血药浓度-时间曲线进行拟合,使用DAS 2.0软件拟合相关药物代谢动力学参数包括机体总清除率(clearance,CL)、药时曲线下面积(area under the curve,AUC)、生物半衰期(biological half time,t1/2)等。用SPSS 21.0 软件对各探针药物的药物代谢动力学参数进行统计学分析,采用独立样本t检验法对AML与NS组、EML与CMC组的药物代谢动力学参数进行统计学分析。P<0.05表示差异有统计学意义。
3 方法学验证
3.1 专属性考察 取大鼠空白血浆混合液,大鼠空白血浆加混合探针药物加内标混合液,以及尾静脉注射混合探针药物后大鼠血浆,按“2.5”项下方法处理,采用“2.1”项下方法分析。结果表明,大鼠血浆中内源性物质不干扰色谱分析。
3.2 线性范围考察 精密吸取大鼠空白血浆90 μL,各加入一系列不同浓度的混合探针药物溶液10 μL,制备成安非他酮、非那西丁、双氯酚酸钠的系列浓度血浆样品,按“2.5”项下方法处理血浆样品,按“2.1”项下方法进样测定,记录各个峰面积,横坐标(x)为血浆样品标准品浓度(ng/mL),纵坐标(y)为对照品峰面积与内标峰面积之比,绘制各探针底物的标准曲线,计算各线性回归方程,结果见表2。

表2 大鼠血浆中3种探针药物的回归方程和回归系数
3.3 精密度和准确度考察 取适量探针药物混合溶液,配置5份混合探针药物的高、中、低、定量下限4个浓度的质控样品,按“2.5”项下方法处理,采用“2.1”项下方法分析依次进样测定。分别于一日内测定多次及连续3 d内测定3次,记录各个峰面积并计算各探针底物峰面积与内标峰面积的比值,代入“3.2”项下标准曲线中得出各探针底物的浓度,计算实际测得量与加入量的比值,从而计算准确度及日间、日内精密度。结果表明该方法测得探针底物血浆样品的日内及日间精密度均良好,能够满足本实验中生物样品的分析要求。
3.4 稳定性试验 按“2.5”项下方法操作,经血浆样品处理后混合探针药物的高、中、低、定量下限4个浓度的质控样品,分别考察血浆样品在室温放置2 h以及反复冻融3次的短期稳定性,以及在-80 ℃条件下放置20 d情况下的长期稳定性,依次进样测定。结果表明稳定性良好,满足生物样品分析要求。
3.5 基质效应考察 取来自不同大鼠的空白血浆90 μL,分别加入各个不同浓度的探针底物混合溶液10 μL,配制成含安非他酮、非那西丁、双氯酚酸钠的高、中、低标准添加SD大鼠的血浆样本,每个浓度配制6份,然后按“2.5”项下方法处理血浆样品,按“2.1”项下方法进样测定,记录安非他酮、非那西丁、双氯酚酸钠的峰面积均为A1。另外用90 μL水代替SD大鼠空白血浆,其他步骤同上,记录安非他酮、非那西丁、双氯酚酸钠峰面积均为A2,则安非他酮、非那西丁、双氯酚酸钠的基质效应的计算公式均为(A1/A2)×100%。采用同样的方法计算内标格列苯脲峰面积并计算其基质效应。由结果可知,探针底物及内标的基质效应均在(100±5)%之间,即离子强度对本试验结果测定不产生干扰,能够满足底物定量分析的要求。
4 结果
4.1 探针药物的浓度-时间曲线 4组大鼠尾静脉探针药物后,将不同的采血点所得的血浆样品按“2.5”项下方法进行处理,使用Origin 8.0软件对血药浓度-时间曲线进行拟合,结果见图1。

注:A. AML组非那西丁;B. EML组非那西丁;C. AML组安非他酮;D. EML组安非他酮;E. AML组双氯酚酸钠;F. EML组双氯酚酸钠
图1探针底物在大鼠体内的浓度-时间曲线
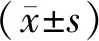
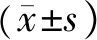
表3 桑叶提取物对非那西丁在大鼠体内药物代谢动力学参数的影响
注:与NS组比较,*P<0.05
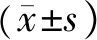
表4 桑叶提取物对安非他酮在大鼠体内药物代谢动力学参数的影响
与CMC组比较,#P<0.05
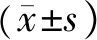
表5 桑叶提取物对双氯酚酸钠在大鼠体内药物代谢动力学参数的影响
注:与NS组比较,*P<0.05;与CMC组比较,#P<0.05
5 讨论
随着中药及中药制剂在医疗救治中的广泛使用,由中药-中药、中药-西药联合用药引起CYP450酶的诱导/抑制,产生的药物相互作用和不良反应的事件明显增加,受到临床药师和医师的广泛关注[10-16]。通过研究中药对CYP450酶的调控作用可以预测中药的某些临床疗效,揭示中药之间及中西药并用的相互作用,从而指导临床合理用药,避免药物相互作用的发生,提高中药使用的安全性和有效性[17-18]。因此,本研究希望通过初步探讨桑叶不同提取物对大鼠体内CYP450酶活性的影响来为后期临床联合给药提供一定的参考意见。
本实验参考2015年版《中华人民共和国药典》以确定桑叶不同提取物的给药量[19],最终桑叶不同提取物的给药量为1 g/kg。由于中药多为口服,故本实验给药方式的选择为灌胃给药。本实验参照课题组前期研究并进行验证[20-22]。与NS组相比,CMC组中各探针底物的主要药物代谢动力学参数无显著差异,表明可以用0.5% CMC-Na溶液溶解难溶性药物用于研究药物对CYP450酶活性的影响。
CYP1A2是CYP家族中与药物代谢关系最为密切的亚酶,其可以代谢8%~10%的上市药物[23-24]。本实验结果表明,连续灌胃给予桑叶不同提取物14 d后,与NS组相比,AML组中非那西丁在大鼠体内血药浓度升高,代谢减慢,表明连续灌胃给药AML对大鼠体内CYP1A2可能存在一定的抑制作用,而连续灌胃给药EML对大鼠体内CYP2B1酶活性无显著性影响。提示AML与其他通过CYP1A2酶代谢的药物同时使用时可能需要调整剂量。另外,3种CYP1酶(CYP1A1、CYP1A2和CYP1B1)都参与各种致癌物的代谢活化,它们的诱导可能对人类健康构成严重危害[25]。因此,AML对其的抑制作用可能在癌症预防中起重要作用。
CYP2B6在人体内参与某些前致癌物和毒素物质的激活而备受人们的关注。本实验结果表明,连续灌胃给予AML对大鼠体内CYP2B6酶活性无显著性影响,而EML中安非他酮在大鼠体内血药浓度升高,代谢减慢,表明对大鼠体内CYP2B6可能存在一定的抑制作用。说明AML可减少机体对前致癌物和前毒性物质的代谢,对糖尿病状态下的机体代谢可能起到一定的改善和保护作用。值得注意的是,与CMC相比,EML组中cmax增大了1.54倍,这意味着连续灌胃EML对大鼠CYP酶的活性产生了相当大的影响。因此,EML与其他通过CYP2B6酶代谢的药物联合使用时需谨慎,应及时调整给药剂量并对其进行监测,避免药物之间相互作用导致产生药物不良反应。
CYP2C是CYP450家族中具有代表性的重要酶类,占总肝CYP含量的1/5,参与临床药物代谢的约有16%。在这个家族中,CYP2C9参与了多种降糖药(如格列本脲、甲苯磺丁脲和二甲双胍)的代谢[26]。本实验结果显示,连续灌胃给予桑叶不同提取物14 d后,AML和EML组中双氯芬酸钠在大鼠体内均存在血药浓度升高,代谢减慢的现象,表明CYP2C6在给大鼠连续灌胃给药AML和EML后存在一定的抑制作用。提示临床上AML和EML与CYP2C9底物药物联用时,应注意及时调整剂量,避免在用药过程中引发药物浓度过高所引起的毒性及不良反应。
综上所述,本研究探索药物相互作用的方法和模型,适合初步筛选可能存在的药物相互作用。当桑叶提取物与CYP1A2,CYP2B6,CYP2C9酶代谢的药物联用时,应密切关注临床药物-药物的相互作用。

