苦参双功能核酸酶1的体外表达及结构性质分析
赵德蕊, 廖 怡, 刘苗苗, 杨青山, 吴家文
(1. 安徽中医药大学 研究生院, 合肥 230012; 2. 安徽中医药大学 新安医学教育部重点实验室科研实验中心, 合肥 230038; 3. 安徽中医药大学 药学院, 合肥230012; 4. 安徽道地中药材品质提升协同创新中心, 合肥 230038; 5. 安徽省中医药科学院, 合肥 230038)
核酸酶分为核酸外切酶和核酸内切酶两大类,限制性核酸内切酶能特异性识别切割双链DNA上的特异核苷酸序列,又分为I、II和III 3种类型;I型和III型核酸内切酶不仅能特异性切割核酸,而且能对特殊碱基进行甲基化修饰,其中I型核酸内切酶切割位点距离识别位点可达数千个碱基之远;而III型核酸内切酶切割位点距离识别位点只有25个碱基对左右。II型核酸内切酶只具有识别切割的功能,不能对碱基进行修饰,所识别的多为短的回文序列,所切割的碱基序列即为所识别的序列。本实验克隆表达的苦参双功能核酸酶1 (Sophoraflavescensbifunctional nuclease 1,SfBFN1) 属于I型核酸内切酶,具有降解核糖核酸和脱氧核糖核酸的双重功能[1],故称为双功能核酸酶1。
早期研究发现动物的核糖核酸酶具有抗肿瘤活性,如豹蛙的核糖核酸酶可以治疗恶性胸膜间皮瘤,对该蛋白的研究已进入III期临床试验[2-5]; 牛精液核糖核酸酶具有抗癌细胞增殖和促进癌细胞凋亡的作用[6]。植物核酸酶1也同样具有抗肿瘤作用,如黑松花粉细胞外核酸酶1[7]和绿豆核酸酶1[8]都能使无胸腺小鼠体内黑色素肿瘤缩小。Matousek等[9]克隆纯化了番茄的双功能核酸酶1,将这种酶及聚乙二醇修饰的化合物注射到无胸腺雌性小鼠体内,并测试其抗癌活性,均可抑制小鼠体内人黑色素瘤或前列腺癌的生长。静脉注射蛇麻的双功能核酸酶1到小鼠体内,发现黑色素瘤或前列腺癌的生长也明显受到抑制[10]。
苦参(SophoraflavescensAit.)为豆科植物,其干燥根具有清热燥湿等功效,外治滴虫性阴道炎[11];还具有抗肿瘤、镇痛等作用[12-14]。近年来,双功能核酸酶1基因已经从拟南芥[1]、番茄[9]和蛇麻[10]等植物中成功被克隆,但未见苦参双功能核酸酶1基因的研究报道。本实验基于转录组测序利用苦参的功能基因资源,首次通过RT-PCR(Reverse transcription polymerase chain reaction, RT-PCR)技术扩增了SfBFN1基因的开放阅读框(Open reading frame, ORF),构建了SfBFN1的克隆及表达载体,筛选了SfBFN1蛋白最适宜的体外表达条件,分析了SfBFN1蛋白的理化性质、结构特点,为其开发成为抗癌蛋白质药物制剂奠定了实验基础。
1 材料与方法
1.1 材料与试剂
苦参(SophoraflavescensAit.)植株采自安徽中医药大学药物园,由杨青山副教授鉴定。DNA凝胶提取试剂盒、琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;RevertAid First Strand cDNA Synthesis Kit和E.Z.N.A Plant RNA Kit购自德国OMEGA公司;酶制剂购自日本TaKaRa公司;引物合成及测序服务由上海生工完成。
1.2 菌株和载体质粒
大肠杆菌DH5α,pET22b(+)和pMD19T载体质粒均购自TaKaRa生物公司; 表达菌株BL21购自北京索宝生物科技有限公司。
1.3 方法
1.3.1 苦参总 RNA 的提取及 cDNA 合成
取苦参适量叶片,液氮速冻后研磨成粉,利用RNA提取试剂盒提取苦参总RNA。以Random为引物,通过逆转录试剂盒合成cDNA。
1.3.2SfBFN1的克隆
利用软件Primer 5.0设计引物(SfBFN1-F:5′-ATGGGTTCTCTGAAAGGACCAATTGTTTG-3′,SfBFN1-R:5′-AAGTGTCCAGGATCTGTTCACGTTTTTTCC-3′)。25.0 μL RT-PCR反应体系中16.0 μL ddH2O,2.5 μL 10×PCR buffer(Mg2+),1.0 μL dNTP mixture(10 mmol/L),1.0 μL 5.0 μmol/μL上下游引物,2.0 μL cDNA和1.5 μL rTaq酶。PCR 扩增程序为:94℃预变性3 min;94℃变性30 s,40℃退火30 s,72℃延伸1 min,共10个循环;随后94℃变性30 s,50℃退火30 s,72℃延伸1 min,共25个循环;最后72℃再延伸10 min。
1.3.3SfBFN1克隆重组质粒构建
将纯化的SfBFN1基因片段连接到pMD19T载体,利用菌液PCR鉴定阳性克隆,NdeI /XhoI酶切鉴定质粒。
1.3.4SfBFN1表达重组质粒构建
将酶切后纯化的SfBFN1基因片段连接到pET22b (+) 空载体,鉴定方法同上。
1.3.5重组质粒 pET22b-SfBFN1在大肠杆菌内诱导表达
将重组质粒pET22b-SfBFN1扩大培养,37℃培养至OD600为0.6,再分别加入不同浓度的IPTG(IPTG浓度分别为0、0.1、0.5和1.0 mmol/L),在不同温度及时间下分别诱导蛋白表达(16℃诱导24 h、25℃诱导8 h和37℃诱导6 h)。
1.3.6 蛋白Western Blot检测
SDS-PAGE电泳结束后,采用200 mA恒流转膜2 h及37℃封闭(2 g脱脂奶粉和40 mL PBST)1.5 h,经过4℃一抗(1∶100)孵育过夜和37℃二抗(1∶2500)孵育1 h,最后暗室曝光。
1.3.7 蛋白生物信息学分析
利用序列处理在线工具包The Sequence Manipulation Suite(http://www.bio-soft.net/sms/index.html)将SfBFN1的碱基序列翻译为氨基酸序列。通过ExPASy Protparam[15](http://web.expasy.org/protparam/)和Motif Scan(http://hits.isb-sib.ch/cgi-bin/motif_scan/)分析SfBFN1蛋白的理化特性及结构域。使用MEGA 5.0[16]软件建立SfBFN1蛋白系统发育进化关系。利用PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)软件预测了SfBFN1蛋白的三级结构,利用PyMOL[17-18]软件对SfBFN1蛋白的三级结构进行绘制。
2 结果
2.1 SfBFN1的克隆及重组质粒的构建
利用RNA提取试剂盒获得苦参总RNA,结果如图1-A;mRNA逆转录合成cDNA,利用SfBFN1的引物对其ORF片段进行克隆,结果如图1-B。
将PCR产物与pMD19T载体连接获得重组质粒,菌液PCR及酶切鉴定如图1-C、D。酶切pMD19T-SfBFN1质粒与同样酶切的pET22b(+) 载体连接获得重组质粒,菌液PCR及酶切鉴定如图1-E、F。SfBFN1基因序列及其蛋白质序列信息已投递到GenBank数据库,登录号为MG891836。
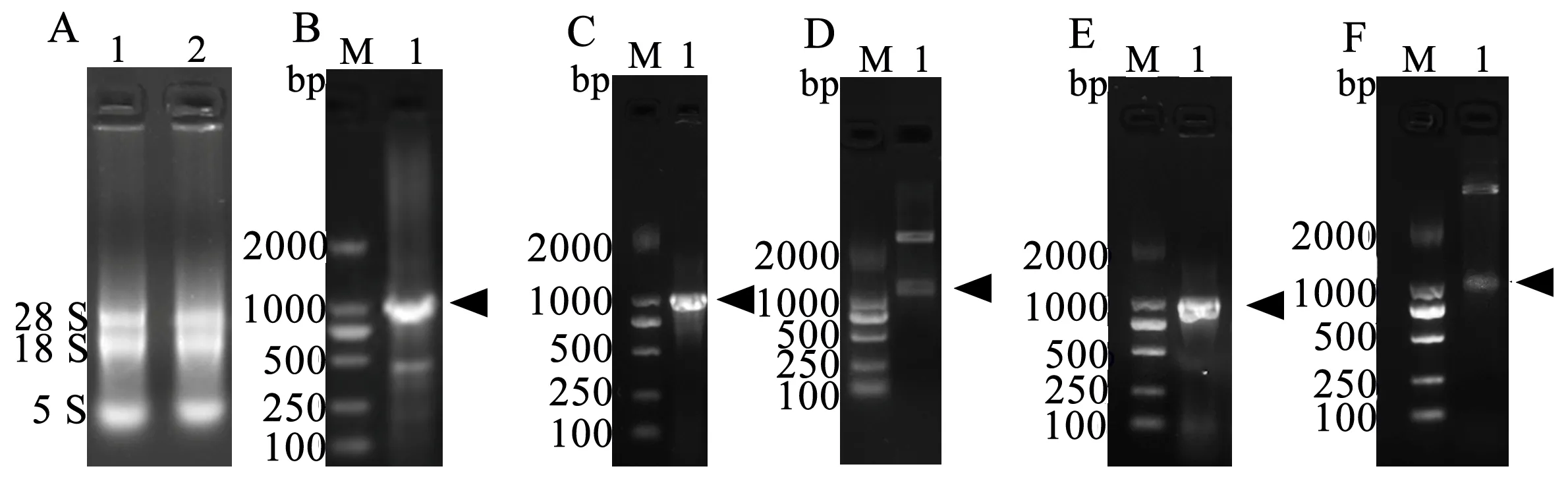
A:苦参总RNA 提取,1、2为平行样品;B:SfBFN1基因读码框的克隆;C :重组质粒pMD19T-SfBFN1菌液PCR鉴定图;D: 重组质粒pMD19T-SfBFN1酶切鉴定图;E:重组质粒pET22b-SfBFN1菌液PCR鉴定图;F:重组质粒pET22b-SfBFN1酶切鉴定图。箭头指示目的条带
图1SfBFN1基因读码框序列的克隆及重组质粒鉴定
Figure 1 The ORF cloning ofSfBFN1 and identification of recombinant plasmids
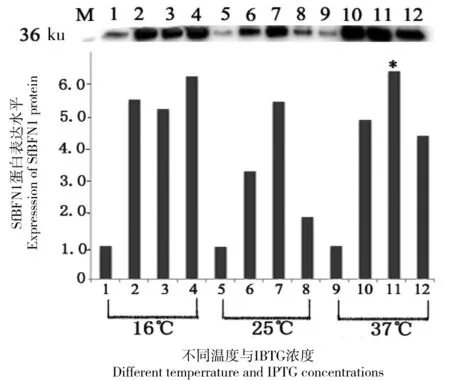
M: Marker; 1~4 分别代表在 16℃下培养24 h, IPTG 终浓度为0、0.1、0.5和1.0 mmol/L 时的蛋白表达情况;5~8 分别代表在 25℃下培养8 h, IPTG 终浓度为0、0.1、0.5及1.0 mmol/L时的蛋白表达情况;9~12 分别代表在 37℃下培养6 h, IPTG 终浓度为 0、0.1、0.5及1.0 mmol/L时的蛋白质表达情况
图2SfBFN1的诱导表达情况
Figure 2 Expression ofSfBFN1
2.2 重组质粒 pET22b-SfBFN1的诱导表达
将pET22b-SfBFN1转化到BL21感受态细胞中,以不同的IPTG 浓度分别在16℃、25℃和37℃诱导表达,利用Western Blot鉴定目的蛋白的表达情况,结果(如图2)显示:在37℃下,当IPTG的终浓度为0.5 mmol/L时目的蛋白的表达量最多(*标示)。
2.3 生物信息学分析结果
2.3.1SfBFN1序列分析
将SfBFN1的cDNA 序列翻译成蛋白质序列,如图 3 所示:读码框长度为984 bp,编码327个氨基酸,TAA为终止密码子。

图3 SfBFN1的开放读码框序列和氨基酸序列Figure 3 ORF and amino acid sequence of SfBFN1
2.3.2 SfBFN1蛋白理化性质
利用Protparam 在线软件分析SfBFN1蛋白,其分子式C1585H2573N447O466S26,相对分子质量约为36.2 ku,理论等电点8.9,280 nm处的摩尔消光系数为29 045 M-1·cm-1。该蛋白含有30个缬氨酸(Val),其含量为9.2%;含有41个正电荷氨基酸和33个负电荷氨基酸。
2.3.3 SfBFN1基元及结构域分析
Motif Scan分析显示SfBFN1编码蛋白的基元和结构域信息见表1,主要含有4个N-糖基化位点,4个酪蛋白激酶II磷酸化位点和2个酪氨酸激酶磷酸化位点等。
2.3.4 SfBFN1分子系统进化分析
利用 NCBI中SmartBlast在线软件对SfBFN1编码蛋白进行序列比对;通过MEGA5.0软件对不同物种双功能核酸酶1进行同源进化树分析(图4),SfBFN1的蛋白序列与羽扇豆、花生及木豆等豆科植物的双功能核酸酶1蛋白序列的同源性约为80%,说明该酶在豆科植物之间具有保守性;其中,SfBFN1与羽扇豆双功能核酸酶1蛋白序列的同源性高达84%,它们之间的遗传距离最短,其亲缘关系最近。
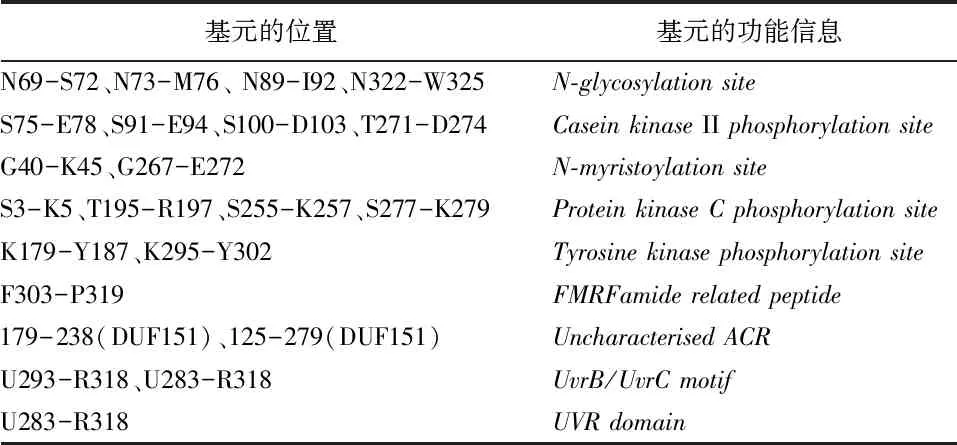
表1 SfBFN1蛋白的基元及功能信息

Lupinusangustifolius(XP_019416686.1);Arachisipaensis(XP_016167659.1);Cajanuscajan(XP_020219569.1);Vignasinensis(XP_014504471.1);Vignaangularis(XP_017428013.1);Malusdomestica(XP_008359765.1);Pyrusbretschneideri(XP_009335956.1);Arabidopsislyrata(XP_020891185.1);Brassicaoleracea(XP_013621486.1);Raphanussativus(XP_018472402.1);Brassicarapa(XP_009128096.1);Camelinasativa(XP_010416415.1)
图4 SfBFN1蛋白的系统进化树
Figure 4 Phylogenetic analysis of SfBFN1 protein
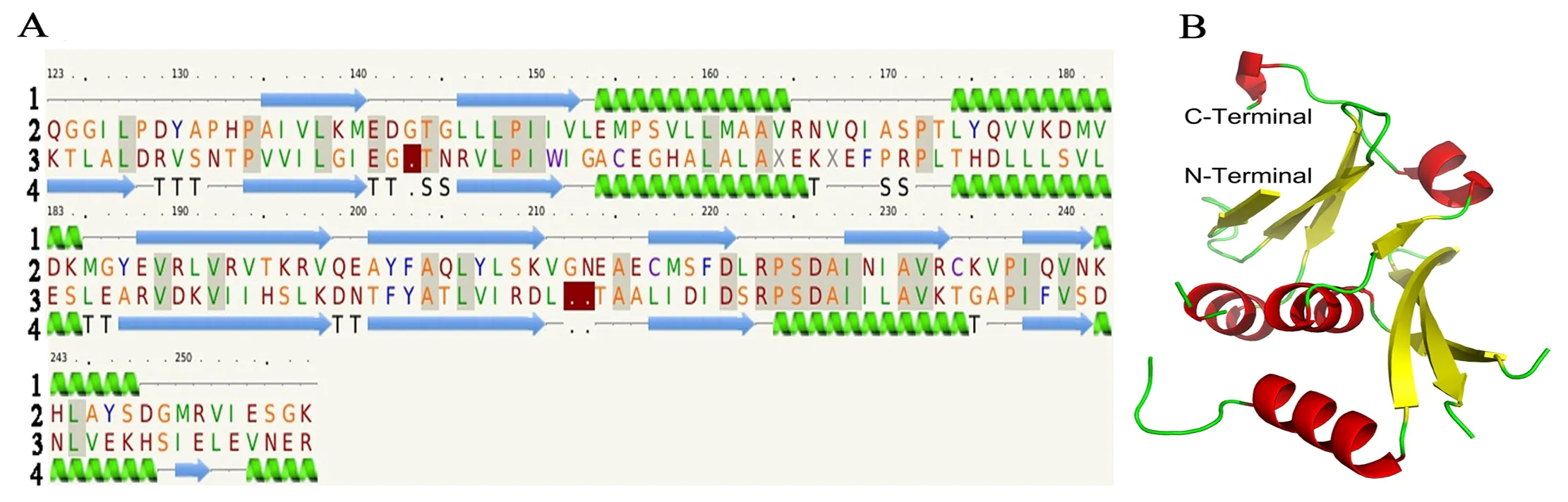
图A 中1为二级结构示意图(绿色示意α螺旋,蓝色示意β折叠);2 为SfBFN1蛋白氨基酸序列;3 为模板TMO160 蛋白(PDB ID: 1sj5)氨基酸序列;4 为模板TMO160 蛋白的二级结构。图B为 SfBFN1的三级结构模型(红色示意α螺旋,黄色示意β折叠)
图5 SfBFN1蛋白结构模型
Figure 5 The structure model of SfBFN1 protein
2.3.5 SfBFN1蛋白结构
本研究利用PHYRE2在线软件预测了SfBFN1蛋白的部分三级结构,氨基酸序列覆盖率为40%(覆盖SfBFN1蛋白132个氨基酸残基,分别为Q123-D142、T144-V211和E214-K257,序列一致性为23%,可信度为100%)。结果显示SfBFN1酶蛋白中央保守区域 (Q123-K257) 富含α螺旋和β折叠,其中含5个α螺旋 (E154-A162、L174-M185、P223-C234、K242-D248和F254-G256) 和7个β折叠(A135-M140、C146-V152、E188-V198、A201-K210、C217-D211、I228-R233和I238-N241),如图5-A所示。
利用PyMOL软件对SfBFN1的三级结构进行绘制(图5-B,结构区域为Q123-K257)。SfBFN1酶蛋白的三级结构中7个β折叠被5个α 螺旋包裹在内部,构成了蛋白质立体结构的稳定的内部框架。
3 结论与展望
本实验成功克隆了SfBFN1基因的开放阅读框,筛选了SfBFN1蛋白的体外表达条件,分析了其理化性质、同源关系及结构特点。研究发现SfBFN1蛋白与羽扇豆的双功能核酸酶1蛋白之间的遗传距离最短,同源性高达84%,这与苦参是豆科植物是相符的。
植物双功能核酸酶1具有重要的生物学功能[19-20],如氧响应因子1通过与双功能核酸酶1的启动子结合从而影响拟南芥叶片的衰老[21],双功能核酸酶1的启动子不仅在衰老的器官中有活性,在其他器官中(如正在发育的花、种子,以及受精后的花等)也有活性,说明该酶还参与拟南芥不同的生长发育过程[22]。
动物核酸酶能抑制和杀死肿瘤细胞,如牛胰腺核糖核酸酶、牛精液核糖核酸酶和豹蛙的核糖核酸酶等,这些酶与细胞的相互作用大多是非特异性的,所以它们的应用会引起较强的毒副作用,例如代谢变化、免疫反应或干扰精子生长等[23-24]。虽然植物核酸酶的功能尚未被广泛发掘,但已证实它具有抗肿瘤作用及较小的毒副反应,其原因可能是动植物具有不同的糖基化模式[9,25],故植物双功能核酸酶1蛋白作为潜在的抗肿瘤抑制剂引起了越来越多的关注。
通过X射线荧光光谱法发现番茄的双功能核酸酶1 蛋白中锌离子有3种空间排列方式,且该蛋白通过二硫键保持结构稳定,这点与牛精液核糖核酸酶的结构类似[26]。研究还发现番茄、蛇麻及芸苔的双功能核酸酶1蛋白具有桔青霉核酸酶1相似的结构特征,且这三种双功能核酸酶经过N-糖基化修饰后切割双链DNA,该过程由Zn2+催化发生[27-30]。SfBFN1蛋白的三级结构富含α螺旋与β折叠,5个α 螺旋包裹着7个β折叠,构成了稳定的立体结构,且蛋白中含有4个N-糖基化位点(表1),蛋白质序列中含有10个半胱氨酸,推测此蛋白酶也是通过二硫键保持结构稳定,由Zn2+催化此酶经过N-糖基化修饰后切割双链DNA。本研究为进一步纯化SfBFN1蛋白,将其开发成抗癌药物奠定了实验基础。

