金黄色葡萄球菌胞外分泌蛋白的核酸酶活性研究
李 琦,廖成水*,毛福超,王晓利,张梦珂,张晓洁,张春杰,李银聚,吴庭才,程相朝,3*
(1. 河南科技大学 动物科技学院/洛阳市活载体生物材料与动物疫病防控重点实验室,河南 洛阳 471023;2. 河南科技大学 医学院,河南 洛阳 471023;3. 洛阳职业技术学院,河南 洛阳 471099)
金黄色葡萄球菌是一种典型的食源性革兰氏阳性菌,人类感染金黄色葡萄球菌的主要临床症状为肺炎、伪膜性肠炎、心包炎等,严重时导致败血症和中毒性休克综合征[1]。在兽医临床上,金黄色葡萄球菌可引发大部分动物的多种疾病,金黄色葡萄球菌易形成生物被膜,在临床感染中较难治愈,从而严重损害动物健康,造成巨大的经济损失[2]。研究发现金黄色葡萄球菌引起的急性肠炎和中毒等症状与其自身分泌蛋白密切相关,其分泌蛋白的浓度直接决定了金黄色葡萄球菌的致病力[3]。
细菌分泌的胞外蛋白是多功能蛋白质,在细菌和人类宿主之间的相互作用过程中发挥重要作用,如粘附、侵袭、复制和逃避[4]。其中,胞外蛋白包括蛋白酶、脂肪酶、胶原酶、透明质酸酶、几丁质酶和核酸酶等多种酶类[5]。其中核酸酶在各种微生物中广泛存在,主要参与机体的营养代谢、遗传物质的复制、重组和修复机制以及微生物感染、免疫等相关过程[6]。在病原菌感染宿主细胞的过程中,病原菌通过分泌各种核酸酶水解磷酸二酯键将DNA和RNA 消化成寡核苷酸,扩大自身可用的核苷酸库来提供生长优势。已有研究表明致病性病原体可分泌核酸酶,是细菌的重要毒力因子[7]。
探究细菌胞外分泌蛋白的特性有助于揭示病原体与宿主互作的分子机制,但目前关于金黄色葡萄球菌胞外分泌蛋白核酸酶活性的研究报道较少[8]。因此,本研究通过琼脂糖凝胶电泳法、琼脂扩散法和琼脂培养法检测金黄色葡萄球菌胞外分泌蛋白的核酸酶活性,再利用琼脂糖凝胶电泳法观察了温度、pH 和金属离子对金黄色葡萄球菌胞外分泌蛋白核酸酶活性的影响,为进一步研究金黄色葡萄球菌的致病性和免疫逃逸提供依据。
1 材料与方法
1.1 菌株与试剂 金黄色葡萄球菌标准菌株ATCC 25923 由洛阳市活载体生物材料与动物疫病防控重点实验室保存。琼脂粉购自博奥森生物股份有限公司;琼脂糖购自北京索莱宝科技有限公司;λDNA(0.2 mg/mL)购自德国Sigma 公司;DNase I 和10×DNase I Buffer 购自宝生物工程(大连)有限公司;BCA蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司;脑心浸液培养基(Brian Heart Infusion,BHI)培养基购自青岛高科技工业园海博生物技术有限公司;超纯水购自北京索莱宝科技有限公司;核酸染料Goodview 购自北京索莱宝科技有限公司;其它化学试剂均为国产分析纯。
1.2 金黄色葡萄球菌胞外分泌蛋白的收集将-70 ℃保存的金黄色葡萄球菌标准菌株于BHI 平板复苏,取单个菌落于BHI 培养基中37 ℃180 r/min培养12 h~16 h。按1∶10 体积比转接至新鲜BHI 培养基继续培养5 h,4 ℃12 000 r/min 离心10min 后取上清液,透析得到胞外蛋白,利用BCA 蛋白质定量检测试剂盒测定蛋白浓度,4 ℃保存。
1.3 胞外分泌蛋白的核酸酶活性的测定 采用琼脂培养法测定胞外分泌蛋白的核酸酶活性,即用50 mmol/L 磷酸盐缓冲液(pH 7.0)配制1.0%琼脂的BHI 培养基,高压灭菌后加入λDNA(终浓度为50 μg/mL)和核酸染料(终浓度为1 μg/mL)制备琼脂平板。将金黄色葡萄球菌菌液稀释至适当浓度,均匀涂于琼脂平板,37 ℃培养24 h 后利用凝胶成像系统观察菌落周围λDNA 的降解程度。
同时采用琼脂扩散法测定胞外分泌蛋白的核酸酶活性,即利用打孔器在该琼脂平板上打直径为5 mm 的孔,去除孔中残留液体。将胞外蛋白加至孔内,分别以DNase I 和BHI(脑心浸液肉汤)液体培养基作为阳性对照和阴性对照,37 ℃培养24 h 后于凝胶成像系统下观察孔周围λDNA 的降解程度。
采用琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性,即按下列参数配制金黄色葡萄球菌胞外 蛋 白 切 割DNA 的20 μL 反 应 体 系:1 μL λDNA(0.1 mg/mL)、5 μL 50 mmol/L 磷酸盐缓冲液(pH7.0)和不同浓度的胞外蛋白(终浓度分别为1 μg/mL、2 μg/mL、3 μg/mL、4 μg/mL 和5 μg/mL),补 充ddH2O 至总体积为20 μL,以DNaseI 为阳性对照。混匀后37 ℃水浴30 min,产物经1.0%琼脂糖凝胶电泳后分析。
1.4 温度对胞外分泌蛋白核酸酶活性影响的测定按照1.3 中琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性的方法检测不同温度(4 ℃、16 ℃、25 ℃、30 ℃、37 ℃、42 ℃、50 ℃和60 ℃)对金黄色葡萄球菌胞外分泌蛋白核酸酶活性的影响。此外,将胞外分泌蛋白经65 ℃、70 ℃、75 ℃和80 ℃的温度处理20 min 后,按照同样方法检测胞外分泌蛋白核酸酶活性的热稳定性,采用凝胶成像系统观察。
1.5 pH 对胞外分泌蛋白核酸酶活性影响的测定参照1.3 中琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性的方法,分别向反应体系中添加乙酸盐缓冲液(pH 3.0)、甲苯酸盐缓冲液(pH 4.0)、醋酸盐缓冲液(pH 5.0)、柠檬酸盐缓冲液(pH 6.0)、磷酸盐缓冲液(pH 7.0)、Tris 缓冲液(pH 8.0)、硼酸盐缓冲液(pH 9.0)、甘氨酸缓冲液(pH 10.0)、甲胺缓冲液(pH 11.0)和磷酸盐缓冲液(pH 12.0)5 μL,其它参数不变,检测pH 对胞外分泌蛋白的核酸酶活性的影响,采用凝胶成像系统观察。
1.6 EDTA 对金黄色葡萄球菌胞外分泌蛋白核酸酶活性影响的测定 按1.3 中琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性的方法,配置终浓度分别为0.01 mmol/L、0.05mmol/L、0.1 mmol/L、0.5 mmol/L 和1 mmol/L EDTA 的20 μL 反应体系,并保持其它参数不变,利用凝胶成像系统观察结果,研究不同浓度的EDTA 对金黄色葡萄球菌胞外分泌蛋白核酸酶活性的影响。
1.7 金属离子对胞外分泌蛋白核酸酶活性影响的测定按1.3 中琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性的方法,配置含终浓度分别为0.01 mmol/L、0.1 mmol/L、1 mmol/L、5 mmol/L 和10 mmol/L 的各金属离子的20 μL 反应体系,并保持其它参数不变,利用凝胶成像系统观察结果,研究Na+、K+、Ca2+、Co2+、Ba2+、Mg2+、Ni2+、Zn2+、Cu2+、Fe3+和Mn4+对核酸酶活性的影响。
2 结 果
2.1 测定胞外分泌蛋白的浓度及核酸酶活性 经透析纯化后的金黄色葡萄球菌的胞外分泌蛋白利用BCA 蛋白质定量检测试剂盒测定蛋白浓度,结果显示获得的该蛋白浓度为48.5 μg/mL。新鲜培养的金黄色葡萄球菌培养后经凝胶成像系统观察可见,在紫外灯下菌落周围出现黑色区域(图1),表明金黄色葡萄球菌的胞外分泌蛋白可降解琼脂中的λDNA,表现出核酸酶活性。

图1 琼脂培养法测定胞外分泌蛋白的核酸酶活性Fig.1 Detection of the nuclease activity of the extracellular proteins by agar culture assay
采用琼脂扩散法测定胞外分泌蛋白的核酸酶活性,结果显示胞外蛋白和DNase I 阳性对照孔周围均出现黑色环状区域,而BHI 培养基阴性对照孔周围未出现黑色圆环(图2)。表明金黄色葡萄球菌分泌的胞外蛋白表现出核酸酶活性。

图2 琼脂扩散法测定胞外分泌蛋白的核酸酶活性Fig.2 Detection of the nuclease activity of the extracellularproteins by agar diffusion method
将λDNA 和不同浓度的胞外分泌蛋白共孵育后,经琼脂糖凝胶电泳法测定,结果显示,λDNA与胞外分泌蛋白孵育后被降解成大小不等的DNA 片段,当胞外分泌蛋白浓度为1 μg/mL 时λDNA 被轻微的降解,随着金黄色葡萄球菌胞外分泌蛋白浓度的增加,降解λDNA 的能力也随之增强(图3)。结果进一步证实金黄色葡萄球菌胞外分泌蛋白具有核酸酶活性。
2.2 温度对金黄色葡萄球菌分泌蛋白核酸酶活性影响的检测结果 分别于不同温度下共孵育λDNA和胞外分泌蛋白,利用琼脂糖凝胶电泳检测胞外分泌蛋白核酸酶活性,结果显示,胞外蛋白在不同孵育温度均表现出降解λDNA 的活性,但在较低温度(4 ℃、16 ℃、25 ℃和37 ℃)时胞外蛋白核酸酶活性较弱,而在42 ℃、50 ℃和60 ℃时胞外蛋白核酸酶的活性较强,且50 ℃时表现出最强的降解λDNA 活性(图4a)。同时,热稳定性检测发现胞外蛋白在超过70 ℃时的核酸酶活性表现出失活状态(图4b)。表明金黄色葡萄球菌胞外分泌蛋白的核酸酶的最适温度为50 ℃,且胞外核酸酶对70 ℃以上的耐受性较差。
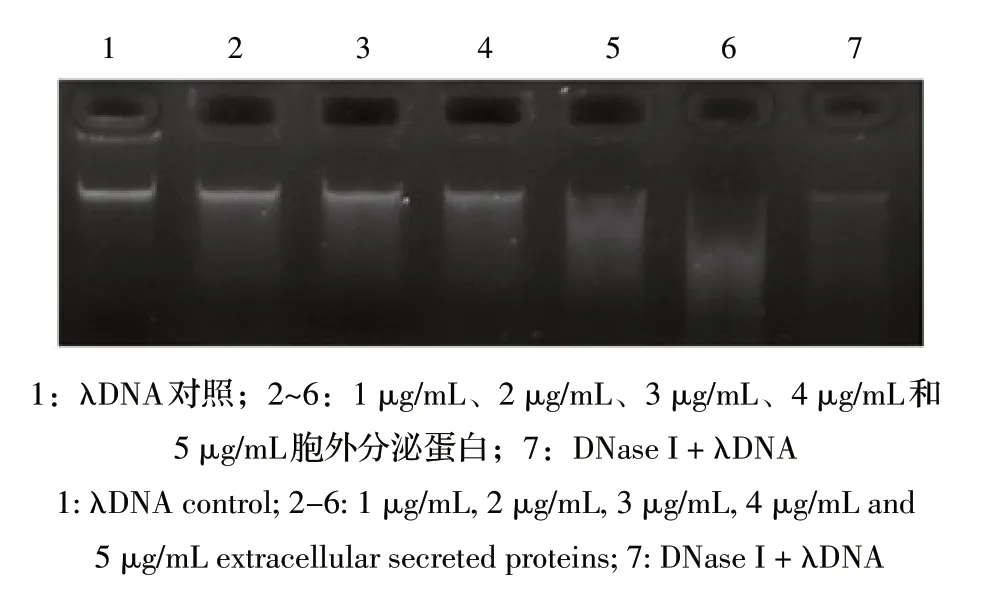
图3 琼脂糖凝胶电泳法测定胞外分泌蛋白的核酸酶活性Fig.3 Detection of the nuclease activity of the extracellular proteins by agarose gel electrophoresis

图4 温度对胞外分泌蛋白核酸酶活性影响的检测结果Fig.4 Effect of different temperature on the nuclease activity of the extracellular proteins
2.3 pH 对金黄色葡萄球菌分泌蛋白核酸酶活性影响的检测结果 琼脂糖凝胶电泳法观察胞外分泌蛋白在反应环境为pH 3.0~pH 12.0 的核酸酶活性。结果显示,金黄色葡萄球菌胞外分泌蛋白在酸性条件下(pH 3.0~pH 6.0)切割λDNA 的活性较差,而在pH 8.0~pH 10.0 的碱性范围具有良好的核酸酶活性,且pH 9.0 时胞外分泌蛋白切割λDNA 的能力最强,但当pH达到11.0和12.0时核酸酶活性被抑制(图5)。表明金黄色葡萄球菌胞外分泌蛋白核酸酶的最适pH 为9.0,在酸性条件的反应环境时核酸酶的活性较弱。

图5 pH 对胞外分泌蛋白核酸酶活性影响的检测结果Fig.5 Effect of different pH values on the nuclease activity of the extracellular secreted proteins
2.4 EDTA 对金黄色葡萄球菌胞外分泌蛋白核酸酶活性影响的检测结果 配置含不同终浓度EDTA 的20 μL 反应体系,并保持其它参数不变条件下培养,检测不同浓度EDTA 对金黄色葡萄球菌胞外分泌蛋白核酸酶活性影响,结果显示,0.01 mmol/L~1 mmol/L EDTA 对金黄色葡萄球菌胞外分泌蛋白核酸酶活性未产生影响(图6)。表明,胞外分泌蛋白中不含金属离子,对实验结果不产生影响。

图6 EDTA 对胞外分泌蛋白核酸酶活性影响的检测结果Fig.6 Detection results of EDTA on the nuclease activity of extracellular secreted proteins
2.5 金属离子对金黄色葡萄球菌分泌蛋白核酸酶活性影响的检测结果 在λDNA 和胞外分泌蛋白的反应体系中添加不同浓度的金属离子,测定不同浓度的金属离子对胞外分泌蛋白核酸酶的影响。琼脂糖凝胶电泳结果显示,添加任何浓度(0.01 mmol/L~10 mmol/L)的Ba2+和Mg2+对胞外分泌蛋白的核酸酶活性均无影响;添加低浓度的Na+(0.01mmol/L~0.1 mmol/L)对胞外分泌蛋白的活性无影响,其它浓度的Na+促进胞外蛋白核酸酶的活性;除0.01 mmol/L K+对胞外分泌蛋白的核酸酶活性无影响外,其它浓度的K+均有促进胞外分泌蛋白的核酸酶活性的作用;低浓度(0.01 mmol/L~1 mmol/L)的Ni2+、Cu2+、和Mn4+提高了胞外分泌蛋白切割DNA 的活性,高浓度(5 mmol/L~10 mmol/L)对胞外分泌蛋白的核酸酶活性无影响。高浓度(5 mmol/L~10 mmol/L)的Ca2+对胞外分泌蛋白的活性具有抑制作用,其它浓度均无影响;高浓度(5 mmol/L~10 mmol/L)的Co2+、Zn2+、Fe3+均提高了胞外分泌蛋白核酸酶的活性(图7)。表明,不同金属离子对金黄色葡萄球菌胞外分泌蛋白切割DNA的能力具有不同的影响,其中低浓度(0.01 mmol/L~1 mmol/L)的Ca2+、Ni2+、Cu2+和Mn4+,高浓度(5 mmol/L~10 mmol/L)的Na+、K+和Fe3+可以促进胞外核酸酶切割λDNA 的活性;添加Co2+(0.01 mmol/L~10mmol/L)可以促进胞外分泌蛋白的核酸酶活性。

图7 金属离子对胞外分泌蛋白核酸酶活性影响的检测结果Fig.7 Effect of metal ions on the nuclease activity of the extracellular secreted proteins
3 讨 论
已有研究证实,微球菌核酸酶是金黄色葡萄球菌的细胞外磷酸二酯酶,这种酶可水解核糖核酸或脱氧核糖核酸,水解后产生3'-磷酸单核苷酸和二核苷酸,有助于无乳链球菌进入先天免疫系统并在其中存活和增殖[9]。具有核酸酶活性的胞外分泌蛋白可能有助于金黄色葡萄球菌进入非吞噬细胞或在吞噬细胞中存活和增殖[10]。本研究通过琼脂糖凝胶电泳法、琼脂扩散法和琼脂培养法证实了金黄色葡萄球菌分泌的胞外蛋白具有核酸酶活性,同时探究了温度、pH 和金属离子对金黄色葡萄球菌胞外分泌蛋白的核酸酶活性的影响。
温度、pH 和金属离子等多种因素可影响核酸酶的活性。一般情况下,微生物产生的核酸酶在pH 值为pH 6.0~pH 10.0 范围内具有活性,且在反应环境pH 值为pH 8.0~pH 8.5 时活性最高[11]。本研究发现金黄色葡萄球菌胞外分泌蛋白在pH 为9.0 的碱性条件下核酸酶活性最强,而在pH 3.0~pH 7.0 的酸性条件下胞外分泌蛋白的核酸酶活性较弱,这说明金黄色葡萄球菌胞外分泌蛋白中不存在酸性核酸酶或者含量较少。多数微生物核酸酶在温度35 ℃和44 ℃之间表现出高活性[11],而本研究中的金黄色葡萄球菌胞外分泌蛋白在42 ℃至60 ℃温度范围内表现出较好的核酸酶活性。如TREX1、FLAP 核酸内切酶I(FEN I)和DNase I 等其它的核酸酶的活性最佳温度是37 ℃,金黄色葡萄球菌胞外分泌蛋白切割DNA 的最适温度50℃,说明金黄色葡萄球菌分泌的核酸酶可能不属于FEN I 或DNase I。大多数核酸酶的活性至少需要Ca2+和Mg2+离子活化[12]。有意思的是,无论低浓度还是高浓度的Mg2+均不能促进金黄色葡萄球菌胞外分泌蛋白的核酸酶活性,但低浓度(0.01 mmol/L~1 mmol/L)的Ca2+可促进金黄色葡萄球菌胞外分泌蛋白切割DNA 的能力,而高浓度(5 mmol/L~10 mmol/L)的Ca2+对核酸酶活性无影响。一般来说,金属离子对核酸酶具有双重作用:既能增强底物对序列或结构特异性的酶的亲和力,也能直接参与磷酸氧键断裂的催化作用[13]。高浓度(5 mmol/L~10 mmol/L)的Na+、K+、Co2+和Fe3+提高了金黄色葡萄球菌胞外分泌蛋白切割DNA 的活性,而低浓度(0.01 mmol/L~1 mmol/L)对胞外分泌蛋白核酸酶活性无影响;但低浓度(0.01 mmol/L~1 mmol/L)的Ni2+、Cu2+和Mn4+提高了金黄色葡萄球菌胞外分泌蛋白DNA 的活性,而高浓度(5 mmol/L~10 mmol/L)对胞外分泌蛋白核酸酶活性无影响。由此可以看出,金黄色葡萄球菌胞外分泌蛋白可能存在多种具有活性的核酸酶。
新近的许多研究证实了病原微生物通过分泌胞外核酸酶降解中性粒细胞细胞胞外诱捕网的DNA 骨架是逃避免疫杀伤的主要途径之一[14]。如酿脓链球菌分泌的核酸酶A(SpnA)和Spd1、肺炎链球菌表面核酸内切酶(EndA)和脱氧核糖核酸内切酶(TatD)、无乳链球菌核酸酶A(NucA)、A 组链球菌(GAS)分泌的Sda1 和SdaD2 以及霍乱 弧 菌Dns 和Xds 都是微生物逃避中性粒细胞胞外诱捕网的重要细胞外核酸酶[15-18]。因此,金黄色葡萄球菌是否也是通过分泌核酸酶的途径逃避先天性免疫防御值得深入研究,虽然本研究证实了金黄色葡萄球菌胞外分泌蛋白的核酸酶活性,但从核酸酶的部分酶学特性来看,金黄色葡萄球菌分泌的胞外蛋白中可能含有多种核酸酶。研究表明,金黄色葡萄球菌分泌的一种胞外核酸酶可降解中性粒细胞胞外诱捕网的DNA 骨架,从而逃避胞外诱捕网的捕杀[19]。但更全面得到金黄色葡萄球菌胞外蛋白胞外核酸酶的信息有助于揭示金黄色葡萄球菌的致病性和免疫逃逸。所以,下一步研究将侧重于分离和鉴定金黄色葡萄球菌胞外核酸酶的种类与特性,同时探讨金黄色葡萄球菌胞外核酸酶在感染中的确切作用。

