川西地区鸡滑液囊支原体分离株的部分生物学特性及其VlhA 基因遗传进化分析
李 凡,张焕容,陈云霞
(西南民族大学 生命科学与技术学院,四川 成都 610041)
鸡滑液囊支原体病又称传染性滑膜炎,是由滑液囊支原体(Mycoplasma synoviae,MS)引起鸡和火鸡的一种常见、多发性急慢性传染病[1]。MS 主要侵害鸡关节的滑液囊和腿鞘,引起渗出性滑膜炎、腿鞘炎,特征病变为关节、腱鞘和脚掌肿胀[2]。MS 具有水平传播和垂直传播的特性[3-4]。各品种的鸡均易感,造成雏鸡、青年鸡生长发育迟缓及胴体降级,产蛋鸡生产性能下降,鸡群残次率增加,严重的易继发其它疾病而死亡[5-7]。由于支原体分离培养极为困难,虽四川地区鸡MS 临床疑似感染病例很多,但还未见四川地区鸡MS 分离鉴定等相关研究报道。本研究对川西部分地区75 份临床疑似MS 感染病鸡的样本进行了PCR 检测,并对检测为阳性的病料进行MS 的分离鉴定及生物学特性研究,对分离株的VlhA 基因进行遗传进化分析,旨在了解川西地区肉鸡场MS 的感染情况,获取MS 地方分离株,为该病的防控提供基础材料和科学依据。
1 材料与方法
1.1 参考菌株及主要试剂 鸡滑液囊支原体参考株GX11-T,购自中国兽药监察所;改良Frey 培养基购自北京中海生物科技有限公司;PCR 预混液购自大连宝生物工程公司。
1.2 疑似MS 感染鸡临床病变观察及样本采集 观察并记录临床疑似MS 感染鸡的病变,采集川西地区的4 区市15 个鸡场75 份临床疑似MS 感染病鸡的咽拭子、胸部滑液囊、跗关节、腿鞘和脚底脓肿组织和分泌物样本。样本详细信息如表1。

表1 疑似MS 感染病鸡的样本信息Table 1 Sample information of suspected MS infected chickens
1.3 病料处理及DNA 提取 取病料组织样品约0.05 g 于研磨器中剪碎研磨,加入1 mL 生理盐水稀释混匀后转至1.5 mL 灭菌离心管中,8 000 r/min 离心2 min 取上清;咽拭子样品置于无菌生理盐水中,涡旋震荡混匀后直接吸取上清,使用酚氯仿法提取病料组织及咽拭子上清中的DNA。
1.4 临床样本的PCR 检测 以VlhA 基因为模板,采用石晓磊[8]设计的引物,MSF:5'-TTAGCAGCTAG TGCAGTGGCC-3'/MSR:5'-GTAACCGATCCGCTTAAT GC-3'由生工生物工程(上海)股份有限公司合成,扩增片段长度为300 bp,同时以MS参考株GX11-T作为阳性对照。PCR 反应条件为:94 ℃5 min;94 ℃30 s,53 ℃30 s,72 ℃1 min,共30 个循环;72 ℃10 min。反应结束后,PCR 扩增产物用1.5%琼脂糖凝胶电泳检测。
1.5 MS 的分离 取PCR 检测为MS 阳性的样本,加入终浓度为2 000 IU 氨苄过夜处理,接种于改良Frey 固体培养基,置37 ℃、5%CO2培养箱中培养,每日在显微镜下观察。待平板上观察到煎蛋样菌落后,在10×4 倍显微镜下观察菌落形态,取菌落经瑞氏染色后镜检观察菌体形态;同时挑取单菌落接种于改良Frey 液体培养基中,37 ℃5%CO2培养,待培养基颜色变黄时收获并传代。
1.6 分离菌吸附鸡红细胞的试验 将5 mL 0.25%鸡红细胞悬液加入直径35 mm 的固体培养板上疑似MS培养物的表面,轻摇混匀,室温下作用20 min 后弃红细胞悬液,用生理盐水洗涤固体培养板3 次,在10×4 倍显微镜下观察菌落表面有无红细胞吸附。
1.7 分离菌生长滴度测定—颜色改变单位法(CCU)将MS 分离菌分别用改良Frey 氏液体培养基经10 倍倍比稀释(101~1010),同时设置加生理盐水的液体培养基为阴性对照,置37 ℃,5% CO2培养,记录每管颜色变化(以培养基颜色由猩红变成橘黄的最终管稀释度作为活菌的CCU),测定各分离株的CCU。
1.8 鸡胚致病性试验 复苏冻存的分离株,12 000 r/min 离心收集菌体,用PBS 重悬菌体,经卵黄囊接种于7 日龄SPF 鸡胚,每个分离菌株共接种3 枚鸡胚,接菌量为5×105CCU/胚,另设3 枚鸡胚注射等量PBS 作对照。鸡胚置37 ℃继续孵化,每日观察并记录鸡胚死亡情况,对死亡鸡胚剖检,分别采集死亡鸡胚尿囊液、卵黄囊、胚体和肝组织,用酚氯仿法提取DNA,使用1.4 的引物进行PCR 检测,从采集的组织中重新分离MS,方法同1.5。
1.9 分离株vlhA 基因的PCR 扩增及遗传进化分析将分离的MS 煮沸提取DNA,使用MSF/MSR 引物进行PCR 鉴定。采用丁美娟等[9]设计的引物:F:5'-GC CATTGCTCCTGCTGTTATA-3'/R: 5'-GGGTAGTCCACT CGCATT-3',PCR 扩增MS VlhA 基因片段,预期目的片段大小为773 bp,产物经测序鉴定。对扩增的vlhA 基因序列和GenBank 参考株相应基因序列进行同源性和系统进化分析。
2 结 果
2.1 部分发病鸡临床症状及剖检病变 疑似感染MS 的病鸡临床表现为行动障碍、卧地不起、跗关节、胸部滑液囊肿大。剖检可见跗关节腔、胸部滑液囊、爪垫有淡黄色分泌液或黄色干酪样分泌物。初步怀疑该场病鸡感染了MS。
2.2 临床样本的PCR 检测结果 以采集的75 份疑似MS 感染病鸡的咽拭子、胸部滑液囊、跗关节、腿鞘和脚底脓肿组织和分泌物样本的DNA 为模板,对其进行PCR 鉴定。结果显示,75份样本中MS核酸阳性样本为31 份,阳性率为41.33%(31/75),15 个疑似感染MS 鸡场中11 个鸡场PCR 检测阳性,场阳性率73.33%(11/15)。部分样品的PCR 扩增结果如图1。表明川西地区肉鸡场存在较高的MS 感染率。

图1 部分待检样本的PCR 扩增结果Fig.1 PCR amplification results of some samples for test
2.3 分离株菌落及菌体形态观察 对PCR 检测为阳性的样本进行MS 分离,培养至5 d 时可在低倍镜下看到固体培养基上形成的“煎蛋样”菌落(图2 A);MS 分离株经瑞氏染色后油镜下观察可见圆形或椭圆形菌体(图2 B);挑取单菌落至液体培养基培养,2 d 后培养基颜色变黄。结果表明分离的病原可能为MS,从11 个PCR 阳性鸡场中的3 个鸡场共分离到9 株病原菌,分别命名为SMU-SCPS-LF1/2018、SMU-SCPS-LF2/2019、 SMU-SCYA-LF1/2019、 SMUSCPS-LF3/2018、SMU-SCPS-LF4/2018、SMU-SCPSLF5/2018、 SMU-SCPS-LF6/2018、 SMU-SCPS-LF7/2018、SMU-SCPS-LF8/2018,其中SMU-SCPS-LF2/2019、SMU-SCYA-LF1/2019 分离自两个不同鸡场,其余7 株分离自同一个鸡场。

图2 分离菌SMU-SCPS-LF2/2019菌落形态(A)及菌体形态(B)Fig.2 Colony morphology(A)and cell morphology(B)of isolate SMU-SCPS-LF2/2019
2.4 分离菌株吸附鸡红细胞试验结果 对固体培养基上的分离株菌落进行鸡红细胞吸附试验,显微镜40 倍放大观察可见菌落上吸附的鸡红细胞(图3),表明分离菌对红细胞有吸附能力。
2.5 分离株生长滴度测定(CCU)结果 将MS分离菌分别用改良Frey 氏液体培养基经10 倍倍比稀释后培养,每日观察颜色变化,观察至第14 d。结果显示,3个鸡场9 株分离菌株的活菌数分别为104CCU/mL~106CCU/mL,以SMU-SCYA-LF1/2019、SMU-SCYALF5/2018 两株的活菌数相对最高,为106CCU/mL(表2)。
2.6 鸡胚致病性试验结果 分离株以5×105CCU 接种7 日龄SPF 鸡胚,鸡胚于接种后7 d~9 d 均死亡,阴性对照未死亡,死亡鸡胚尿囊液、卵黄囊、胚体和肝组织经PCR 检测均能检测到MS,且均分离回收到了接种菌株。剖检发现死亡鸡胚肝脏出血,表明分离株具有较强的致病性。
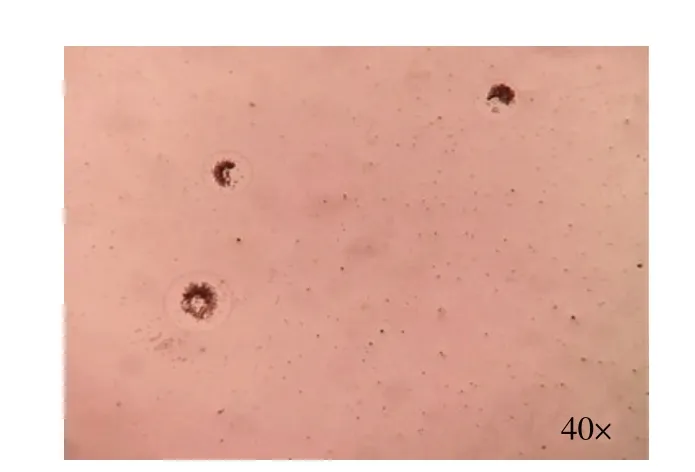
图3 分离菌SMU-SCPS-LF2/2019 的鸡红细胞吸附试验结果Fig.3 Chicken hemadsorption test results for isolate SMU-SCPS-LF2/2019

表2 MS 分离株活菌计数结果Table 2 Results of viable bacterial count of 9 isolates
2.7 分离菌株VlhA 基因的PCR 扩增及其遗传进化分析 以提取的MS 分离菌株的DNA 为模板,使用MSF/MSR 引物进行PCR 鉴定。结果显示,9 株分离菌株经PCR 扩增均出现目的条带(图4)。表明9 株分离菌均为MS。

图4 MS 分离株VIhA 基因的PCR 扩增结果Fig.4 The amplication results of VIhA gene in MS isolates by PCR
9 株MS 分离株VlhA 基因测序结果与GenBank 参考株相应基因序列的同源性分析结果显示,9 株分离株之间的同源性为86.1%~99.9%,与参考株的同源性为86.2%~95.4%,分离自同一个鸡场的7 株MS之间的同源性为96.4%~99.9%,与分离自另外两个鸡场的两株MS 同源性为85.5%~90.8%,同源性分析结果表明MS 分离株变异较大。
经MEGA 软件构建的9 株MS 分离株与GenBank登录的MS 参考株VlhA 基因系统进化分析结果显示,分离自2 个不同鸡场的分离株SMU-SCYA-LF1/2019、SMU-SCPS-LF2/2019 和GenBank 中 登 录 的 中国分离株聚为一小支,与本研究中采用的参考株GX11-T 聚为一大支,亲缘关系最近;分离自同一鸡场的7 株MS 菌株与伊朗乌尔米耶、伊朗克尔曼和以色列分离株聚为1 支(图5)。系统发育分析表明:川西地区MS 流行菌株既有与中国流行株亲缘关系较近的菌株,也有与国外流行株亲缘关系较近的菌株,亲缘关系复杂。

图5 MS 分离株VlhA 基因进化树Fig.5 Phylogenetic tree of VlhA gene of MS isolates
3 讨 论
鸡滑液囊支原体病通常采用血清学、微生物学或分子生物学诊断方法[10-11]。血清学方法成本相对较低,但特异性或敏感性不足,分离鉴定法费时费力[12]。以PCR 为基础的分子检测方法因操作简单、特异、快速、灵敏,被广泛应用。因此本研究采用PCR 方法对采集的咽拭子及病变明显的关节滑液囊组织样本共75 份进行检测,PCR 阳性检出率仅为41.33%,分析原因一方面在于部分样品中MS 含量过低导致普通PCR 无法检出,另一方面虽然在病理剖检时观察到腿部关节及胸部滑液囊有明显的病变,PCR 却未能检测到MS,可能与检测前已经长时间用药有关,虽然药物对MS 已经产生杀灭作用并清除了MS,但MS 对机体已经造成了不可逆的损害,所以依然可见明显的病变。有研究显示,MS与多种病原有协同作用,如鸡毒支原体、金黄色葡萄球菌、败血性沙门氏菌、链球菌、大肠杆菌、传染性支气管炎病毒、禽流感病毒、呼肠孤病毒、新城疫病毒和传染性喉气管炎病毒等[13],这些病原的混合或继发感染,可导致MS 感染程度加重,同时也增加了MS 分离的难度。本研究未对上述病原进行鉴定,不能排除以上病原的感染或其与MS 的混合感染。
分离培养被认为是检测MS 感染的“金标准”,但其费时费力,特别是在混合感染的情况下。一般情况下,MS 分离培养的阳性结果可在4 d~7 d 内获得,但阴性结果最多需要30 d[14]。本研究从31 份PCR 检测阳性的样本中仅分离出9 株MS,分离率仅为29.03%。分析分离率低的原因可能是因感染组织中病程过长等原因致使MS 活菌含量低,同时也有可能样本在运输保存过程中MS 已经失活,最重要的原因可能是所选择的培养基并不适合所有MS 的分离培养。有文献报道,MS 生长过程中需要NAD等特殊生长因子[15],同时采样时或样品中混合的其他对营养要求不高的细菌的生长会掩盖MS 的生长,导致无法分离获得MS[13]。因此,影响MS 分离的因素很多,通过分离鉴定MS 来达到诊断MS 感染的目的显然不如PCR 方法,基于此,本研究先采用PCR 对临床可疑样本进行检测,再有针对性地对PCR 阳性样本进行MS 分离鉴定,本研究分离获得9株MS 菌株,为进一步开展MS 病原学及免疫学相关研究奠定了物质基础。
VlhA 基因是MS 的一个重要毒力基因,其编码VlhA 蛋白,该蛋白由两个可变的细胞表面蛋白组成,即可变脂蛋白(MSPB)和可变血凝素蛋白(MSPA),介导MS 粘附、侵袭和免疫逃避[16]。VlhA 基因具有很强的特异性,但其编码的MSPB 和MSPA 均具有较高的抗原变异性,是目前MS 遗传进化分析采用最多的靶基因[9,17]。本研究利用PCR 扩增获得分离株VlhA基因目的片段,对其测序分析并绘制9 株分离株与GeneBank 登录的MS 参考菌株的进化树,结果两株不同鸡场来源的分离株SMU-SCYA-LF1/2019、SMUSCPS-LF2/2019 同源性仅89.8%,同源性不高,但其与中国分离株同属一个分支,且与四川分离株KU572311.1 亲缘关系最近;其余7 株分离自同一个鸡场的分离株的同源性为96.4%~99.9%,同源性高,但与其他两株不同鸡场分离株以及四川和中国其他地区分离株存在较远的遗传距离,而与中东地区分离的3 株MS 亲缘关系较近,应为新的川西地区流行株。川西部分地区肉鸡场MS 分离株的获得及其VlhA 基因遗传进化分析揭示了川西部分地区肉鸡场MS 的来源及其变异情况,为进一步开展MS 的病原生物学及免疫学相关研究奠定基础。

