猪链球菌蛋白表面展示系统的构建及展示蛋白的初步观察
黄萌萌,刘 冉,陈 平,朱金鲁,卫 东,谢 芳,李 刚,刘思国,张跃灵
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
通过细菌表面展示系统展示外源抗原,是制备多联疫苗、实现一苗多防的有效手段[1-2]。研究显示,在革兰氏阳性细菌中有一类锚定于细胞壁的LPxTG 蛋白,其N 端有信号肽(Signal peptide,SP)序列,C 端有胞壁锚定基序(Cell wall anchor motif,CWA),CWA 由LPxTG 序列(x 为任意氨基酸)和一段带正电荷的尾巴组成。其细胞壁锚定机制如图1 所示,全长的前体蛋白(Pre-protein)产生于细胞内,信号肽酶(Signal peptidase)识别SP 并切割,产生中间体蛋白(Intermediate protein)。中间体蛋白被转运至细胞膜外,但是其C 端被正电荷固定在细胞膜上。位于细胞膜上的分选酶A(Sortase A,SrtA)识别LPxTG 序列,催化T 和G 之间的肽键断裂,并将产生的末端T共价连接到细胞壁的肽聚糖上,最终产生共价锚定于细胞壁的成熟蛋白(Mature protein)(图1)[3-5]。
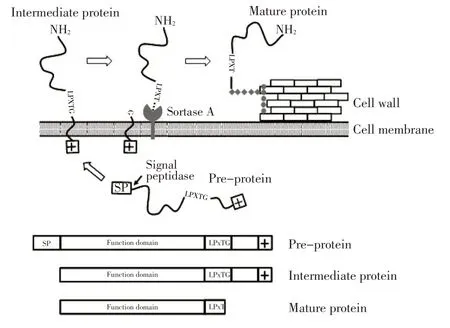
图1 LPxTG 蛋白表面锚定原理及3 种蛋白状态Fig.1 Surface anchoring principle of LPxTG protein and its three states
这种LPxTG 蛋白和锚定机制广泛存在于革兰氏阳性细菌中[6]。进一步研究发现,可以利用外源蛋白替换LPxTG 蛋白的功能区(Function domain),实现外源蛋白在特定革兰氏阳性菌表面的锚定[7]。利用这一机制,Dieye 等人采用乳酸菌Usp45 蛋白的SP 和化脓链球菌(S.pyogenes)M6 蛋白的CWA,将葡萄球菌核酸酶Nuc 展示在乳酸乳球菌(Lactococcuslactis)和4 种乳杆菌(Lactobacillus)的表面[7]。这种蛋白表面展示因为是共价结合,稳定性好,而且锚定于细胞壁,能更好地激起机体免疫反应,在表面展示外源抗原、制备多联疫苗方面具有巨大的应用潜力。Cortes-Perez 等人发现,SP 或CWA 序列在蛋白表面展示方面有一定的种属特异性,例如化脓链球菌M6 蛋白的CWA 无法在植物乳杆菌(L. plantarum)表面展示外源蛋白,而替换为植物乳杆菌自身LPxTG蛋白的CWA 时,则能够实现表面展示[1]。因此,要在特定革兰氏阳性菌中展示外源蛋白,必须筛选和鉴定其自身LPxTG 蛋白的SP 和CWA 信号序列。
猪链球菌是一种重要的猪病病原[8-9],且为革兰氏阳性细菌,目前尚无猪链球菌表面展示外源蛋白的报道。本研究通过分析猪链球菌的LPxTG 蛋白及其SP 和CWA 序列,以GFP 为报告基因,构建了猪链球菌的蛋白表面展示系统,并初步观察了其展示蛋白,为猪链球菌表面递呈外源蛋白或抗原提供了新的思路和策略。
1 材料与方法
1.1 主要实验材料 猪链球菌2 型05ZYH33 菌株,为中国2005 年四川流行分离株[8]。大肠杆菌MC1061F-感受态细胞购自上海唯地生物技术有限公司;THB 培养基和LB 培养基购自美国BD 公司;LB(SPC)、THB(SPC)分别为添加100 μg/mL 壮观霉素(SPC)的LB 和THB 培养基;质粒pSET2 由Daisuke Takamatsu 教授惠赠;PrimeSTAR Max DNA 聚合酶购自宝生物工程(大连)有限公司;PCR 产物纯化试剂盒和DNA 胶回收试剂盒购自OMEGA 公司;细菌基因组DNA 提取试剂盒、山羊抗兔IgG-HRP 和质粒小提试剂盒购自TIANGEN 公司;限制性内切酶和T4 DNA 连接酶购自Thermo Scientific 公司;抗GFP 抗体购自GeneTex 公司。
1.2 LPxTG 蛋白的确定及其序列分析 根据文献报道,已经证实SSU05_0196 为LPxTG 蛋白[10]。采用其CWA 序列,经BLAST 分析,初步确定候选LPxTG蛋白。分别利用TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP-5.0 软件(http://www.cbs.dtu.dk/services/SignalP/)进一步分析其跨膜区和SP。C 末端的CWA 特征序列则通过观察是否具有LPxTG 氨基酸序列和3 个以上正电荷氨基酸(精氨酸和赖氨酸)来确定。猪链球菌强启动子Peno参见文献[11],长度为197 bp。
1.3 引物的设计与合成 根据gfp 基因和LPxTG 蛋白基因序列,设计扩增gfp、Peno-SP-10aa、10aa-CWA 序列的引物见表1,由哈尔滨博仕生物公司合成。
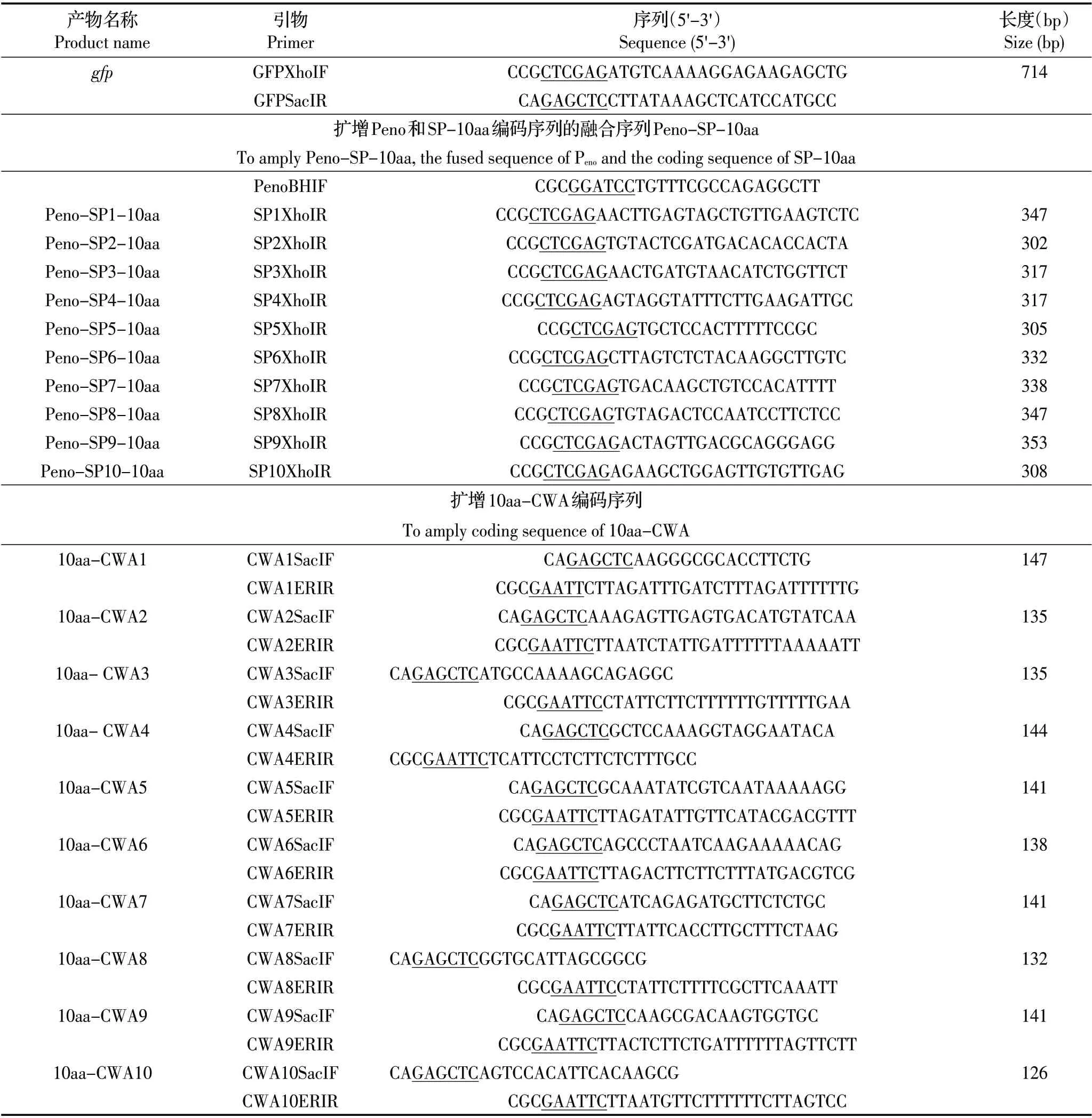
表1 实验所用引物信息Table 1 Primers used in this study
1.4 SP、GFP、CWA 编码DNA 片段的扩增和融合本研究采用的强启动子Peno和编码SP、GFP、CWA的DNA 片段融合策略如图2 所示。LPxTG 蛋白的SP及其下游10 个氨基酸(SP-10aa)和CWA 及其上游10个氨基酸(10aa-CWA)的编码序列由猪链球菌05ZYH33 的 基 因 组(CP000407.1)获 得。gfp 基 因(KF410617)由BGI tech 公司合成后作为模板,以GFPXhoIF 和GFPSacIR 为引物,扩增获得两端含有Xho I/Sac I酶切位点的gfp基因片段。Peno序列融合于各SP-10aa编码序列起始密码子前,序列由BGI tech公司合成,再以表1 中相应的引物,分别扩增Peno-SP1-10aa 至Peno-SP10-10aa 的DNA 片 段。以05ZYH33 的基因组DNA 为模板,以表1 中CWA1SacIF/CWA1ERIR至CWA10SacIF/CWA10ERIR为引物,扩增获得10aa-CWA1 至10aa-CWA10。以构建Peno-SP1-GFP-CWA1融合片段为例,胶回收gfp、Peno-SP1-10aa 和10aa-CWA1 片段,以摩尔比1∶1∶1 混合后Xho I/Sac I 双酶切。回收酶切产物,采用T4 连接酶进行连接,连接产物作为模板,以PenoBHIF/CWA1ERIR 为引物,扩增获得编码Peno 控制SP1-GFP-CWA1 融合蛋白表达的DNA 片段Peno-SP1-GFP-CWA1。同样方式,采用表1 中对应编号的引物,获得融合DNA 片段Peno-SP2-GFP-CWA2 至Peno-SP10-GFP-CWA10,共计构建10 个Peno-SP-GFP-CWA 融合DNA 片段。
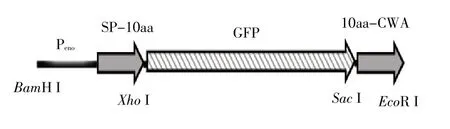
图2 启动子Peno和蛋白各片段融合策略Fig.2 Fragment fusion strategy for Peno promoter,SP sequence and CWA sequence
1.5 蛋白表面展示质粒的构建 构建的Peno-SP1-GFP-CWA1 至Peno-SP10-GFP-CWA10 融 合DNA 片段经过BamH I/EcoR I 双酶切后分别连接同样酶切处理的pSET2 载体,转化大肠杆菌MC1061F-。以pSETseqF(5'-AACTGTTGGGAAGGGCGA-3')/pSETseqR(5'-GTGGAATTGTGAGCGGATAA-3')为引物,利用菌液PCR 鉴定阳性克隆,由BGI tech 公司测序鉴定,含有正确Peno-SP-GFP-CWA 融合DNA 片段的阳性克隆为正确构建的蛋白表面展示质粒,根据其来源LPxTG 蛋白编号,分别命名为pSsPSD1 至pSsPSD10。
1.6 蛋白表面展示质粒转化猪链球菌05ZYH33提取上述蛋白表面展示质粒,采用文献[12]的方法转化猪链球菌05ZYH33 菌株,涂布THB(SPC)平板,37 ℃,5%CO2过夜培养,获得含有相应蛋白表面展示质粒的猪链球菌05ZYH33 株。采用pSETseqF/pSETseqR 为引物进行菌液PCR 鉴定其是否含有pSsPSD1 至pSsPSD10 对应质粒,阳性菌株根据对应质粒编号进行命名。
1.7 猪链球菌05ZYH33 转化阳性菌株的GFP 表达检测 将蛋白表面展示质粒转化阳性菌株分别接种THB(SPC)液体培养基,37 ℃,5%CO2过夜培养,取5 μL 点样THB(SPC)固体平板,37 ℃,5%CO2培养48 h 后观察绿色荧光。其余液体培养基离心,弃上清后,以转化pSET2 载体的05ZYH33 株作为对照,通过观察菌体绿色荧光分析GFP 表达情况。
1.8 猪链球菌05ZYH33 转化阳性菌株展示蛋白的初步观察 根据图1 所示的原理并参考文献报道的LPxTG 蛋白表面展示结果[7],本研究构建的表面展示系统产生的GFP 存在3 种状态,分别是前体蛋白、中间体蛋白和成熟蛋白。采用western blot,以胞壁锚定的成熟GFP 条带为指标,可以初步观察蛋白表面展示质粒转化阳性菌株的GFP 展示水平。本研究根据https://web.expasy.org/protparam/网站,计算GFP前体蛋白、GFP 中间体蛋白和GFP 成熟蛋白的分子量。将猪链球菌转化阳性菌株分别接种THB(SPC)液体培养基,37 ℃培养至OD600nm0.4、0.6、0.8、1.0和1.2 时离心收集菌体,超声破碎。获得的菌体蛋白测定浓度后,SsPSD1、SsPSD2、SsPSD4、SsPSD8、SsPSD9 每泳道上样30 μg,SsPSD7、SsPSD10 每泳道上样60 μg,以兔GFP 多克隆抗体(1∶15 000)为一抗,羊抗兔抗体IG-HRP(1∶5 000)为二抗,进行western blot 鉴定。根据计算的GFP 前体蛋白、中间体蛋白和成熟蛋白的分子量,采用ImageJ 软件对相应蛋白条带进行灰度分析,确定3 种状态GFP 蛋白的量。以3 个状态GFP 蛋白的总量粗略表示GFP 蛋白的表达总量,以GFP 成熟蛋白的量,反映GFP 表面展示水平,从而初步观察构建的蛋白表面展示质粒转化阳性菌株的蛋白表面展示水平。
2 结 果
2.1 猪链球菌05ZYH33 株LPxTG 蛋白序列分析以SSU05_0196 的CWA 序列对猪链球菌05ZYH33 菌株基因组进行PHI-BLAST,根据N 端和C 端均含有跨膜区,N 端具有SP 序列和C 端具有CWA 特征序列的原则,分析获得表2 所示的10 种LPxTG 蛋白,其中有4 种已有文献报道了其功能,并确认其为胞壁锚定蛋白。本文依次将其标记为1~10号LPxTG蛋白。
2.2 SP、GFP、CWA 的编码DNA 片段的扩增和融合 根据上述蛋白的基因序列和表1 的引物,分别扩增获得gfp 基因片段(图3A)、10 个Peno和SP 融合的片段Peno-SP-10aa(图3B 上)和10 个CWA 片段10aa-CWA(图3B 中),电泳检测结果显示各片段均与预期符合(表1)。获得的gfp、Peno-SP-10aa 和10aa-CWA 片段进行酶切、连接后PCR融合扩增DNA片段Peno-SP-GFP-CWA,PCR 鉴定结果如图3B 所示,各片段大小与预期的1 100 bp~1 200 bp 大小相符合,表明获得了10 个Peno、SP、gfp 和CWA 融合片段Peno-SP1-GFP-CWA1~Peno-SP10-GFP-CWA10。
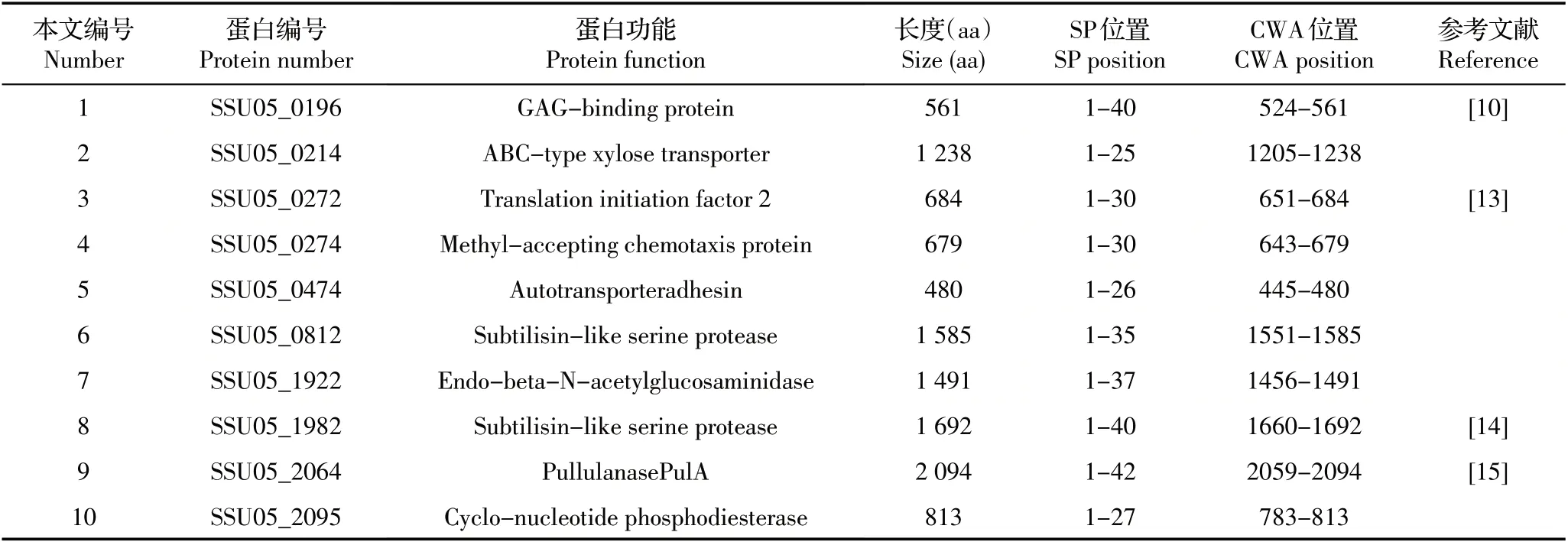
表2 通过序列分析确定的05ZYH33 株LPxTG 蛋白Table 2 LPxTG protein of strain 05ZYH33 determined by sequence analysis
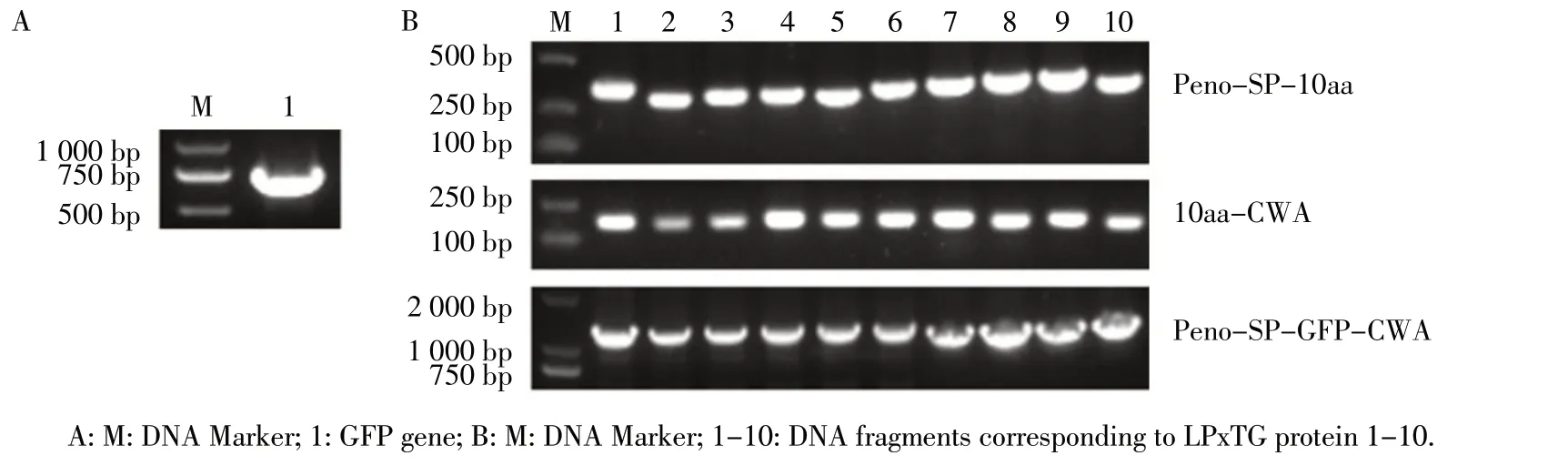
图3 DNA 片段的扩增和融合Fig.3 Amplification and fusion of DNA fragments
2.3 蛋白表面展示质粒的构建 上述10 个Peno-SPGFP-CWA 融合DNA 片段分别胶回收后,经BamH I和EcoR I 双酶切克隆至pSET2 质粒中,PCR 检测结果显示扩增片段大小均与预期符合(图4),进一步测序显示插入片段正确,表明10 个蛋白表面展示质粒正确构建,分别命名为pSsPSD1~pSsPSD10。
根据表达策略,这10 个蛋白表面展示质粒表达的蛋白序列GFP 上下游分别融合了10 个LPxTG 蛋白的SP 区和CWA 区,不同蛋白来源的SP 和CWA 在序列和长度上均存在显著差异。除了SP 和CWA 序列,另外还有SP 下游10 个氨基酸和CWA 上游10 个氨基酸分别作为SP 和GFP、GFP 和CWA 之间的铰链区,另外,因为加入Xho I 和Sac I 酶切位点,在GFP上游和下游各引入了2 个氨基酸(图5)。
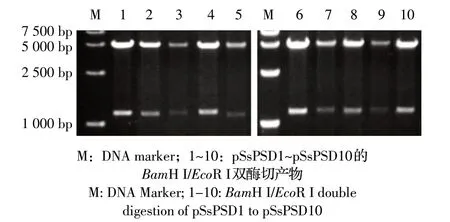
图4 蛋白表面展示质粒酶切鉴定Fig.4 Identification of protein surface display plasmids by restriction enzyme digestion

图5 构建的猪链球菌蛋白表面展示质粒表达的GFP 融合蛋白序列Fig.5 Sequence of GFP fusion proteins expressed by the constructed S.suis protein surface display plasmids
2.4 蛋白表面展示质粒转化猪链球菌05ZYH33上述蛋白表面展示质粒分别转化猪链球菌05ZYH33菌株,pSsPSD3 多次尝试未获得转化菌株,其余9 个质粒经转化获得了猪链球菌克隆。但是以pSETseqF/pSETseqR 为引物,菌液PCR 鉴定显示,pSsPSD5 和pSsPSD6 无对应的阳性质粒片段,其余7 个均含有对应的阳性质粒片段(图6);经测序验证结果显示这7个阳性质粒插入序列正确。表明获得7 个猪链球菌转化阳性菌株,根据对应质粒编号,依次命名为SsPSD1、SsPSD2、SsPSD4、SsPSD7、SsPSD8、SsPSD9、SsPSD10。

图6 猪链球菌05ZYH33 转化株PCR 鉴定Fig.6 PCR identification of S.suis 05ZYH33 transformed strain
2.5 猪链球菌05ZYH33 转化阳性菌株的GFP 表达检测 将猪链球菌转化阳性菌株接种THB(SPC)液体培养基过夜培养,分别通过点样THB(SPC)固体平板和离心收集菌体观察绿色荧光。结果显示,7个转化阳性菌株的菌苔和离心菌体均能够观察到绿色荧光(图7),表明在Peno 启动子控制下,7 个转化阳性菌株的均能有效表达GFP。
2.6 猪链球菌05ZYH33 转化阳性菌株展示蛋白的初步鉴定 利用网站https://web.expasy.org/protparam/计算3 种状态GFP 的分子量分别为34.9 ku~36.9 ku、32.1 ku~33.0 ku 和28.7 ku~29.0 ku(表3)。同一状态时分子量的差异主要是不同蛋白的SP、CWA 和铰链区的氨基酸组成不同造成的。

图7 猪链球菌转化阳性菌株GFP 表达的荧光观察Fig.7 Fluorescence observation of GFP expression in S.suis transformation positive strains

表3 GFP 蛋白3 种状态的计算分子量Table 3 Calculated molecular weights of three GFP states
采用western blot 检测7 个猪链球菌阳性菌株中GFP 前体蛋白、中间体蛋白和成熟蛋白的表达情况,结果显示,与GFP 荧光观察结果一致,7 个猪链球菌阳性菌株中均能观察到GFP 表达,并存在GFP 前体蛋白、中间体蛋白和成熟蛋白3 种状态,大小分别对应于表3 的计算分子量(图8)。
采用ImageJ 软件对图8 结果进行灰度分析,首先分析了处于不同生长时期时成熟GFP 蛋白的产生情况,结果显示7 个转化阳性菌株均表现为对数生长期(OD600nm0.4~0.8)成熟GFP 蛋白产生较多,培养至稳定期(OD600nm1.2)后GFP 成熟蛋白的产生量明显减少(图8,图9A)。比较分析OD600nm值0.6 时各转化阳性菌株的GFP 表达总量和成熟GFP 的量,结果显示, SsPSD1 和SsPSD9 的GFP 表达总量最高,SsPSD8、SsPSD4 和SsPSD2 次之,SsPSD7 和SsPSD10最低;成熟GFP 蛋白的量则属SsPSD1、SsPSD8 和SsPSD9 最 高,SsPSD2 和SsPSD4 次 之,SsPSD7 和SsPSD10最低(图9B)。表明SsPSD1、SsPSD9、SsPSD4和SsPSD8阳性转化菌株表面展示GFP的能力最好,在猪链球菌表面展示外源蛋白方面具有很好的潜力。
另外,对比GFP 蛋白3 种状态的比例,结果显示,SsPSD1、SsPSD4、SsPSD7 和SsPSD10 呈现出前体蛋白(44%~66%)、中间体蛋白(19%~31%)和成熟蛋白比例(15%~21%)依次降低的趋势,表明它们的SP 和CWA 的切割效率偏低,不能有效地将GFP 前体蛋白加工为中间体蛋白,也不能有效地将中间体蛋白加工为成熟蛋白,造成GFP 前体蛋白和中间体蛋白的积累(图8,图9)。SsPSD8 则中间体蛋白很少积累(11%),成熟蛋白比例较高(31%),这表明来 自LPxTG 蛋 白SSU05_1982 的CWA 易 被SrtA 识 别和切割,从而将更多的中间体蛋白加工为成熟蛋白。而SsPSD2 前体蛋白几乎无积累(7%),中间体蛋白比例(72%)远高过其它转化阳性菌株(19%~31%),表明来自LPxTG 蛋白SSU05_0214 的SP 易被信号肽酶识别和切割,从而将更多的前体蛋白加工为中间体蛋白。

图8 转化阳性菌株不同生长期3 种不同状态的GFP 的western blot 检测Fig.8 Western blot detection of three different states of GFP in transformation positive strains at different growth stages
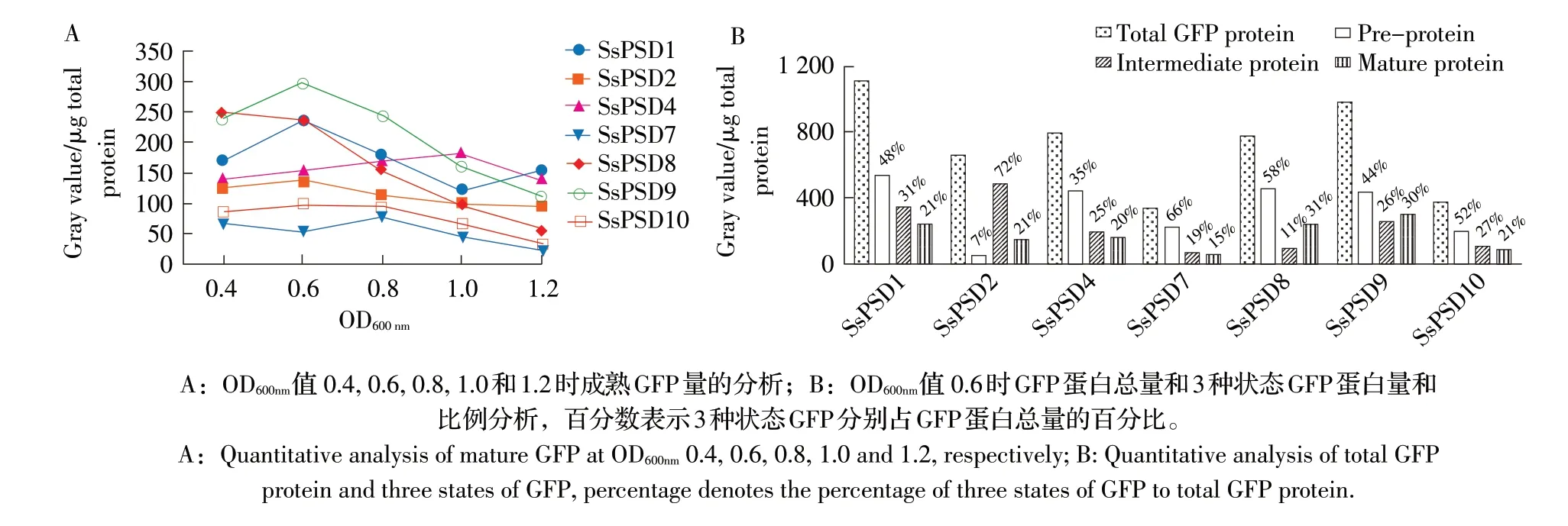
图9 猪链球菌蛋白表面展示系统GFP 的定量分析Fig.9 Quantitative analysis of GFP in S.suis protein surface display systems
3 讨 论
LPxTG 蛋白的SP 和CWA 信号表面展示外源蛋白的功能一经发现,就引起了研究者广泛的兴趣,但目前尝试较多的是将外源抗原展示于乳酸菌的表面[1,2,16]。如果将外源抗原展示于潜在疫苗菌株,则有可能实现制备多联疫苗、一苗多防,是多联疫苗菌株制备的新思路,而目前还很少有这方面的探索和报道。基于猪链球菌是一个重要的猪病病原,注射疫苗是预防猪链球菌感染的主要手段[17-18],本研究采用猪链球菌LPxTG 蛋白的SP 和CWA 信号,构建了7 个猪链球菌蛋白表面展示系统,其中4 个表现出较高的蛋白表面展示水平,具有在猪链球菌表面展示外源蛋白的潜力,从western blot 中成熟蛋白的比例来看,与报道的乳酸菌表面展示水平相当[7]。
目前构建的基于LPxTG 蛋白的SP 和CWA 的蛋白表面展示系统将蛋白展示到表面的水平,与某些菌株内源LPxTG 蛋白的展示水平还有很大差距。比如金黄色葡萄球菌LPxTG 蛋白之一蛋白A,western blot 结果显示其在金黄色葡萄球菌中以成熟锚定蛋白比例最高,大约为3 种蛋白状态总和的70%[19],而目前的表面展示系统,成熟外源蛋白不足3 种状态总和的35%[7]。这一方面可能是SP 和CWA 信号对外源蛋白的兼容性不及内源蛋白,这需要进一步研究LPxTG 蛋白的锚定机制,全面了解LPxTG 蛋白锚定的影响因素,再对症加以解决;另一方面可能是在SP 或CWA 和外源蛋白之间引入的铰链区太短,造成信号肽酶或SrtA 识别不充分,切割效率低,这可以通过尝试不同长度的铰链区来改善[2];再一方面,根据本研究结果,不同SP 和CWA 序列的切割效率不同,暗示可以通过重组效率高的SP 和CWA区,例如本研究中SsPSD2 的SP 和SsPSD8 的CWA,从而规避限速步骤,增加成熟蛋白的比例,提高表面展示水平。目前本实验室正在尝试从这几个方面改进猪链球菌蛋白表面展示系统的展示水平。另外,本研究在制备蛋白表面展示质粒,用于转化猪链球菌时,发现质粒普遍产量偏低,尤其是pSsPSD3,尝试数次难以获得足量的pSsPSD3,因此未获得pSsPSD3 的阳性转化菌株;pSsPSD5 和pSsPSD6 虽然获得了转化菌株,但是检测却未发现目的片段,这3 个质粒的制备、转化和表面展示能力的观察目前正在进一步的尝试中。
最后,对于评价蛋白表面展示系统的方法,虽然通过western blot 检测成熟蛋白的产生和产量被多个文献采用[1,19],且有一定的参考意义,但是具体的表面展示水平还要采用菌体ELISA、菌体组分western blot 以及免疫显微技术进一步定位表面蛋白。但是由于猪链球菌表面存在荚膜,给表面蛋白的检测造成了一定的困难,目前本实验室正在进行条件摸索,以期更好地定量猪链球菌蛋白表面展示系统的展示水平。
综上所述,本研究通过DNA 重组并转化猪链球菌,得到7 个猪链球菌蛋白表面展示系统。这7 个猪链球菌蛋白表面展示系统均表现出一定表面展示成熟GFP 的能力,其中SsPSD1、SsPSD9、SsPSD4 和SsPSD8 蛋白表面展示水平较高。本研究为猪链球菌表面展示外源蛋白或抗原提供了很好的基础和重要的参考。

