河北省犊牛腹泻大肠杆菌致病性及耐药性分析
刘勃兴,赵安奇,柳翠翠,刘 畅,李 浩,高桂生,吴同垒,史秋梅,张志强
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛 066004)
致犊牛腹泻病的病原有很多,其中大肠杆菌占据相当比重[1]。犊牛大肠杆菌病,又称牛白痢,是威胁犊牛健康生长的主要疾病,具有较高的发病率与死亡率[2]。该病临床表现为严重腹泻,有时会排出含有凝乳块稀粪,并发呕吐,出现脱水症状,病情严重时甚至会导致死亡[3]。患病犊牛的生长发育缓慢,生产性能降低,对肉牛和奶牛养殖造成严重的经济损失。
大肠杆菌是一种条件性致病菌,不同的致病菌株所携带的毒力基因存在一定的差异[4]。毒力岛(Pathogenicity island,PAI)是细菌染色体上负责编码毒力相关基因的不稳定DNA 片段,是某些细菌为适应生存环境变化而进化获得的毒力基因[5]。在致病大肠杆菌中,肠细胞脱落位点毒力岛(Locus of entericyteeffacement,LEE)和耶尔森菌强毒力岛(High pathogenicity island,HPI)是十分重要的毒力基因[6-7],在细菌感染发病过程起重要作用。
目前大肠杆菌的治疗还是以抗生素类药物为主[8],但随着抗生素的使用不当,大肠杆菌耐药谱和耐药水平不断提高,有报道在犊牛上分离的大肠杆菌多重耐药的情况十分严重[9],导致临床治疗大肠杆菌所致犊牛腹泻病过程中,很多时候抗生素类药物达不到很好的治疗效果。因此,迫切需要筛选出有效的抗生素类药物以及开展大肠杆菌耐药性产生原因的研究。本研究对河北省临床分离到的50 株犊牛腹泻大肠杆菌的致病性及耐药性进行检测分析,以期为该地区大肠杆菌所致犊牛腹泻病的防治提供依据。
1 材料与方法
1.1 病料来源 从河北省石家庄、保定、承德、唐山、廊坊5 个市的牛场采集腹泻犊牛直肠拭子,经伊红美蓝培养基初步鉴定后,再通过细菌生化鉴定与16S rDNA 鉴定等,共计分离出50 株大肠杆菌。将分离纯化的大肠杆菌加甘油冻存。
1.2 主要试剂及实验动物 营养肉汤、伊红美蓝培养基,购自北京陆桥科技股份有限公司;药敏纸片,购自杭州天和微生物科技股份有限公司;D2 000 plus DNA Marker,购自中科瑞泰科技有限公司;2×TaqMaster Mix,细菌DNA 基因组提取试剂盒,购自康为世纪生物科技有限公司;质控菌株大肠杆菌ATCC25922 由河北省预防重点试验室提供。洁净级昆明小鼠,体重20±2 g,由北京维通利试剂动物有限公司提供。
1.3 PCR 模板的制备 将冻存的50 株犊牛腹泻大肠杆菌分别接种伊红美蓝培养基,37 ℃12 h,挑取有金属光泽的单菌落接种于营养肉汤培养基,置于37 ℃180 r/min 培养12 h。利用细菌DNA 基因提取试剂盒提取大肠杆菌的DNA,置于-20 ℃保存备用。
1.4 分离菌的致病性试验 将分离菌接种于营养肉汤培养基,37 ℃180 r/min 过夜培养,次日以1∶100的比例转接至营养肉汤,继续培养至对数期(OD600nm≈0.6),无菌PBS 洗涤2 次,采用腹腔注射方式感染小鼠,每只小鼠注射0.1 mL 对数期分离菌菌液(活菌数为1×107cfu),每株菌感染5 只小鼠。对照组注射同等体积的PBS。观察并记录小鼠发病及死亡情况,并剖检死亡小鼠,采集肝脏、脾脏、心血等器官并进行细菌的分离鉴定。
1.5 分离菌的HPI 和LEE 毒力岛基因检测 以提取的分离菌DNA 为模板,参照文献[10]报道合成HPI(irp2、fyuA),LEE(ler、eaeA)引物序列,采用PCR方 法 检 测 分 离 菌 株LEE(ler、eaeA)、HPI(irp2、fyuA)毒力基因,并对结果进行分析。PCR 扩增引物均由上海生工生物公司合成。
1.6 药物敏感性试验 参照美国临床和试验室标准协会(CLSI)的标准,采用KB 纸片法,对β-内酰胺类(氨苄西林、头孢曲松、阿莫西林),氨基糖苷类(阿米卡星、新霉素、卡那霉素),四环素类(多西环素、土霉素),氟喹诺酮类(环丙沙星、恩诺沙星),氯霉素类(氟苯尼考),大环内酯类(替米考星),磺胺类(磺胺间甲氧、磺胺二甲氧、复方新诺明) 7 类15 种抗生素药物进行药物敏感性试验,每株菌进行3 次重复。同时以大肠杆菌ATCC25922 为质控菌株。
1.7 分离菌的耐药基因检测 参考文献[11-13]合成四环素类(tetA、tetB、tetC、tetD),氨基糖苷类(strA-str-B、aadA1),大环 内酯 类(ermB、ermC、ermF),磺胺类(sul1、sul2、sul3),喹诺酮类(qnrA、qnrB、gyrA、gyrB),β-内 酰 胺 类(CTX-M、SHV)耐药基因引物序列,以提取的分离菌DNA 为模板,采用PCR 方法检测分离菌株耐药基因,并对结果进行分析。引物均由上海生工生物公司合成。
2 结 果
2.1 致病性试验结果 小鼠腹腔注射0.1 mL 菌液(活菌数为1×107cfu)或无菌PBS 后,对小鼠进行观察。结果显示,分离菌感染组小鼠后,小鼠精神萎靡,抱爪,蜷缩在笼角,呼吸紊乱。感染分离菌的50 组小鼠均有死亡,死亡率60%~100%。对照组小鼠无死亡,状态良好。对病死小鼠进行剖检,观察可见明显的败血症,其中肠道出血最为严重;对肝脏、脾脏、心血等进行细菌的分离,均分离到大肠杆菌。表明50 株分离菌均对小鼠具有致病力。
2.2 HPI 与LEE 毒力岛基因检测 通过PCR 方法检测分离菌的毒力基因,结果显示HPI 和LEE 毒力岛基因均有检出,irp2、fyua、ler、eaeA 基因检出率分别为:68%(34/50)、66%(33/50)、34%(17/50)、34%(17/50)。其中37 株检测到HPI 毒力岛基因,17株检测到LEE 毒力岛基因,仅4 株同时检测到HPI和LEE 两种毒力岛基因,HPI 毒力岛基因的检出率明显高于LEE 毒力岛基因的,两种毒力岛同时携带的菌株较少(表1,图1)。

表1 分离菌的HPI、LEE 毒力岛基因检出率Table 1 Detection rate of HPI and LEE virulence island genes in isolated bacteria
2.3 药物敏感性试验 采用KB 纸片法进行药物敏感性试验,参考CLSI 药敏试验标准对结果进行判定,试验结果显示:分离大肠杆菌对β-内酰胺类抗生素氨苄西林、头孢曲松、阿莫西林敏感度较高,敏感率52%~70%。对大环内酯类抗生素替米考星耐药率最高,高达100%(50/50)(表2)。试验选取的15 种抗生素药物中有9 种药物耐药率在50%以上,而敏感率在50%以上的只有4 种。统计每株菌对试验的15 种药物耐药情况,结果显示,50 株分离菌均对2 种以上抗生素表现耐药(50/50),对8 种药物耐药的菌株最多,占24%(12/50)(图2)。表明,河北省犊牛腹泻大肠杆菌多重耐药性严重,替米考星、土霉素、阿米卡星等9 种抗生素药物耐药率在50%以上,不推荐在临床上继续使用。

图1 3 株分离菌HPI、LEE 毒力岛基因检测结果Fig.1 Amplification of virulence Island genes of HPI and LEE in 3 isolates
2.4 耐药基因检测 采用PCR 方法对6 类抗生素药物耐药基因进行检测,结果显示,四环素类tetA、tetB、tetC、tetD 检出率分别为10%、24%、100%、0;氨基糖苷类strA-str-B、aadA1 检出率分别为18%、100%;大环内酯类ermB、ermC、ermF 检出率分别为32%、20%、36%;磺胺类sul1、sul2、sul3检出率分别为28%、28%、12%;喹诺酮类qnrA、qnrB、gyrA、gyrB 检出率分别为36%、6%、100%、100%;β-内酰胺类CTX-M、SHV 检出率分别为22%、10%。除四环素类tetD 检出率为0,其它耐药基因均有不同程度检出,四环素类tetC、氨基糖苷类aadA1、喹诺酮类gyrA、gyrB 检测率高达100%(表2)。分离菌均携带4 种及以上耐药基因(图2)。结合2.3 结果分析,表明分离菌耐药基因与耐药性数据未体现出明显关联性。

表2 分离菌耐药基因检测率和药物敏感性试验结果Table 2 Detection rate of drug resistance genes and drug sensitivity test of the isolates
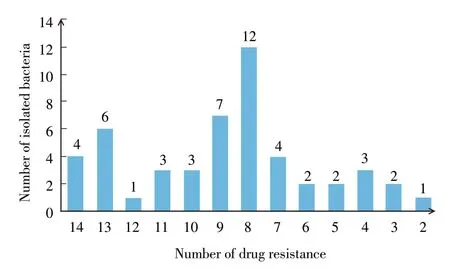
图2 分离菌多重耐药情况Fig.2 Multidrug resistance of the isolates
3 讨 论
大肠杆菌是一种条件性致病菌,犊牛由于免疫系统未完全发育,易感染大肠杆菌发病,临床症状以腹泻为主。2018 年1 月至2019 年6 月,本研究对河北省石家庄、承德、廊坊、保定、秦皇岛等市部分散养户和规模化肉牛养殖场进行调研,发现犊牛腹泻问题普遍存在,并对养殖户造成不同程度的经济损失。针对河北省肉犊牛腹泻病的现状,本研究采集河北省部分牛场的腹泻犊牛新鲜肛门拭子样品,共分离出50 株大肠杆菌。并以小鼠为动物模型进行致病性试验,结果显示,分离菌均可致小鼠死亡,说明分离菌均具有致病性,提示大肠杆菌是犊牛腹泻病诊断中不可忽略的重要病原。
在对致病性试验数据进行统计发现不同菌株的致病力不同,表现为小鼠死亡率不同。为探究该现象的产生原因,本研究进一步对与大肠杆菌致病力有关的LEE(eaeA、ler)和HPI(irp2、fyua)毒力岛基因检测,发现HPI 毒力岛基因检出率高达68%,LEE 毒力岛基因检出率为34%,HPI 毒力岛基因检出率高于LEE毒力岛基因。据孙武文报道,北方6 个省的犊牛腹泻大肠杆菌的HPI 阳性率为42.14%(59/140)[14],王姣姣报道,吉林省犊牛腹泻大肠杆菌HPI 检测阳性率为74%(55/74)[15],HPI 毒力岛基因检出率普遍较高,表明犊牛腹泻大肠杆菌的致病力与HPI 毒力岛基因可能有关。HPI 毒力岛最早是从耶尔森菌属发现,并且无毒或低毒菌株不携带HPI 毒力岛基因。有研究报道,HPI 主要含有铁摄取毒力基因簇,irp2 是HPI 毒力岛基因中一种铁调节基因,是HPI 毒力岛的标志性基因。fyuA 基因编码铁抑制外膜蛋白,该蛋白具有鼠疫杆菌素、耶尔森杆菌素双重受体的功能[10]。分离菌毒力岛基因携带情况较为复杂,且毒力基因数与致病性有一定关联,表现为携带基因较少的菌株小鼠致死率相对较低,但两者是否存在相关性还需要进一步研究。
为了指导临床用药,本研究对分离菌进行药物敏感性试验,试验结果表明50 株分离菌耐药情况不容乐观。试验选取临床治疗中常用的15 种药物,50株分离菌对土霉素、阿米卡星、新霉素、卡那霉素、替米考星、磺胺间甲氧嘧啶、磺胺对甲氧嘧啶、复方新诺明、氟苯尼考9 种药物耐药率在50%以上,抑菌效果欠佳,临床治疗犊牛腹泻病不建议继续使用。分离菌对多西环素、氨苄西林、头孢曲松、阿莫西林4 种药物敏感率在50%以上,可继续使用治疗犊牛腹泻病,但这4 种药物已经开始出现耐药性,临床应用应加以注意。对分离菌的多重耐药性进行统计,数据显示2 种及以上耐药性菌株占比高达100%(50/50),10 种及以上耐药菌株17 株,占比为34%,50 株分离菌多重耐药十分严重。2015年,崔冰冰对分离自中国北方部分规模化奶牛场的34 株犊牛腹泻大肠杆菌对22 种常用抗生素的耐药情况和多重耐药进行了分析,发现对10 种以上抗生素耐药的菌株有24 株,占比达70.59%[16]。2016 年,刘少坤从北京、天津牛场腹泻犊牛样品中分离到共32株强致病性大肠杆菌,并对其多重耐药性进行分析,发现天津地区犊牛大肠杆菌致病株全部为多重耐药,最多对16 种抗生素耐药,其中对14 种抗生素耐药的菌株占比最大;北京地区中仅一株只耐一种药物,对13 种抗生素耐药菌株占比最大[17]。上述数据显示犊牛腹泻大肠杆菌多重耐药情况普遍存在,并解释了抗生素类药物为何难以控制该病。细菌多重耐药性的产生不仅给动物疾病的防治带来了困难,同时还给食品安全以及人类健康造成严重的威胁。
为何犊牛腹泻大肠杆菌耐药如此严重?为从分子水平对该问题进行解答,本研究对分离菌的耐药基因进行检测。结果显示,临床常见6 类抗生素的除四环素类tetD 为0,其它耐药基因均有检出,其中四环素类tetC、氨基糖苷类aadA1、喹诺酮类gyrA、gyrB 检测率高达100%。本次药物敏感性试验中磺胺类药物的耐药性较高,但磺胺类sul1、sul2、sul3 检出率较低。为何磺胺素类耐药基因与药物耐药率两组数据的符合率较低,还需做进一步研究。喹诺酮类药物敏感率较高,但gyrA、gyrB 基因检测率高达100%,药物敏感率与耐药基因检测符合率较低。gyrA、gyrB 编码大肠杆菌的DNA 解旋酶,这两种基因的存在可影响药物作用靶位[18-19],分离菌均携带这两种基因,对喹诺酮类抗生素存在潜在耐药性。抗生素试验数据显示耐药基因与药物敏感性有一定的关联,但耐药基因检出率与同种抗生素类不同药物耐药率未表现出明显相关性,这可能与细菌存在多种耐药机制有关。
本研究对河北省分离到的50 株致犊牛腹泻大肠杆菌,对其致病性及耐药性及产生原因进行了检测与分析,为研究大肠杆菌所致犊牛腹泻病的致病机制提供一定的基础,同时也为临床用药以及致犊牛腹泻大肠杆菌耐药机制的研究提供理论支持。

