外源褪黑素对NaCl胁迫下5BB葡萄叶片生理特性的影响
韩国民,刘 茜,唐美玲,代玲敏,*
(1.滨州医学院 药学院,山东 烟台 264003; 2.烟台市农业科学研究院 葡萄与葡萄酒研究所,山东 烟台 265500)
土壤盐渍化是我国农业生态文明建设面临的重要问题之一。目前,我国盐渍化土地约占可利用土地面积的4.9%[1-2],主要分布在东北、西北、华北和沿海地区[3-4]。此外,较高的蒸发强度和较低的水资源利用量不断增加干旱和半干旱地区的盐渍化程度[5],许多地区光照充足且昼夜温差大,适宜葡萄栽培,是我国重要的葡萄和葡萄酒产区,但盐胁迫限制葡萄树的生长、光合作用、产量和果实品质[6-7]。高盐环境通过渗透胁迫、离子胁迫和氧化胁迫打破植物细胞内自由基产生与清除的动态平衡,加速植物细胞膜脂的过氧化,进而积累有害物质引起植物代谢紊乱,阻碍植物正常的光合作用和营养吸收[1,8-11]。研究表明,盐胁迫使葡萄叶片中叶绿素含量下降[12]、膜脂过氧化加剧[13]和丙二醛含量升高[14],诱导植物激素相关基因表达,减少养分的吸收[15-16]。因此,土壤盐渍化严重制约了我国葡萄与葡萄酒产业的发展。
褪黑素(melatonin,MT)是广泛存在于动植物体的一种激素,最早在动物的松果体中被发现,属吲哚类色胺,化学名称为N-乙酰-5-甲氧基色胺[17],直到20世纪90年代末期才在植物中被发现[18-19]。MT是一种广谱抗氧化剂,具有高效清除活性氧簇(ROS)的能力[20-21],在植物抵御逆境胁迫中有显著作用[19,22],如抵御高温、低温、高盐、干旱、紫外线、电离辐射和重金属等逆境条件[23]。研究证明,干旱胁迫和盐胁迫条件下,赤霞珠葡萄幼苗根系和叶片中MT含量显著增加,且胁迫程度越强增幅越大[24];此外,外源MT能够缓解臭氧胁迫、NaHCO3胁迫和高温胁迫对葡萄叶片光合作用的伤害[25-27]。卞凤娥等[28]研究发现,根施MT能够缓解NaCl胁迫对酿酒葡萄威代尔叶片叶绿素荧光特性的影响,但外源MT缓解NaCl对砧木葡萄品种叶片生理特性的影响仍未见详细报道。
随着国内外学者在砧木葡萄选育和应用研究方面取得明显进展,抗性砧木嫁接栽培已成为趋势,对中国葡萄产业生产、可持续发展具有深远意义[29]。本试验以砧木品种5BB葡萄为试验材料,研究外源MT对NaCl胁迫下5BB葡萄叶片生理生化指标的影响,探索MT缓解NaCl胁迫5BB葡萄叶片生长发育的生理生化机制,为MT在盐碱地种植葡萄中的应用提供一定的理论依据。
1 材料与方法
1.1 供试材料
试验材料为砧木葡萄品种5BB的成熟叶片,于2017年8月在滨州医学院(烟台)葡萄资源圃摘取。
1.2 处理
从顶端第1片完全展开的叶片算起,摘取第5~7片长势一致的叶片,低温(冰盒)保存带回实验室。参照王平[30]的处理方法并进行改良:摘取的叶片分别用自来水和蒸馏水冲洗,用滤纸把剩余的水吸干,将叶柄从基部减去1~2 cm防止产生气栓,然后用脱脂棉包裹住叶柄。将其插入配好的MT(不同浓度)+0.25 mol·L-1NaCl混合溶液中浸湿,每组处理30片叶片。盐胁迫中外源MT浓度的设置参考Meng等[31]的方法并进行改进:①水空白处理(CK);②0.25 mol·L-1NaCl 盐胁迫处理(0 MT);③0.25 mol·L-1NaCl+100 nmol·L-1MT(100 MT);④ 0.25 mol·L-1NaCl+200 nmol·L-1MT(200 MT);⑤0.25 mol·L-1NaCl+500 nmol·L-1MT(500 MT)。
处理好后用封口膜封好放入垫有湿滤纸的培养架中,并用保鲜膜覆盖在培养架上进行保湿,光照16 h·d-1,光照强度为2 000 lx。在盐处理后的第0、1、2、3、4、5、6天分别取叶片,进行各项生理指标的测定。
1.3 测定项目及方法
1.3.1 光合指标
每天上午09:00—11:00,用CIRAS-2便携式光合测定系统(PPSystems,英国)测定叶片的净光合速率Pn、气孔导度Gs和胞间CO2浓度Ci。测定条件:光量子通量密度为1 000 μmol·m-2s-1,参比室CO2浓度为(360±20)μmol·L-1,叶室温度为(25.0 ± 0.5)℃。
1.3.2 叶绿素相对含量(SPAD)
随机选取各处理的叶片,采用Konica SPAD-502Plus(日本)便携式叶绿素仪测定叶片的叶绿素SPAD值。
1.3.3 叶片相对电解质外渗率(REC)
使用电导率仪测定。用打孔器打取15个圆片(避开主脉),放入试管中,加10 mL蒸馏水,摇匀,测电导率Ea,然后将试样在室温下放置24 h,摇匀测电导率Eb,将试样煮沸15 min,冷却测定电导率Ec。计算公式:REC=(Eb-Ea)/(Ec-Eb)。
1.3.4 其他指标
参照张志良等的方法[32],采用考马斯亮蓝法测定可溶性蛋白质含量,采用硫代巴比妥酸法测定丙二醛(MDA)含量,采用氮蓝四唑光还原法测定超氧化物歧化酶(SOD)活性。
1.4 数据分析
每次指标测定重复3次,数据均采用平均值±标准差表示,使用SPSS 23.0进行方差分析(ANOVA),当存在显著性差异时(P<0.05),平均值进行Tukey(HSD)多重比较检验。
2 结果与分析
2.1 细胞膜脂
REC和脂质过氧化产物MDA是衡量膜损伤程度的重要指标。由图1-A可知,从第2天开始,叶片REC在NaCl胁迫下开始显著增加,但MT显著缓解了叶片电解质的外渗(P<0.05),不同浓度的缓解效果从大到小依次为100 MT、200 MT和500 MT,其中100 MT处理与CK未出现显著差异(P>0.05);从第4天开始,100 MT处理的叶片REC开始显著高于CK(P<0.05),但缓解效果依然显著(P<0.05),其REC值仅为0 MT叶片的78.29%,此时500 MT的缓解效果已经基本消失,其REC值与0 MT的基本持平;到第6天时,只有100 MT处理的叶片REC显著低于0 MT。随着时间的推移,未进行NaCl胁迫的CK实验组叶片REC值缓慢增加,可能与离体叶片的活性有关。
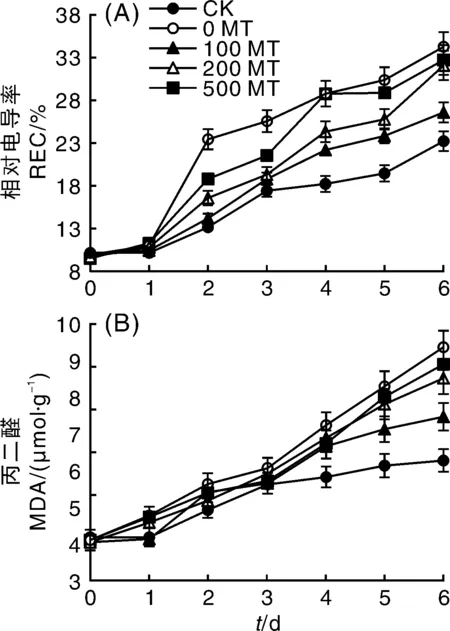
图1 外源褪黑素对NaCl胁迫下葡萄叶片相对电导率和丙二醛含量的影响Fig.1 Effects of exogenous melatonin on electrolyte leakage and MDA content of grape leaves under NaCl stress
如图1-B所示,第1天,各处理组叶片中MDA含量并未出现显著性差异;从第2天开始,0 MT组的叶片MDA含量开始显著高于CK组(P<0.05),但MT对叶片细胞脂膜的保护作用并未明显出现。第4天所有NaCl胁迫处理的叶片MDA含量显著增加(P<0.05),外源MT处理与0 MT没有显著差异,直至第5天100 MT的保护效果才开始显著出现,其MDA含量的增长率仅为第4天的6.99%,而0 MT的增长率为14.65%。整体来看,随着处理时间的延长,5组处理的叶片MDA含量都呈现升高的趋势,其中CK的MDA含量亦平缓增长,可能与离体叶片的活性有关。
因此,MT可以同时降低NaCl胁迫下葡萄叶片的REC和MDA,减弱盐胁迫对叶片膜损伤的程度,但MDA对MT保护作用的敏感程度远弱于REC。
2.2 渗透调节物和保护酶活性
可溶性蛋白质和SOD分别是植物胁迫条件下典型的叶片渗透调节物质和保护酶。由图2-A可知,NaCl胁迫下叶片可溶性蛋白呈先增加后降低的趋势,第3天可溶性蛋白质含量达到最高值,之后逐渐减少;到第6天,可溶性蛋白质的含量与第1天基本持平。第2天,MT处理组可溶性蛋白含量略高于0 MT组,但并未出现显著差异;第3天,100 MT、200 MT、500 MT处理的叶片可溶性蛋白质含量分别比0 MT处理高出17.83%、13.37%和7.24%,且100 MT和200 MT显著高于0 MT组(P<0.05)。
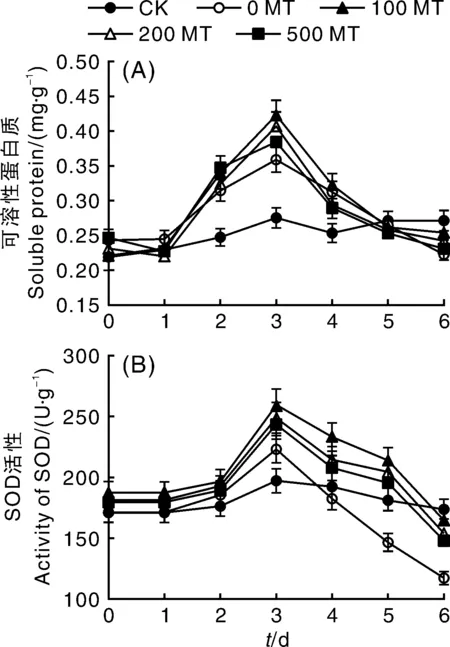
图2 外源褪黑素对NaCl胁迫下葡萄叶片可溶性蛋白质和SOD活性的影响Fig.2 Effects of exogenous melatonin on soluble protein and SOD activity of grape leaves under NaCl stress
如图2-B所示,NaCl胁迫下叶片SOD活性和可溶性蛋白的变化趋势一致,均是先升高后下降。不同的是SOD活性在第3天才开始显著增加(P<0.05),在随后的胁迫过程中SOD活性又逐渐降低。第3天,0 MT的SOD活性显著高于CK,说明NaCl胁迫促使叶片做出应激反应,增加保护酶浓度进行自我防护;此时,3组MT处理的SOD活性均显著高于0 MT(P<0.05),但此时3个浓度MT处理之间的SOD活性并未出现显著差异。随着NaCl胁迫时间的延长,0 MT处理的SOD活性迅速下降,第4天减少了18.32%,到第6天其SOD活性仅为第3天的52.53%,是胁迫之前的(0 d)68.64%,说明NaCl胁迫对叶片保护酶产生了较大影响,但MT处理缓解了NaCl胁迫下SOD活性的降低。从第4天开始,3组MT处理SOD活性均显著高于0 MT,且100 MT的缓解效果最好,SOD活性显著高于200 MT和500 MT。因此,盐胁迫会使叶片SOD活性降低,褪黑素处理则提高了SOD活性。
2.3 SPAD值和气体交换参数
2.3.1 SPAD值
叶绿体是植物叶片完成光合作用的细胞器,其结构和功能正常是植物生存的前提,但盐胁迫极易引起叶绿体膜系统的絮乱和破坏[33]。从图3-A可以看出,葡萄叶片经0.25 mol·L-1NaCl胁迫1 d后SPAD值均显著下降(P<0.05),但100 MT处理的葡萄叶片SPAD值在NaCl胁迫不同时间下均高于其他NaCl胁迫处理的叶片。第4天,100 MT处理叶片与0 MT、200 MT和500 MT处理叶片SPAD值的差值达到最大,分别比CK低4%、20%、18%和21%,具有显著差异(P<0.05)。但从第5天开始,100 MT对叶绿体的保护作用逐渐下降,这与CK组的趋势一致,推测这应该与离体叶片本身的活性有关;第4天之前,500 MT保护叶绿体的效果好于200 MT,而4 d以后,500 MT的保护效果开始下降,但SPAD值整体还是略高于0 MT处理。
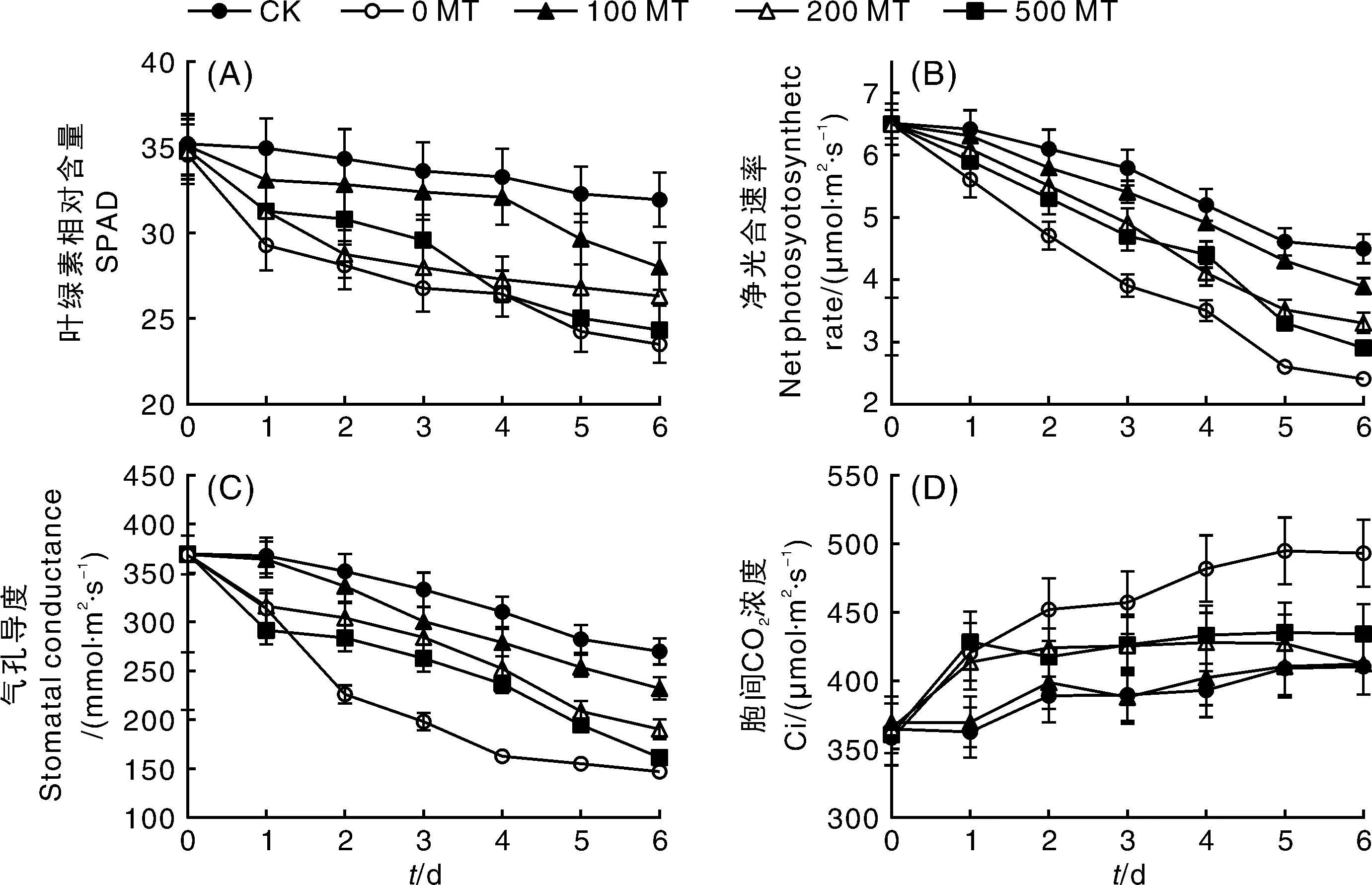
图3 外源褪黑素对NaCl胁迫下葡萄叶片叶绿素相对含量和气体交换参数的影响Fig.3 Effects of exogenous melatonin on soluble protein and gas exchange parameters of grape leaves under NaCl stress
2.3.2 气体交换参数
很多植物生理应激指标可用于评估逆境胁迫对植物光合作用的影响。本试验选取净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)3个指标,分别在离体5BB叶片NaCl胁迫的0、1、2、3、4、5、6 d进行监控。如图3-B所示,NaCl胁迫第1天,CK和100 MT处理组的叶片Pn并未出现显著降低,但0 MT和500 MT两组处理叶片Pn与胁迫前叶片比较出现了显著降低(P<0.05),且两者无显著差异;从第2天开始,0 MT处理组叶片Pn显著低于所有外源MT处理组,除100 MT与CK未出现显著差异外,其余2组MT处理(200 MT和500 MT)Pn均显著低于CK。随着时间的推移,CK和所有NaCl胁迫处理的Pn值均呈降低趋势,降低速率分别为CK>100 MT>200 MT>500 MT>0 MT;在第6天之前,除100 MT外,其余NaCl胁迫处理的Pn均显著低于CK(P<0.05)。
由图3-C可知,Gs在不同处理中的变化趋势与Pn基本一致,但NaCl胁迫下MT对Gs的缓解效果优于Pn。NaCl胁迫的第2天,Gs缓解效果最差的500 MT比0 MT处理的叶片Gs高25.66%,此时,500 MT的Pn仅比0 MT高出13%。随着处理时间的延长,CK和所有NaCl胁迫处理的Gs值亦呈降低趋势,降低速率分别为CK>100 MT>200 MT>500 MT>0 MT。因此,MT可以缓解NaCl对叶片光合参数Pn和Gs的影响,100 MT的缓解效果最好,其次为200 MT,随着MT浓度的增加,MT的缓解效果不断降低。
在植物光合作用的气孔限制分析中,Ci的变化趋势常用于光合速率变化和气孔因素之间关系的确定。由图3-D可知,第1天,0 MT、200 MT和500 MT处理组的叶片Ci值显著增高(P<0.05),从第2天开始,200 MT和500 MT处理组叶片Ci基本趋于稳定,但随着NaCl胁迫时间的延长,0 MT处理组Ci值持续增加,第6天的Ci值增长至NaCl胁迫前的1.38倍;CK和100 MT处理组的叶片Ci值变化相对稳定,直到第2天才有所增加,随后一直维持在400 μmol·m-2s-1左右,并且整体比200 MT和500 MT略低,但各MT处理间并未出现显著差异(P>0.05)。因此,与Pn和Gs相比,Ci值的变化比较稳定,并没有随着Pn和Gs的持续降低而减少;所有MT处理组均与0 MT组差异显著,但不同MT处理对Ci的影响并不显著。
3 讨论
盐胁迫是一种影响植物生存的最广泛非生物胁迫之一,通过影响植物的生理生化特征抑制植物的正常生长发育,严重影响经济作物的产量和经济效益。植物受盐胁迫危害,最直接的原因是细胞内Na+的大量积累,不仅降低植物对K+和Mg2+等的吸收和积累,而且引起的细胞内外渗透压变化导致离子毒害和渗透不平衡,损害细胞膜结构和功能,进而破坏细胞膜的完整性。在植物正常生长环境下,细胞内的电解质在细胞膜的阻隔作用下保留在细胞内,当细胞膜遭受盐胁迫伤害时,植物细胞会启动胞内电解质外渗渗透调节机制进行自我保护[34],此时细胞膜的阻隔作用降低使电解质涌向细胞外,增加叶片REC。REC是衡量植物体内细胞内溶物扩散到细胞外的一项生理指标,也是反映细胞质膜是否受到伤害的指标。REC越高,植物受到的盐胁迫伤害则越大。此外,NaCl胁迫还促使植物体内源活性氧的大量积累,诱发膜脂过氧化损害细胞膜结构和功能的完整性[35],被动增加其渗透性,促进REC的渗出。
本研究中,图1-A显示外源MT在第2天就开始有效缓解电解质的渗漏,维持质膜系统的完整性,但是外源MT是通过影响植物细胞渗透调节机制还是利用本身的抗氧化能力消除内源活性氧阻碍膜脂过氧化来减缓NaCl胁迫叶片中REC值的增长,还需要进一步印证。MDA作为膜脂过氧化的最终产物,可用于衡量植物膜脂过氧化的标准,其含量能够间接反映出植物在逆境胁迫下细胞膜受伤害程度[36]。图1-B中外源褪黑素在前4 d的NaCl胁迫下并未显著影响叶片MDA的积累,说明在这段时间内外源MT并没有直接与内源活性氧反应阻碍膜脂过氧化,而是通过改变植物细胞渗透调节机制来影响电解质的渗漏。
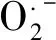
逆境胁迫下植物可溶性蛋白的变化有2种情况,一种是可溶性蛋白降解或其合成途径受阻引起可溶性蛋白减少,另外一种是诱导合成新的蛋白进而提高可溶性蛋白的含量[39]。因此,有些研究中盐胁迫使可溶性蛋白增加[40],也有些研究中的结果相反[41-42],但外源褪黑素均增加了可溶性蛋白的含量[40-41]。本研究中叶片可溶性蛋白在NaCl胁迫下呈现先增加后降低的趋势(图2-A),外源MT从第2天开始显著增强可溶性蛋白的积累,其影响效果类似REC。一般认为,MT引起的可溶性蛋白含量增加能够有效增强植物的渗透调节能力,降低叶片的REC含量,所以本试验中MT在第2天对REC的显著性影响归因于可溶性蛋白的增加,说明NaCl胁迫初期MT通过调节可溶性蛋白的含量来改变植物细胞渗透调节机制;NaCl盐胁迫3 d以后,MT处理组和0 MT的可溶性蛋白含量差异显著性逐渐消失,第5天时其影响效果基本可忽略,但第5天后MT对REC的影响依然显著,此时,对SOD活性的显著影响也存在,说明NaCl胁迫后期MT通过提高SOD活性阻碍膜脂过氧化来缓解电解质液的外渗。
叶绿体是植物叶片进行光合作用的细胞器,内含的叶绿素含量是衡量植物光合活性的重要生理指标之一。盐胁迫通过2个途径减少植物叶绿素含量:一是降低叶绿素合成酶活性、抑制叶绿素的合成;另一个是细胞膜质过氧化后破坏膜结构的完整性,促进叶绿素的分解[33,43]。本研究结果表明,NaCl胁迫显著降低叶片叶绿素含量,但100 nmol·L-1外源MT能够显著缓解NaCl胁迫对叶绿素的损害。由于在MT增强SOD活性之前叶绿素的减少已经出现缓解趋势,可以说明外源MT是通过提升叶绿素合成酶活性来减弱叶绿素合成的抑制程度。因此,MT不但可以提升SOD、过氧化物酶和过氧化氢酶等保护酶的活性,还可以增强叶绿素合成酶的活性。
Pn是衡量植物光合系统是否正常的生理指标,引起Pn降低的因素分为气孔因素和非气孔因素,非气孔因素包括光合相关酶活性和光合器官损伤程度[44]。本研究中发现,NaCl胁迫下葡萄叶片Pn和Gs随着胁迫时间的延长呈显著降低的趋势,且两者之间呈现较好的线性关系,但Ci值持续升高,说明NaCl胁迫下非气孔因素引起了Pn的降低,应该与相关酶活性降低和光合器官持续受损有关;本试验中外源MT有效缓解了Ci的增加,尤其是第3天开始Ci值基本保持稳定,说明MT处理组的叶片气孔因素是引起Pn降低的原因,此时的外源MT通过增强相关酶活性保护了叶片的光合器官,进而促进气孔的开放,提高了叶片的光合速率。这与杨阳等[45]通过外源钙缓解干旱胁迫对葡萄光合作用的影响结果一致。
此外,本研究发现外源MT浓度越高(100~500 nmol·L-1),对缓解葡萄叶片NaCl胁迫的效果越差,这可能与较高浓度MT会诱导蛋白质的氧化变性有关[26,46]。整体评估不同浓度外源MT缓解NaCl胁迫的效果可知,100 nmol·L-1的MT处理效果最好,该结果与其他不同浓度外源MT对植物逆境胁迫缓解作用的研究结果一致[26,41]。
综上所述,适宜浓度的MT能提高NaCl胁迫下砧木葡萄品种5BB叶片可溶性蛋白含量,改善其渗透调节能力,增强相关保护酶活性,维持细胞活性氧代谢平衡,降低叶片膜脂过氧化程度,最终保护叶片的光合作用,减少盐胁迫对砧木葡萄品种5BB的损伤。其中,外源MT对叶片相关酶活性的调节起到关键保护作用。但是较高浓度的外源MT对砧木葡萄也有不利影响,效果较好的外源MT浓度为100 nmol·L-1。

