曲古霉素A对脂多糖诱导的肺泡巨噬细胞炎症反应的影响
凌涛,谢佳,沈玉松,杨航,乔沐,孙大勇*,赵宁,钱克俭
(1.深圳市龙岗中心医院急诊科,广东 深圳 518116;2.南昌大学第一附属医院重症医学科,江西 南昌 330006)
组蛋白乙酰化修饰是表观遗传调控的重要机制,组蛋白去乙酰化酶抑制剂(histone deceatylase inhibitors,HDACIs)通过增加细胞内组蛋白的乙酰化程度,调控基因的转录,从而在恶性肿瘤和慢性炎症性疾病等的治疗中发挥作用。研究发现HDACIs也可影响炎症性疾病的发生发展。然而在肺泡巨噬细胞(alveolar macrophages,AM)炎症反应模型中,HDACIs能否抑制炎症介质释放、影响细胞存活目前鲜见报道。曲古霉素A(trichostatin A,TSA)是一种广谱HDACIs,本实验采用体外脂多糖(lipopolysaccharide,LPS)刺激AM构建炎症反应模型,观察TSA预处理对AM的细胞活性和炎症因子肿瘤坏死因子α(TNF-α)表达的影响。
1 材料与方法
1.1 主要实验材料和试剂
大鼠肺泡巨噬细胞株NR8383(上海中科院细胞库),胎牛血清(美国Gibco),Hams F-12K培养基(美国Gibco),磷酸盐缓冲液(PBS,北京中杉),青霉素-链霉素溶液(北京中杉),二甲基亚砜(DMSO,美国Sigma),LPS(美国Sigma),TSA(美国MCE)。RNA提取试剂盒(日本Takara),反转录试剂盒(威斯腾生物),荧光定量PCR试剂盒(威斯腾生物),SYBR Green I(威斯腾生物),大鼠TNF-α ELISA检测试剂盒(北京丽科)。
1.2 细胞培养
NR8383细胞培养于含100 U/mL青霉素、100 μg/mL链霉素和20%胎牛血清的Hams F-12K培养基中,置37 ℃、5% CO2、相对湿度为100%的细胞培养箱中培养,3~4 d换液1次,细胞融合80%时按照1∶3进行传代。
1.3 AM活性检测
使用CCK-8法检测TSA对AM活性的影响。取正常培养NR8383细胞重悬,计数调整细胞浓度至1×105/mL,接种于96孔板中,每孔100 μL,每组细胞设3个复孔。将96孔板移入培养箱中于37 ℃、5% CO2条件下培养,培养90 min后分别加入1、3、10、30、50 ng/mL终浓度的TSA,设阴性对照组(等体积PBS替代TSA)和阳性对照组(等体积10% DMSO替代TSA),37 ℃、5% CO2条件下于培养箱中继续培养48 h。取出96孔板,每孔加入10% CCK-8溶液,于培养箱内孵育1~4 h,同时设置空白组(加入培养基和10% CCK-8溶液)。酶标仪测定450 nm处的吸光度值(A值),计算细胞存活率。细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4 细胞处理及分组
取正常培养NR8383细胞重悬,调整细胞浓度至1×105/mL,接种于6孔板,每孔2 mL,每组细胞设3个复孔,在培养箱中放置1.5 h使细胞适应环境。实验分为4组:PBS对照组(A组),LPS(1 μg/mL)处理组(B组),TSA(1 ng/mL)+LPS(1 μg/mL)处理组(C组),TSA(10 ng/mL)+LPS(1 μg/mL)处理组(D组)。C组、D组向对应孔分别加入终浓度为1 ng/mL和10 ng/mL的TSA,A组加入等量PBS,继续于培养箱中37 ℃、5% CO2条件下培养30 min。再向对应孔中加入1 μg/mL LPS,A组加入等量PBS,继续于培养箱中37 ℃、5% CO2条件下培养。6 h后倒置显微镜下观察细胞形态学改变;离心收集细胞上清液,ELISA法检测TNF-α蛋白浓度;并收集细胞团块,保存于-80 ℃冰箱,用于提取细胞总RNA后,实时定量PCR法检测TNF-α mRNA表达。
1.5 检测指标
1.5.1TNF-α蛋白测定 收集各组细胞培养上清液检测TNF-α蛋白浓度,按ELISA试剂盒说明书操作。
1.5.2TNF-α mRNA表达测定 使用RNA提取试剂盒提取细胞总RNA,琼脂糖凝胶电泳检测总RNA完整性及纯度,紫外分光光度计测定总RNA浓度。应用反转录试剂盒反转录RNA,反应条件:30 ℃ 10 min(使用Random 6 mers时)或42 ℃ 30~60 min,95 ℃ 5 min,冰上冷却。用实时定量PCR试剂盒进行PCR扩增,反应条件:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。以GAPDH作为内参基因,TNF-α mRNA的相对表达量采用2-△△Ct法计算,ΔΔCt=(Ct目标基因-Ct对照基因)处理组-(Ct目标基因-Ct对照基因)对照组。
1.6 统计学处理
2 结果
2.1 TSA对AM活性的影响
加入不同浓度TSA后,AM细胞存活率随TSA浓度递增而降低,说明高浓度TSA对细胞活性有一定影响。见图1。1、3、10 ng/mL TSA组组间比较,细胞存活率差异无统计学意义(P>0.05),且细胞存活率均高于90%,表明TSA浓度在1~10 ng/mL范围内对AM的细胞毒性作用较小,可用于后续研究。
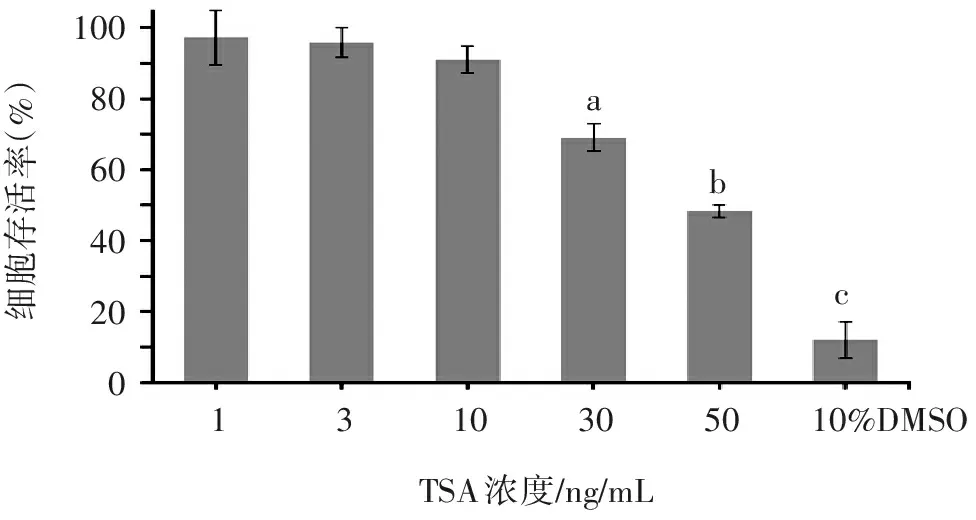
100806040200细胞存活率(%)abc1310305010%DMSOTSA浓度/ng/mL
注:TSA 30 ng/mL组与其它各组比较,aP<0.05;TSA 50 ng/mL组与其它各组比较,bP<0.05;10% DMSO组与其它各组比较,cP<0.05。
图1 CCK8法检测不同浓度TSA对NR8383细胞
存活率的影响(n=3)
2.2 各组AM形态学改变
各组细胞处理后继续培养6 h,倒置显微镜下观察细胞形态。A组细胞部分贴壁、部分悬浮生长,生长速度较快;B组细胞贴壁稀少,悬浮细胞增多,生长速度缓慢,细胞数量明显减少;C组和D组细胞均贴壁良好,部分悬浮生长,生长速度较快。显示LPS能明显抑制AM生长,而用TSA(1 ng/mL和10 ng/mL)预处理后,能减轻LPS对细胞的毒性作用。见图2。
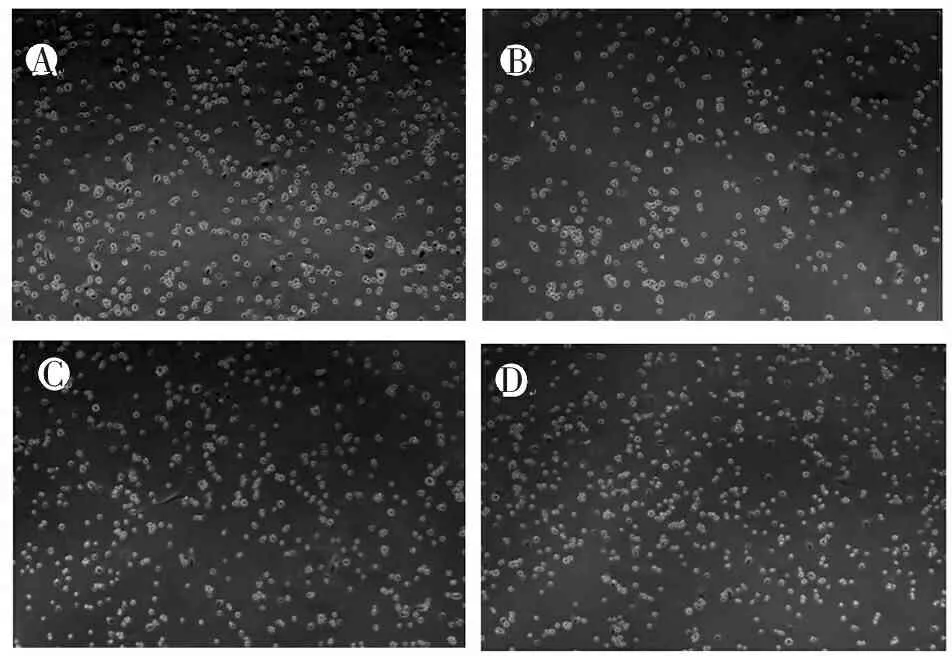
CBAD
注:A:PBS对照组(A组);B:LPS(1 μg/mL)处理组(B组);C:TSA(1 ng/mL)+LPS(1 μg/mL)组(C组);D:TSA(10 ng/mL)+LPS(1 μg/mL)组(D组)。
图2 各组NR8383细胞培养6 h后形态学改变
(倒置显微镜 100×)
2.3 各组AM上清液TNF-α蛋白表达
收集细胞培养上清液用ELISA法检测TNF-α蛋白表达,见图3。对照组、LPS处理组、TSA(1 ng/mL)+LPS组、TSA(10 ng/mL)+LPS组的TNF-α蛋白表达量分别为(34.62±3.24)ng/L、(158.61±4.76)ng/L、(117.05±1.96)ng/L、(66.69±0.46)ng/L。与对照组比较,其余3组TNF-α蛋白表达量均明显升高(均P<0.05)。与LPS处理组比较,给予1 ng/mL和10 ng/mL TSA预处理后均明显抑制TNF-α蛋白表达(均P<0.05);且给予10 ng/mL TSA预处理后TNF-α蛋白表达量更低(P<0.05)。显示LPS能诱导AM的TNF-α分泌增加,而TSA预处理能下调LPS诱导的TNF-α表达,并且其抑制作用与药物剂量有关联。
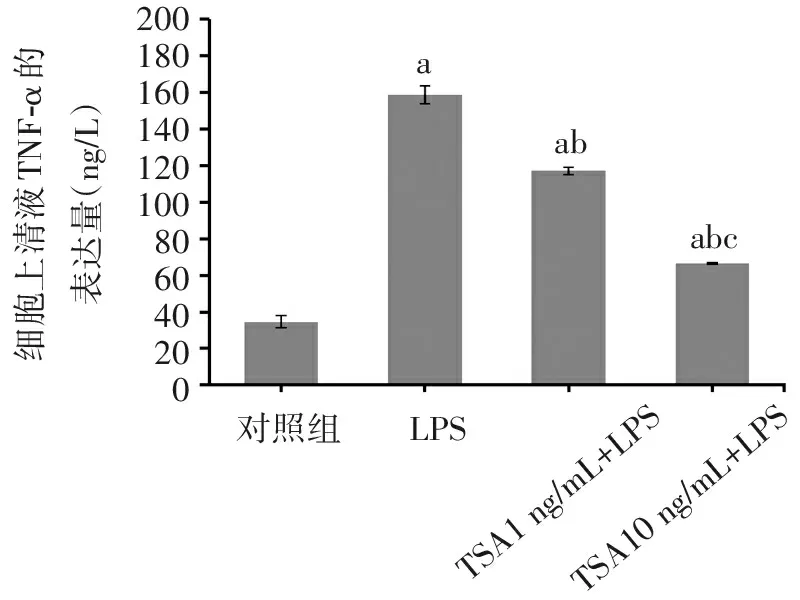
200180160140120100806040200细胞上清液TNF-α的表达量(ng/L)aababc对照组LPSTSA1ng/mL+LPSTSA10ng/mL+LPS
注:与对照组比较,aP<0.01;与LPS处理组比较,bP<0.01;与TSA(1 ng/mL)+LPS组比较,cP<0.05。
图3 各组细胞上清液TNF-α蛋白表达(n=3)
2.4 各组AM的TNF-α mRNA表达
LPS处理组TNF-α mRNA表达量较对照组升高(8.68±0.56)倍,TSA(1 ng/mL)+LPS组较对照组升高(5.68±0.50)倍,TSA(10 ng/mL)+LPS组较对照组升高(2.39±0.31)倍(均P<0.05)。与LPS处理组比较,给予1 ng/mL和10 ng/mL TSA预处理后,能明显下调TNF-α mRNA的表达;并且给予10 ng/mL TSA预处理组比1 ng/mL TSA预处理组的TNF-α mRNA表达量更低(均P<0.05)。见图4。显示LPS能诱导AM的炎症因子TNF-α转录,而TSA预处理能抑制AM的TNF-α转录,并且其抑制作用与药物剂量有关联。
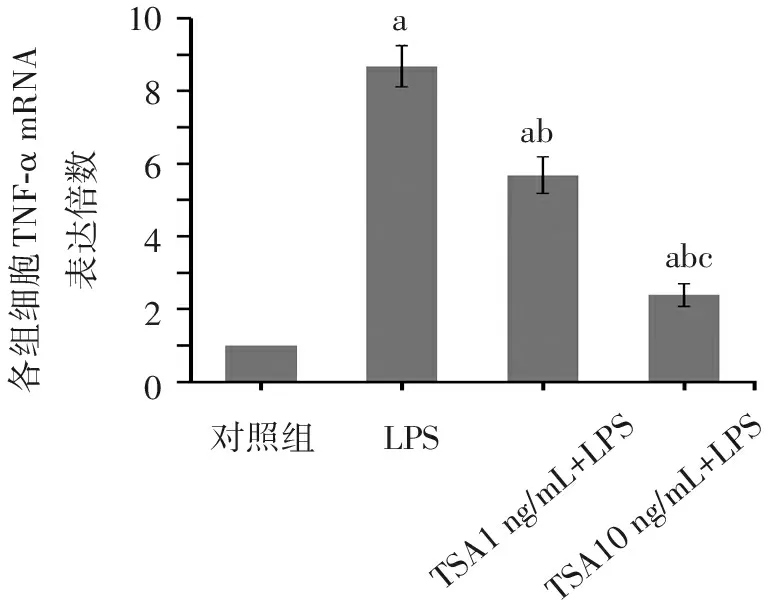
对照组LPSTSA1ng/mL+LPSTSA10ng/mL+LPSabcaba各组细胞TNF-αmRNA表达倍数1086420
注:与对照组比较,aP<0.01;与LPS处理组比较,bP<0.01;与TSA(1 ng/mL)+LPS组比较,cP<0.05。
图4 各组细胞TNF-α mRNA的表达检测
(实时定量PCR,n=3)
3 讨论
脓毒症(sepsis)是指因感染导致宿主反应失调,进而导致危及生命的器官功能障碍[1-2]。肺是脓毒症时最易并发功能障碍的靶器官,也是最先受累的器官[3]。AM是肺组织中含量最多的非实质性细胞,当AM受到病原体或不同炎症介质刺激时,炎症因子失控性释放,导致急性肺损伤(acute lung injury,ALI)的发生,在脓毒症并发ALI中发挥关键作用[4-5]。LPS是革兰阴性菌细胞壁的主要致病成分,本研究发现LPS(1 μg/mL)刺激肺泡巨噬细胞6 h后细胞贴壁稀少,悬浮细胞增多,生长速度缓慢,细胞上清液TNF-α蛋白含量明显增高,表明LPS能诱导肺泡巨噬细胞产生炎症反应。
HDACIs能引起乙酰化核小体组蛋白的堆积,抑制肿瘤细胞增殖,诱导细胞分化和(或)凋亡,大量临床试验已经证实其具有良好的抗肿瘤作用且毒副反应轻微。在美国,广谱HDACIs辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)已被批准应用于临床治疗晚期和难治性皮肤T细胞淋巴瘤[6]。随着对HDACIs作用机制研究的不断深入,发现与炎性反应有关的转录因子、细胞内信号分子、细胞因子受体等均受到乙酰化调节,因而HDACIs可影响炎症性疾病的发生发展[7-10],为脓毒症的治疗提供了一条新的途径。
目前认为HDACIs本质上是固有免疫细胞中关键免疫受体表达和抗菌作用的负性调节因子,降低了巨噬细胞对细菌的吞噬和杀伤作用,增加了对非严重细菌和真菌感染的易感性。但是在脓毒症和脓毒症休克中,HDACIs可以保护组织细胞免受致命性的炎症损伤[11-12]。研究认为HDACIs对脓毒症的保护作用主要是通过抑制TLR4-MyD88-NF-κβ/MAPK信号通路和抑制肺泡上皮细胞凋亡等途径发挥作用[13-14]。Toll样受体4(Toll-like receptor,TLR4)是一种跨膜蛋白,具有识别病原微生物,激活天然免疫系统,导致炎症反应的重要生物学功能。TLR4的细胞膜外结构识别LPS后,其构象发生变化,导致其细胞膜内结构募集衔接蛋白;髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)和β干扰素TIR结构域衔接蛋白(TIR domain-containing adaptor inducing interferon-β,TRIF)是两种重要的衔接蛋白;然后级联激活下游的核因子κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)信号传导途径[15-17]。而NF-κB和MAPK活性均受到乙酰化调节[18-19]。
Li等[20]研究发现,腹腔注射LPS诱导脓毒症休克后应用SAHA进行干预,小鼠1周存活率由对照组的0%显著提高达87.5%。Zhao等[21]在盲肠结扎穿孔诱导的致命性感染性休克模型中使用SAHA预处理,可以明显提高生存率,减少“细胞因子风暴”,并可减轻远处器官损伤。本实验证实,TSA预处理AM 30 min后,能减轻LPS对AM的毒性作用,明显抑制LPS诱导的TNF-α mRNA和TNF-α蛋白增加。因此我们推测,在脓毒症发生时TSA可从转录水平抑制肺泡巨噬细胞TNF-α的产生,减少炎症因子的释放,从而避免或减轻脓毒症导致的肺损伤。
综上述,TSA能够抑制LPS诱导的大鼠肺泡巨噬细胞炎症反应,有望应用于LPS所致的脓毒症相关性肺损伤的治疗。

