活性维生素D3对阿霉素肾病大鼠CD2AP的影响
陈亚茹,赵丹,杨晓萍,罗星,刘馨馨,马国英
(1.石河子大学医学院,新疆 石河子 832002;2.石河子大学医学院第一附属医院,新疆 石河子 832002)
慢性肾脏病(chronic kidney disease,CKD)是以肾功能损害、蛋白尿排泄率升高为主要特征的临床常见疾病[1]。近年来,随着对CKD尿蛋白分子机制的深入研究,发现肾足细胞表面维生素D受体是活性维生素D3发挥抗蛋白尿的重要靶点[2]。CD2相关蛋白(CD2AP),作为足细胞标志分子,具有维持细胞良好形态,调节细胞分化、凋亡及细胞信号转导的功能[3]。本实验研究骨化三醇对阿霉素(Adriamyicin,ADR)肾病大鼠足细胞CD2AP表达的影响,探讨活性维生素D3的肾保护作用。
1 材料与方法
1.1 实验动物
90只6周龄雄性SPF级健康Sprasue-Dawley大鼠,体重(200±20)g,由新疆医科大学实验动物中心提供。生产许可证号:SCXK(新)2013-0001。
1.2 实验试剂及仪器
1.2.1 主要试剂ADR(深圳万乐药业有限公司,批号:1409E1),骨化三醇(上海罗氏制药有限公司,批号:J20150011),CD2AP兔多克隆抗体(美国Bioworld Technology公司),GAPDH鼠单抗(北京康为世纪生物科技有限公司),蛋白预染Marker 26616(美国Thermo Fisher Scientific公司),免疫组织化学染色二步法检测试剂盒(北京中杉桥生物技术有限公司)。
1.2.2 实验仪器全自动生化分析仪BC6800(深圳迈瑞医疗国际有限公司),透射电子显微镜(日本Olympus Optical公司),电泳及电转膜仪(美国Bio-Rad公司),Gel Doc 2000凝胶成像分析系统(美国Bio-Rad公司)。
1.3 动物模型的复制及分组
采用随机数字表法将60只大鼠经单次尾静脉注射ADR 7.5 mg/kg复制模型,另取30只为对照组。2周后,3组随机选取6只大鼠检测24 h尿蛋白、血清总蛋白(total protein,TP)、血浆白蛋白(plasma albumin,ALB)、总胆固醇(total cholesterol,TC)、血清肌酐(serum creatinine,Scr)水平,判断模型是否复制成功。将模型复制成功的SD大鼠随机均分为模型组和治疗组。治疗组给予0.25μg/(kg·d)骨化三醇灌胃治疗,对照组、模型组给予等量花生油灌胃。模型复制成功后每2周每组取6只大鼠检测24 h尿蛋白,取肾组织冷冻保存。第10周实验结束。
1.4 观察指标
1.4.1 尿蛋白、血生化检测治疗2、4、6、8和 10周后代谢笼留24 h尿,检测24 h尿蛋白。经大鼠腹主动脉采血,用全自动生化分析仪检测TP、ALB、TC、Scr水平。
1.4.2 Masson染色将4μm厚的大鼠肾组织石蜡切片梯度酒精脱蜡、脱二甲苯处理。经核染液染色60 s,浆染液染色30~60 s,黄色分色液分色6~8 min,直接用苯蓝/光绿液复染5 min左右,梯度酒精脱水,晾干,中性树胶封片。
1.4.3 透射电子显微镜实验结束时,各组随机选取 3只大鼠取其新鲜肾皮质约1 mm×1 mm×1 mm,经2.5%戊二醛初固定,1%锇酸再固定,脱水、包埋、半薄切片、定位修块,超薄切片机制成50~60 nm的超薄切片,经醋酸铀和柠檬酸铅双重染色,封片、镜检、摄像。
1.4.4 免疫组织化学染色将4μm厚的肾组织石蜡切片常规脱蜡、微波高温抗原修复,3%过氧化氢内源性过氧化物酶封闭,滴加CD2AP(1∶400)4℃孵育过夜,滴加辣根过氧化物酶标二抗,PBS漂洗3次,DAB显色,苏木精复染,透明,封片。每张切片随机选取5个肾小球视野,根据肾小球和肾小管间质单位内阳性信号面积与总面积的比值,计算CD2AP表达水平。
1.4.5 Western blotting检 测从-80℃冰 箱 取 出100 mg肾组织,加1 ml裂解液研磨(裂解液在使用前按1∶100比例加入10μl PMSF),所有操作在冰上进行。研磨充分,取上清用BCA法测定蛋白浓度,配平。加入蛋白上样缓冲液,100℃煮8 min,上样量50μg/孔。SDS-PAGE电泳浓缩胶:83 V,30 min;分离胶:100 V,1 h;电转:23 V,100 min;5%脱脂奶粉封闭2 h,滴加一抗(CD2AP 1∶1 000,GAPDH 1∶1 000)4℃孵育过夜,TBST洗,CD2AP山羊抗兔二抗(1∶5 000)和GAPDH山羊抗小鼠二抗(1∶2 000)室温孵育2 h,TBST洗二抗,用ECL发光试剂暗室曝光,Image Lab系统图像摄取,以GAPDH作为内参。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况
注射ADR后2周,模型组与对照组2周后大鼠24 h尿蛋白和血生化检测结果比较,经t检验,差异有统计学意义(P<0.05);模型组TP、ALB低于对照组,24 h尿蛋白、Scr、TC高于对照组,提示模型复制成功(见表1)。对照组大鼠被毛有光泽,精神状况良好,作息较规律;模型组毛皮暗淡无光,易嗜睡,反应迟缓,饮食欠佳;治疗组较模型组饮食、精神状态均有不同程度改善。
2.2 各组大鼠的24 h尿蛋白比较
实验前,3组大鼠24 h尿蛋白比较,经单因素方差分析,差异无统计学意义(F=0.369,P=0.697),具有可比性。对照组、模型组、治疗组大鼠活性维生素D3治疗2、4、6、8和10周后24 h尿蛋白比较,采用重复测量设计的方差分析,结果:①不同时间点的24 h尿蛋白有差别(F=566.288,P=0.000)。②3组大鼠24 h尿蛋白有差别(F=6 679.977,P=0.000);模型组较对照组升高,活性维生素D3治疗后24 h尿蛋白水平降低。③3组大鼠24 h尿蛋白变化趋势有差别(F=843.349,P=0.000)。见表2和图1。
2.3 活性维生素D3对ADR肾病大鼠肾组织病理学改变的影响
Masson染色结果显示,对照组大鼠肾小球及肾小管基底膜的胶原成分被苯胺蓝染成蓝色,仅少量胶原分布,肾组织其他部分未见明显胶原沉积。模型组大鼠的肾小球和肾小管基底膜增厚,肾间质中染成蓝色的胶原纤维增多,并出现片状淡蓝色纤维样坏死。治疗组大鼠肾间质胶原纤维增生减轻,第10周末治疗效果明显,提示活性维生素D3能减轻肾小球结构的损伤。见图2。
表1 3组大鼠24 h尿蛋白和血生化检测结果比较(n=6,±s)

表1 3组大鼠24 h尿蛋白和血生化检测结果比较(n=6,±s)
组别 24 h尿蛋白/mg TP/(g/L) ALB/(g/L) Scr/(μmol/L) TC/(mmol/L)对照组 7.353±0.370 63.273±3.951 33.530±1.922 26.855±0.761 1.603±0.226模型组 33.269±2.598 44.948±6.510 21.878±3.014 57.649±4.893 3.228±0.220 t值 5.562 5.390 3.935 6.307 1.027 P值 0.004 0.043 0.037 0.031 0.001
表2 3组大鼠不同时间点的24 h尿蛋白比较(n=30,mg,±s)
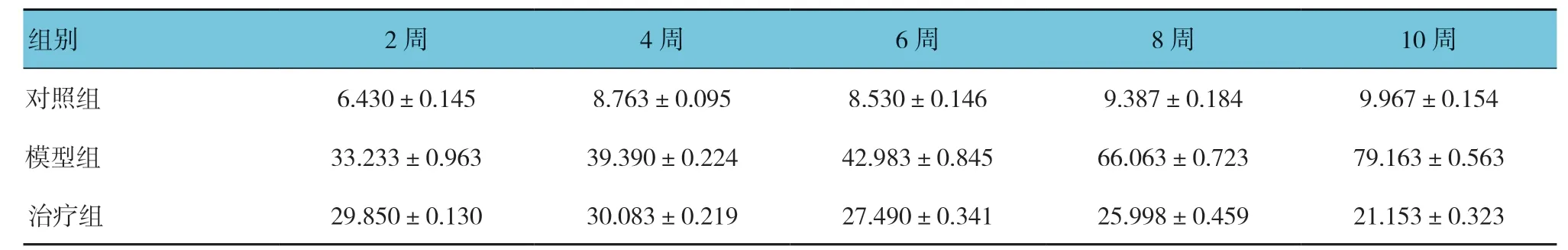
表2 3组大鼠不同时间点的24 h尿蛋白比较(n=30,mg,±s)
组别 2周 4周 6周 8周 10周对照组 6.430±0.145 8.763±0.095 8.530±0.146 9.387±0.184 9.967±0.154模型组 33.233±0.963 39.390±0.224 42.983±0.845 66.063±0.723 79.163±0.563治疗组 29.850±0.130 30.083±0.219 27.490±0.341 25.998±0.459 21.153±0.323
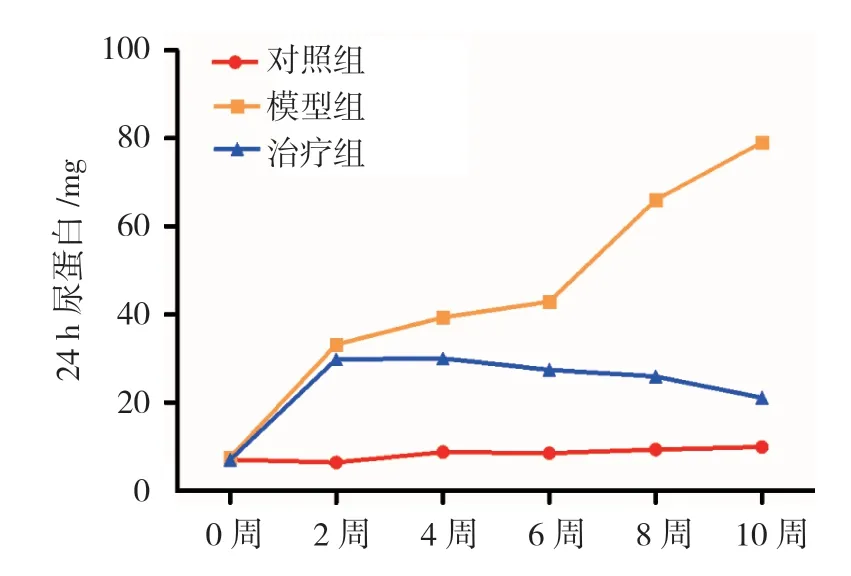
图1 3组大鼠24 h尿蛋白变化趋势(n=30,±s)
2.4 活性维生素D3对ADR肾病大鼠肾足细胞超微结构的影响
大鼠肾组织透射电子显微镜结果显示,对照组大鼠足细胞形态结构正常,基底膜平滑均匀无增厚,钉突状足突清晰可见,向外延伸,彼此连接,细胞核形态规则。模型组大鼠足细胞足突回缩,熔蜡般广泛融合,细胞核畸形且胞内有脂滴聚集。活性维生素D3治疗后,足细胞损伤减轻,细胞核形态良好,足突完整,偶见融合与少量的脂滴凝集。见图3。

图2 3组大鼠肾组织病理学改变(Masson染色×400)
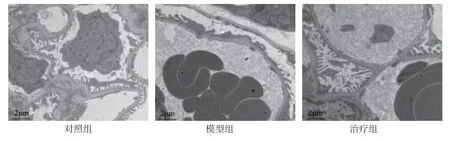
图3 3组大鼠肾组织超微结构改变(透射电子显微镜)
2.5 活性维生素D3对ADR肾病大鼠肾小球CD2AP分布的影响
免疫组织化学染色结果可以看出CD2AP主要定位于肾小球的足细胞胞浆内,呈黄褐色或淡黄色片状分布。CD2AP蛋白在对照组、模型组、治疗组的相对表达量分别为(0.094±0.002)、(0.041±0.014)和(0.080±0.019),经单因素方差分析,差异有统计学意义(F=19.802,P=0.000);治疗组CD2AP蛋白表达水平高于模型组(P<0.05),可见活性维生素D3可抑制ADR诱导大鼠足细胞CD2AP表达降低,上调肾足细胞CD2AP的表达,伴随尿蛋白减少。见 图4。

图4 ADR肾病大鼠肾组织CD2AP蛋白的表达(IHC×400)
2.6 活性维生素D3对ADR肾病大鼠肾小球CD2AP蛋白表达的影响
对照组、模型组、治疗组大鼠2、6和10周的肾小球CD2AP蛋白相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间点大鼠肾小球CD2AP蛋白表达水平比较,差异有统计学意义(F=111.181,P=0.000)。②3组大鼠肾小球CD2AP蛋白表达水平比较,差异有统计学意义(F=4613.574,P=0.000),治疗组高于对照组和模型组。③3组大鼠肾小球CD2AP蛋白表达水平变化趋势比较,差异有统计学意义(F=95.446,P=0.000)。见表3和 图5。
表3 3组大鼠不同时间点CD2AP蛋白表达水平比较(n=30,±s)

表3 3组大鼠不同时间点CD2AP蛋白表达水平比较(n=30,±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05
组别 2周 6周 10周对照组 0.854±0.105 0.864±0.201 0.896±0.067模型组 0.352±0.1501) 0.336±0.1241) 0.306±0.0171)治疗组 0.490±0.0911)2) 0.510±0.2281)2) 0.734±0.0831)2)

图5 3组大鼠CD2AP蛋白表达水平的变化趋势(n=30,±s)
3 讨论
肾小球疾病仍然是慢性和终末期肾病的主要原因。通过对动物模型的研究,学者对人类肾小球疾病的认识取得了重大进展[4]。绝大多数CKD为肾小球上皮细胞的疾病。在科研实验中,啮齿动物能更好地诱导疾病,以利于研究其进展机制,确定潜在的目标和治疗方法[5]。本实验根据文献报道,通过一次性尾静脉注射ADR 7.5 mg/kg获得非糖尿病足细胞疾病的动物模型,即ADR肾病模型[6]。2周末检测24 h蛋白尿、血生化指标显示,与对照组比较,模型组24 h尿蛋白升高,血清TP、ALB下降,Scr、TC升高;且2周末大鼠精神状态欠佳,反射迟钝,饮食量减少,提示模型复制成功。
足细胞损伤,突变或丢失都是足细胞复杂结构的物理改变,一旦足细胞足突扁平或抹失,肾小球的滤过屏障就不再完整,血管中的蛋白质泄漏至尿液中,就产生了蛋白尿[7]。蛋白尿是肾功能障碍重要的临床标志。
维生素D最活跃的代谢物是1,25-二羟维生素D,其是矿物体内平衡的中枢调节剂,对骨骼健康和矿物代谢至关重要[8]。也有研究证实在结肠直肠癌中,活性维生素D3能够抑制增殖,促进结肠癌上皮分化[5]。目前,关于CKD的研究热点是活性维生素D3如何减轻肾足细胞损伤,改善CKD的进程。研究发现,在嘌呤霉素氨基核苷肾病、ADR肾病、糖尿病肾病模型鼠中普遍存在维生素D的缺乏,给予 活性维生素D3可以减轻肾组织损伤,显著减少蛋白尿的产生[9-11],与本研究结果有高度一致性[9-11]。笔者用ADR诱导的CKD模型肾组织损伤严重,Masson染色可见大量蓝染的胶原纤维增生,肾小管间质内可见肾小管扩张和肾间质纤维化。但肾脏纤维化是否与CD2AP蛋白密切相关,目前尚没有报道。
CD2AP是足细胞裂孔隔膜特异表达的蛋白,能维持足细胞结构和功能的完整性,CD2AP表达异常在蛋白尿的发生机制中发挥重要的作用。RUSSO等[12]研究发现,CD2AP基因敲除的小鼠,肾小球上皮细胞足突缺陷产生蛋白尿,最终肾衰竭而死。本研究发现,ADR肾病大鼠肾组织损伤严重,超微结构显示肾足细胞核畸形,足突融合,脂滴形成,CD2AP表达明显降低,这表明CD2AP表达降低是引起肾足细胞超微结构损伤的重要原因,进一步破环肾小球滤过屏障,导致滤过膜通透性增强,产生蛋白尿。活性维生素D3治疗后,CD2AP表达增强,大鼠24 h尿蛋白降低,肾组织纤维化症状减轻,足细胞超微结构显示胞核规则,胞膜光滑无增厚,足突清晰可见。
本研究通过复制ADR肾病模型,证明ADR能够诱导肾小球损伤,包括肾小球结构病理改变及足细胞超微结构的破坏,这些损伤参与慢性肾病蛋白尿的产生过程。活性维生素D3能够上调CD2AP表达,改善肾足细胞损伤,维持肾小球滤过膜的完整性,减少了蛋白尿的产生,发挥肾功能保护作用。近年来,众多学者对足细胞病、蛋白尿的分子机制和信号通路研究多集中在足细胞特异分子Nephrin引导的信号通路,而CD2AP独立于其他分子的功能研究相对较少[13]。本研究证明CD2AP在活性维生素D3治疗慢性肾病,减少蛋白尿的发生、发展机制中承担重要的角色。目前,关于CD2AP的具体分子机制尚不完善,有待研究者多维度深入探讨。

