构建解题模型 快准计算反应热
广东 曾令勇
一、高考情况分析
当今高考化学试题在高考评价体系框架的引领下,科学设置考查内容,保证基础性、加强综合性、增强应用性和探索创新性,满足高等学校对高素质人才选拔的需要。而反应热计算是一个应用性很强的知识点,在历年高考题中很受青睐,具体考情分析如下表:

201320142015201620172018全国卷Ⅰ考查题型非选择题,1个空非选择题,1个空非选择题,1个空非选择题,2个空非选择题,2个空考查内容利用盖斯定律进行计算利用盖斯定律进行计算利用键能进行计算利用盖斯定律进行计算利用盖斯定律进行计算全国卷Ⅱ考查题型选择题选择题非选择题,2个空非选择题,1个空非选择题,1个空非选择题,1个空考查内容利用盖斯定律进行计算利用盖斯定律进行计算,反应热的大小比较利用键能、盖斯定律进行计算利用盖斯定律进行计算利用盖斯定律进行计算利用盖斯定律进行计算全国卷Ⅲ考查题型非选择题,1个空非选择题,1个空非选择题,1个空考查内容利用盖斯定律进行计算利用盖斯定律进行计算利用盖斯定律进行计算广东卷考查题型非选择题,2个空非选择题,1个空非选择题,1个空考查内容书写热化学方程式、利用盖斯定律进行计算利用盖斯定律进行计算书写热化学方程式、利用盖斯定律进行计算
二、解题方法介绍
反应热的计算题型主要有三类:第一类是根据反应物和生成物的总能量进行计算;第二类是根据键能来进行计算;第三类是根据盖斯定律进行计算。依据历年高考题分析可知,最受青睐的考查内容是根据盖斯定律进行的计算。盖斯定律的内容学生非常容易理解,不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。盖斯定律好理解,但在具体考题中,一旦涉及热化学方程式(既有已知的热化学方程式,也有目标热化学方程式)就不知道从何处下手,直接放弃觉得可惜,如果尝试解答,消耗时间较长,且正确率不高。现在笔者对利用盖斯定律进行计算反应热的这种题型摸索出一个比较好的解题模型,总体来说就是六个字:物质、位置、系数。“物质”是指要抓唯一,观察目标热化学方程式的反应物和生成物,抓出在所给的已知热化学方程式中仅出现过1次的物质;“位置”是指抓出来的物质的位置,如果同为反应物或生成物就是加,位置不同就是减;“系数”是指抓出来的物质系数,如果系数相同就不需要乘除,系数不同就要乘或除以相应的数。具体解法如下:
【例1】(2018·全国卷Ⅰ·28,略改编)(2)已知:

ΔH1=-4.4 kJ·mol-1



三、典型题例分析
1.常规题型
1.1 给出目标热化学方程式
【例2】(2018·全国卷Ⅱ·27,略改编)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:



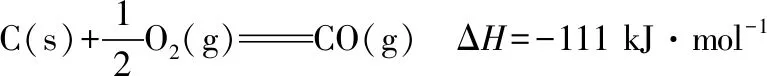
该催化重整反应的ΔH=________kJ·mol-1。
【解析】①是目标热化学方程式,②③④是已知的热化学方程式,经观察②中找CH4(也可以找H2),位置不同,系数相同即-②;③中找CO2,位置不同,系数相同即-③;④中找CO,位置相同,系数在目标热化学方程式中是2,而④中CO的系数是1,所以是+④×2。综上所述①=-②-③+④×2,即①=④×2-②-③,则ΔH=(-111 kJ·mol-1)×2-(-75 kJ·mol-1)-(-394 kJ·mol-1)=+247 kJ·mol-1。
1.2 未给出目标热化学方程式
【例3】甲醇是重要的可再生燃料。已知在常温常压下:



则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________。

1.3 图象题
【例4】氨的合成是重要的化工生产之一。
工业上合成氨用的H2有多种制取方法:
已知有关反应的能量变化如下图所示,且方法②的反应只能在高温条件下发生,则方法②中反应的ΔH=________kJ·mol-1。

图1

图2

图3
【解析】多数学生一看到这类题型,首先把三个图所对应的热化学方程式写出,实际上不用写,写出来既浪费时间又增大了出错率。按照笔者的方法,就抓三种物质,这三种物质既在目标热化学方程式里,且在已知图中只出现过1次,它们分别是图3的CH4、图1的CO、图2的H2。其中CH4在图3和②中都是反应物,位置相同,系数也相同,即+(-ckJ·mol-1);CO的位置在图1和②中不同,系数相同,即-(-akJ·mol-1);H2的位置在图2和②中不同,且目标热化学方程式中H2的系数是图2的3倍,即-(-3bkJ·mol-1)。所以ΔH=(-ckJ·mol-1)-(-akJ·mol-1)-(-3bkJ·mol-1)=(a+3b-c) kJ·mol-1。
2.复杂题型
这种复杂题型主要是在已知方程式中增加了一个看似没用但非常有用的热化学方程式,这个热化学方程式主要是用来消元的。例如:
【例5】(2014·全国卷Ⅰ·28,节选)(2)已知:


ΔH2=-29.1 kJ·mol-1


【解析】唯一的物质:②式中有C2H4,③式中有C2H5OH,那么①怎么办,实际它是用来消元的,可以与③式消掉CH3OCH3。C2H4的位置不同,系数相同即-②,C2H5OH位置不同,系数相同即-③,也就是说要把③颠倒,颠倒后直接可以与①式消CH3OCH3,即+①。所以④=+①-②-③,即ΔH=-23.9 kJ·mol-1-(-29.1 kJ·mol-1)-(+50.7 kJ·mol-1)=-44.5 kJ·mol-1。
【例6】(2017·全国卷Ⅰ·28,略改编)(2)图4是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

图4
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、__________________________________。

四、结束语
通过以上题型分析,这种解题模型应用范围广,可以快速准确地求出各种题型的反应热,对于书写热化学方程式也行之有效。例如:
【例7】(2011·广东卷·31,节选)(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:


写出由CO2生成CO的热化学方程式:________________。

作为老师,需要不断对教学进行反思,不放过教学中无论是学生提出还是自己发现的问题,指导学生应用创新的观念去分析、解决问题,促进学生形成化学学科的思维方式。

