白介素-1β在大鼠皮肤创伤后不同时段的表达
李翼彬,李俊岑,赵鑫鑫,金 昊
(1.成都市第三人民医院,四川 成都,610000;2.成都医学院实验技术教研室,四川 成都,610081)
创伤愈合是一个复杂的病理生理过程,主要包括炎症反应期、增殖期和瘢痕修复期[1]。但创伤修复的机制目前仍未完全明了。白介素-1β( IL-1β)作为创伤修复过程中较重要的细胞因子,具有促进成纤维细胞、血管内皮细胞增殖和细胞外基质沉积等作用[2-3]。但是,在皮肤创伤后不同时段不同组织部位中,IL-1β的表达变化仍不清楚。因此,本文通过建立大鼠皮肤创伤修复模型,从形态学上观察创伤后不同时段创伤皮肤组织病理变化以及IL-1β的表达变化,为进一步探讨IL-1β在创伤修复过程中的潜在机制提供实验依据。
1 材料和方法
1.1 动 物
SD 品系大鼠15只, 由成都医学院实验动物中心提供,随机分为1d、3d、7d三个时间段组,每组5只。
1.2 模型制备
各组大鼠实验前1d脱毛,称重。用3.6%水合氯醛腹腔注射麻醉(用量1 ml/kg体重) ,固定于手术台上,常规消毒。在距脊柱0.5cm处,用刀将1.5cm×1.5cm范围内的皮肤切除, 不伤及脊柱旁肌肉上的脂肪及筋膜, 术后每日给予标准饲料喂养,动物饲养室温维持在25~30℃。
1.3 免疫组织化学染色
各组大鼠用3.6%水合氯醛(1 ml/kg)腹腔麻醉后,切取距损伤边缘10mm的皮肤全层组织,浸泡于4%多聚甲醛溶液24-36h,石蜡包埋,沿皮肤纵切面切片,制作5μm厚的石蜡切片每组取5张石蜡切片,具体染色步骤按IL-1β免疫组化SP试剂盒说明执行。DAB显色,苏木素复染,二甲苯透明,树胶封片。用PBS代IL-1β抗体做阴性对照组,其余步骤不变。
1.4 结果观察
采用OLYMPUS数码照像机采集图像,观察IL-1β阳性产物在皮肤组织中的分布,用 Image-Pro Plus 6.0 图像处理软件测量未愈合面积,以及阳性反应物的平均光密度值(MD)。
1.5 统计学处理
各组未愈合面积和平均光密度值数据以均数±标准差表示,用SPSS 20.0 软件包,组间比较采用方差分析 LSD 法。
2 结 果
2.1 创伤未愈面积结果
损伤后1d、3d、7d大鼠创伤皮肤未愈合面积均逐渐缩小,各组未愈合面积均存在统计学差异(P<0.05)如图1,表1)。
2.2 HE染色结果
损伤后1d,镜下组织间隙散布着大量红细胞,也可见扩张充血的毛细血管,小血管内可见血栓形成。损伤周围可见少量中性粒细胞等炎性细胞浸润(图2-a)。损伤后3d,肉芽组织大量形成,向创口延伸。损伤区周围可见毛细血管生成,中性粒细胞和巨噬细胞大量浸润,大量成纤维细胞存在(图2-b)。损伤后7d,肉芽组织已基本填平创口,成纤维细胞向纤维细胞转化。肉芽组织向瘢痕组织转变。损伤区周围可见大量的梭形细胞核的纤维细胞,炎性细胞少见(图2-c)。
2.3 免疫组化染色结果
2.3.1 损伤边缘 皮肤内IL-1β免疫阳性反应物的分布概况 光镜下观察到IL-1β在动物上皮组织、巨噬细胞、成纤维细胞中有表达,阳性反应物主要定位在胞核、胞浆和基质中。
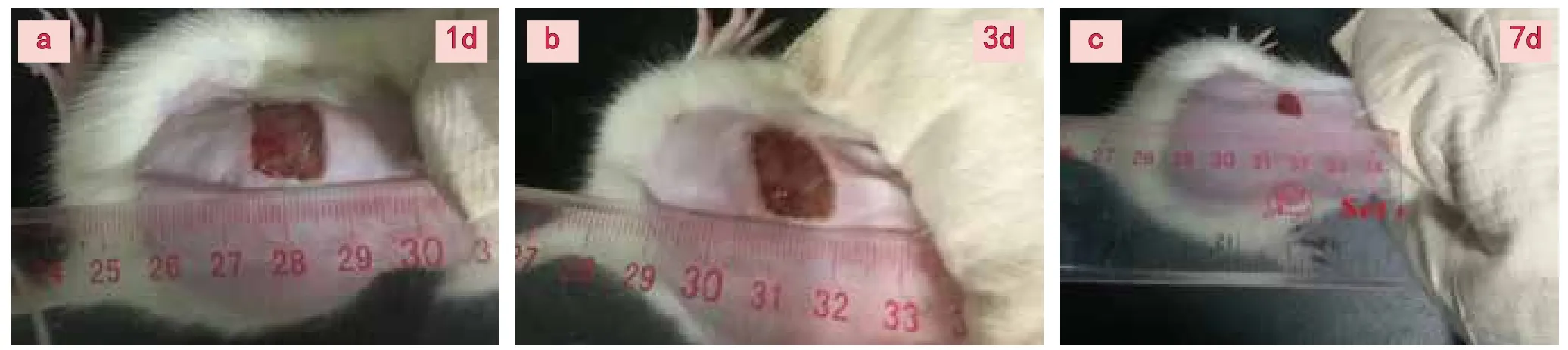
图1 创伤皮肤未愈合面积:a,b,c分别示大鼠皮肤创伤后1d,3d,7d 未愈合皮肤面积

图2 创伤皮肤组织HE染色:a 损伤后1d,镜下组织间隙散布大量红细胞,可见扩张充血的毛细血管,血管内可见血栓形成。损伤周围可见少量中性粒细胞等炎性细胞浸润 (HE×400);b 损伤后3d,肉芽组织大量形成,向创口延伸。损伤区周围可见毛细血管生成,中性粒细胞和巨噬细胞大量浸润,大量成纤维细胞存在。(HE×400);c 损伤后7d,肉芽组织已基本填平创口,成纤维细胞向纤维细胞转化。肉芽组织向瘢痕组织转变。损伤区周围可见大量细胞核呈梭形的纤维细胞,炎性细胞少见(HE×400)。
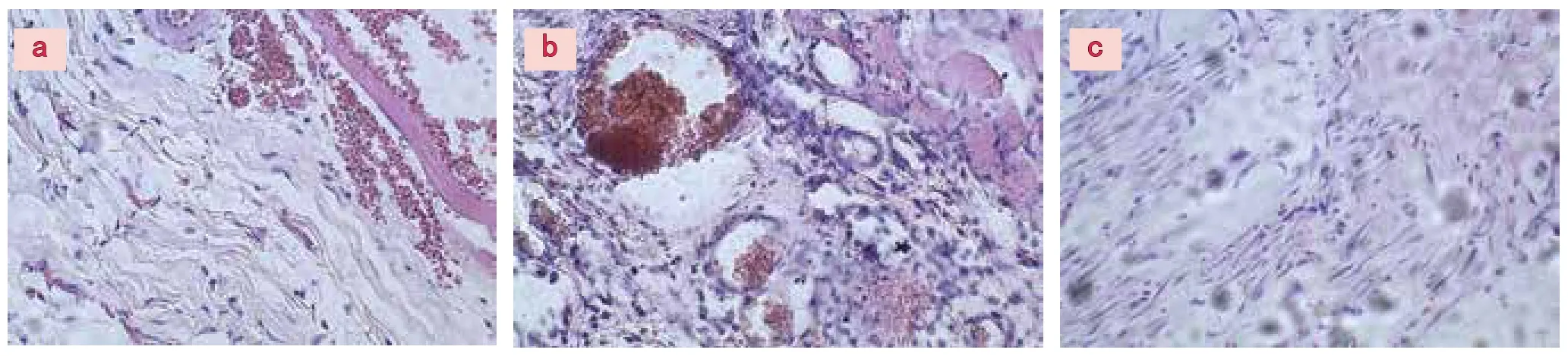
图3 创伤皮肤组织免疫组织化学染色:a 损伤后1d,皮肤表皮细胞、扩张的血管内皮细胞、成纤维细胞、浸润的中性粒细胞中的胞浆中内可见少许IL-1β免疫反应阳性物,呈弱染色(IHC×400);b 损伤后3d,IL-1β在表皮细胞、成纤维细胞、巨噬细胞、中性粒细胞、的胞浆表达增强,呈强染色(IHC×400);c 损伤后7d,表皮细胞、成纤维细胞的胞浆内IL-1β免疫反应阳性物减弱,呈弱染色(IHC×400)
2.3.2 皮肤创伤后IL-1β的变化 损伤后1d,皮肤表皮细胞、扩张的血管内皮细胞、成纤维细胞、浸润的中性粒细胞中的胞浆中可见IL-1β免疫反应阳性物(图3-a)。损伤后3d,损伤区大量炎症细胞浸润,成纤维细胞增殖,IL-1β在表皮细胞、成纤维细胞、巨噬细胞、中性粒细胞的胞浆表达增强,表达强度明显高于损伤后1d组(P<0.05)(图3-b)。损伤后7d,表皮细胞、成纤维细胞的胞浆内IL-1β免疫反应阳性物减弱,较损伤后3d有明显差异(P < 0.05)(图 3-c)。
免疫组织化学方法对照实验结果均为阴性。
表1 不同时间段未愈合面积和IL-1β免疫反应阳性物平均光密度值 (±s)
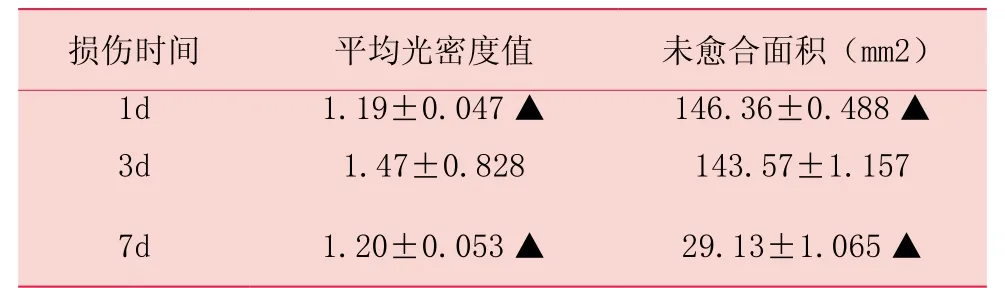
表1 不同时间段未愈合面积和IL-1β免疫反应阳性物平均光密度值 (±s)
备注:▲大鼠皮肤创伤后1d、7d与3d比较,P<0.05
损伤时间 平均光密度值 未愈合面积(mm2)1d 1.19±0.047▲ 146.36±0.488▲3d 1.47±0.828 143.57±1.157 7d 1.20±0.053▲ 29.13±1.065▲
3 讨 论
3.1 大鼠皮肤创伤修复面积和组织病理变化
本实验结果示:大鼠皮肤创伤后1d、3d、7d的创伤皮肤未愈面积逐渐缩小,1d、7d组与3d组存在统计学差异(P<0.05)。损伤后1d,镜下可见真皮层毛细血管扩张充血,血栓形成,炎性细胞浸润损伤周围,表明皮肤损伤后1d处于损伤修复的止血和炎症反应阶段。相关研究显示:在皮肤创伤后的止血和炎症反应阶段,毛细血管收缩、血小板聚集、纤维蛋白凝块形成、多种修复细胞、生长因子以及细胞外基质参与此过程[4-6]。损伤后3d,肉芽组织大量形成并向创口生长,损伤区周围可见大量成纤维细胞、巨噬细胞及新生毛细血管,此期进入细胞增殖和分化阶段。Demidova-Rice TN等[7]认为:在此阶段,血管开始形成,炎症细胞及上皮细胞、真皮细胞分泌生长因子,诱导细胞增殖,启动细胞迁移。创口内大量成纤维细胞增生,合成细胞外基质,形成富含新生血管的肉芽组织。细胞增殖分化是动态进行的,细胞和细胞外基质通过生物因子介导而相互作用。损伤后7d,肉芽组织已基本填平创口,成纤维细胞大量分泌胶原蛋白;肉芽组织逐渐纤维化并向瘢痕组织转变。在损伤区周围可见大量梭形细胞核的纤维细胞,炎性细胞少见此时期进入组织重建或瘢痕形成阶段。Honnegowda TM等[8]认为肉芽组织被重塑过程中,富含胶原蛋白Ⅰ的细胞外基质将会逐渐取代胶原蛋白Ⅲ、纤维蛋白、纤连蛋白、透明质酸等。胶纤维母细胞及肌成纤维细胞逐渐向损伤区迁移,参与肉芽组织基质重建。最后,成纤维细胞凋亡,形成相对无细胞、其抗张强度和正常皮肤组织相仿的瘢痕组织。
3.2 大鼠皮肤创伤后IL-1β的表达变化
白介素1(IL-1)是一种免疫调节因子,参与了固有免疫细胞和淋巴细胞的分化,在自发性炎症、自身免疫和感染性疾病中发挥主要作用。IL-1炎症因子家族和IL-1受体成员(IL-1α、IL-1β、IL-1受体拮抗剂、IL-18,IL-33 、IL-36、IL-37、IL-38)在炎症反应中通过IL-1受体发挥各自独特的作用[9-10]。本实验通过免疫组化染色对损伤边缘皮肤中的IL-1β免疫阳性反应物进行观察,并对IL-1β阳性反应物进行了光密度检测,对其表达水平行半定量分析。结果发现IL-1β在动物上皮组织、巨噬细胞、成纤维细胞中有表达,阳性反应物主要定位在胞核、胞浆和基质中。这表明了当机体受到创伤等严重打击后,体内会相续启动一系列复杂的细胞生物学效应,包括应激信号的激活和传递、炎症反应失衡、各种有害因素的释放。
本实验中,大鼠皮肤创伤后1d至3d,IL-1表达逐渐增强,在3d达到高峰,3d后随着时间的推移,表达逐渐减弱。同时,实验数据分析表明,在损伤后1d至3d,大鼠的创伤面积愈合率为2%,3d至7d的创伤面积愈合率为79%,远远大于大鼠皮肤损伤后前3天的愈合率。笔者认为大鼠皮肤愈合速度可能会随着炎症因子IL-1β的表达逐渐减弱,而逐渐增快。这可能与IL-1β激活的几条重要的信号转导途径相关,例如:IL-1受体相关激酶途径、磷脂酰肌醇3激酶信号转导途径、JAK STAT信号通路和离子通道[11]。乐海浪等[12]认为:创伤后炎症反应在创伤的病理过程中发挥了重要的作用,可能诱发部分创伤并发症,例如:脓毒症、多器官衰竭、高代谢、深静脉血栓形成等。TNFα、IL-1、IL-6、C-反应蛋白等均是创伤后炎症反应的敏感指标,能反应创伤患者的病情,评价炎症反应的严重程度。陈先玖等[13]采用舒筋活血汤治疗慢性创伤性膝关节滑膜炎患者,结果显著降低了TNF-α、IL-1β水平,改善了关节疼痛症状,提高了治疗总有效率。朱晓燕等[14]采用香连金黄散下调感染皮肤局部的炎症因子IL-1β等表达,使实验组皮肤恢复效果优于对照组。李凤蕾等[15]认为采用高剂量乌灵菌粉可改善PTSD大鼠焦虑样行为,这种作用可能与其降低海马组织中IL-1β、IL-6的水平有关。因此,临床中可通过早期监测这些重要炎症指标,采取适当的措施阻止炎症反应的进一步发展,以有效降低MODS发生率,减少创伤患者死亡率,促进创口愈合,缩短愈合周期。
但是,损伤修复的作用机制并不是通过单一因子的调节,而是一个复杂的分子网络。炎症相关酶、炎症介质、细胞因子、黏附因子等在炎症过程中都发挥着重要作用,特别是 IL-1和TNF-α等,对炎症反应起重要调节作用[16]。抑制促炎因子是否能促进伤口的愈合,仍值得进一步深入探索。

