纳米氧化铜对人肝癌细胞的毒性作用
张金波 吕冬霞 钟健 卢春凤
(佳木斯大学 1基础医学院,黑龙江 佳木斯 154007;2 2017级临床7班)
纳米氧化铜具有热稳定性、催化性能和一定的抗菌效应,因此可用于抗菌材料、生物医学陶瓷材料、光学电子、催化剂、废水处理等行业中〔1~5〕。由于众多的纳米氧化铜产品开发和利用,它已不可控地分布于空气、水、土壤中,生物体会通过皮肤、呼吸道等多种途径摄入,因此,纳米氧化铜是否会给生物体带来影响已成为生物医学领域研究的热点问题。肝脏作为消化系统的重要器官,具有清除体内外毒性物质、保护机体免受毒素侵袭的作用。肝脏、脾脏、肾脏等脏器是纳米颗粒蓄积的部位,因此,纳米氧化铜蓄积可能对肝脏造成一定的影响。人肝癌HepG2细胞分化程度较高,具有较完整的代谢系统,可作为评价化学危险性的理想体外模型〔6〕。因此,本研究以HepG2细胞为细胞模型,通过对细胞增殖活性和乳酸脱氢酶(LDH)的检测探索纳米氧化铜的毒性作用,为纳米氧化铜的安全性评估和合理地应用提供相关依据。
1 材料和方法
1.1材料 HepG2细胞:购自中国科学院上海生命科学研究院。二氧化碳细胞培养箱:上海易亮医疗器械有限公司,激光共聚焦显微镜:日本Olympus公司,全自动多功能酶标仪:美国Bio Tek公司。纳米氧化铜颗粒:球状,直径40 nm,杭州万景新材料有限公司。二甲基亚砜(DMSO):美国Sigma公司,改良型杜氏伊格尔培养基(DMEM)、胎牛血清:美国Gibco公司,LDH试剂盒:南京建成生物有限公司,胰蛋白酶、CCK-8试剂盒:上海碧云天生物技术有限公司。纳米氧化铜颗粒悬液的配制:用1 ml磷酸盐缓冲液(PBS)溶解1 mg纳米氧化铜颗粒粉末,超声振荡至完全溶解,高压蒸汽灭菌后密封,4℃冷藏;用无血清培养基稀释成需要的浓度待用。
1.2细胞培养与染毒 将细胞悬液加入到6孔板,每孔加入2 ml,接种密度是1×105/ml,培养24 h后把培养液弃去,用浓度是0(对照)、25、50、100、200 μg/ml的纳米氧化铜颗粒处理细胞,二氧化碳细胞培养箱培养24 h。
1.3形态学改变 将细胞悬液以1×105/ml加入到6孔板中,培养24 h后把培养液弃去,用浓度是0(对照)、25、50、100、200 μg/ml 的纳米氧化铜颗粒处理细胞,24 h 后,通过倒置显微镜观察细胞形态。
1.4Hoechst33258细胞核染色 将细胞悬液以1×105/ml加入到6孔板中,培养24 h后把培养液弃去,用浓度是0(对照)、25、50、100、200 μg/ml 的纳米氧化铜颗粒处理细胞,培养24 h后把培养液弃去,PBS 液冲洗,用4%甲醛室温下固定15 min,PBS冲洗,染色液染色15 min,PBS冲洗,运用激光共聚焦显微镜显示细胞核形态变化。
1.5细胞活性的CCK-8法测定 将细胞悬液以8×104/ml加入96孔板,培养24 h后把培养液弃去,用浓度是0(对照)、25、50、100、200 μg/ml 的纳米氧化铜颗粒处理细胞,培养24 h后加入CCK-8 10 μl,培养2 h后使用酶标仪测定450 nm处的吸光度,计算细胞存活率。每组设定4个复孔。
1.6细胞膜完整性的测定 将细胞悬液以8×104/ml加入96孔板,培养24 h后把培养液弃去,用浓度是0(对照)、25、50、100、200 μg/ml 的纳米氧化铜颗粒处理细胞24 h,按照试剂盒说明书对细胞上清液中LDH活力进行检测。每组设6个复孔。
1.7统计学方法 运用SPSS17.0 软件,多组间比较采用单因素方差分析和方差齐性检验。进一步进行组间两两比较,若方差齐时,采用SNK检验;若方差不齐,采用Games-Howell 检验;率的比较采用χ2检验。两组比较采用独立样本t检验。
2 结 果
2.1细胞形态学变化 对照组细胞呈正常的梭形,细胞贴壁生长,外形规则,轮廓清晰;染毒浓度是25 μg/ml时,细胞形态变得不规则,开始变圆;染毒浓度达50 μg/ml时,细胞变形明显,变小变圆,轮廓不清楚,细胞间隙增大;染毒浓度达到100 μg/ml时,细胞变成圆形,胞质不通透,细胞生长状态差,不能牢固贴壁,部分细胞漂浮在细胞液中,可见细胞碎片。见图1。
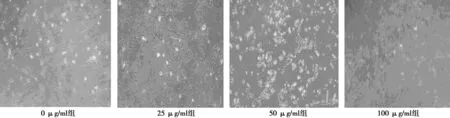
图1 不同浓度纳米氧化铜染毒后HepG2细胞的形态变化(×200)
2.2细胞核染色 对照组细胞核呈长圆形,外形规则,轮廓清楚;染毒浓度是25 μg/ml时,部分细胞核可见染色质呈凝集状态,染毒浓度达50、100 μg/ml时,细胞核缩小,染色质凝集程度变高,发生凋亡改变。见图2。
2.3细胞活性的检测结果 25、50、100、200 μg/ml的纳米氧化铜处理细胞后,细胞存活率分别为(88.30±5.58)%,(85.68±3.91)%,(64.93±2.95)%,(47.73±1.98)%,对照组(0 μg/ml组)细胞存活率为100%。不同浓度纳米氧化铜染毒组HepG2细胞的存活率与对照组相比均明显降低(P<0.05);细胞存活率随着纳米氧化铜染毒浓度的上升呈下降趋势。
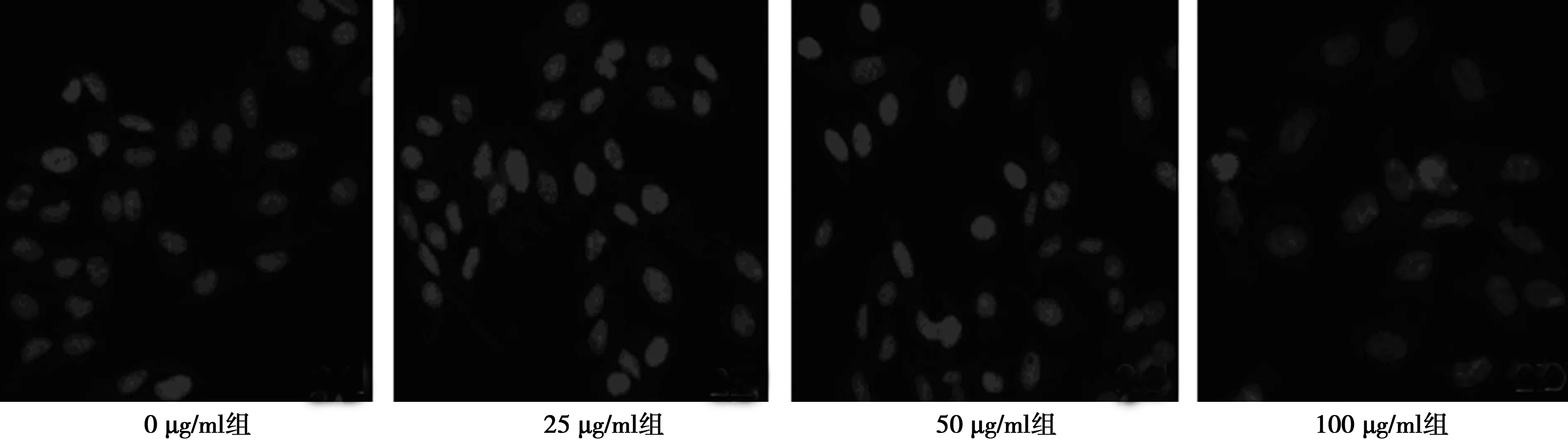
图2 不同浓度纳米氧化铜染毒后细胞核形态变化(Hoechst33258染色,×10)
2.4细胞膜完整性的测定结果 0、25、50、100 μg/ml纳米氧化铜处理细胞后,细胞上清液中LDH活力分别为(667.83±6.06)、(824.28±27.30)、(1 315.62±23.04)、(1 792.30±10.20)μg/ml。25、50、100 μg/ml纳米氧化铜组HepG2细胞LDH的活力与对照组(0 μg/ml组)相比均升高(P<0.01);细胞中LDH活力随着纳米氧化铜染毒浓度升高呈上升趋势。
3 讨 论
当化合物或颗粒在三维空间的尺寸至少有一个维度在1~100 nm就称纳米粒子〔7〕。由于其具有特殊的理化性质〔8〕,现已用于生物医药、机械环保、电子、化妆品等领域〔9〕。纳米氧化铜具有良好的分散性、热稳定性、抑菌性能、催化特性等特点,被用于半导体、抗菌制剂和催化剂等领域〔10〕。已有研究表明,纳米氧化铜能够对机体产生毒性效应〔11〕。所以,研究纳米氧化铜对生物体的毒性效应更加重要,丰富纳米材料毒性的理论数据,可为其科学、合理的应用和安全处理提供理论论据〔12〕。
纳米粒子具有特殊的理化性能,使其更容易通过细胞膜而进入细胞〔13,14〕,引起细胞形态发生一定变化。Gong等〔15〕认为纳米粒子会对细胞膜造成一定损害,使细胞皱缩,无法牢固贴壁。李娜〔16〕发现纳米氧化铜处理 A549细胞后,细胞发生明显的形变,纳米氧化铜可分布于细胞质、溶酶体、线粒体及细胞核等细胞器中。Wang 等〔17〕研究表明,纳米氧化铜能够到达溶酶体膜,对其破坏。本实验结果也表明纳米氧化铜达到一定浓度对细胞具有一定的毒性。随着纳米氧化铜染毒浓度增加,可见凋亡的特征性改变,如染色质高度凝集、核固缩等。
研究显示〔18,19〕,纳米氧化铜会影响细胞增殖活性,使细胞产生过多的氧自由基(ROS),启动细胞凋亡。本研究证实,纳米氧化铜染毒组细胞存活率明显降低,且随着纳米氧化铜染毒浓度的上升呈下降趋势。Maqsood等〔20〕用22 nm的氧化铜作用于HepG2细胞,细胞存活率也会下降,且与纳米氧化铜浓度呈正比,与本实验结果相符。
LDH存在于活细胞胞质中,能够把乳酸催化成丙酮酸。正常细胞会将少量LDH释放到细胞外,如果细胞膜遭到破坏,LDH会大量释放到细胞外液中,所以细胞膜是否受损可以通过细胞外液中LDH的活力来判断。实验证明,纳米氧化铜染毒组LDH的活力明显升高,且随着纳米氧化铜染毒浓度升高呈上升趋势。说明纳米氧化铜颗粒能使细胞膜发生损伤,使细胞的增殖受到抑制引起死亡。Akhtar等〔21〕研究发现,5~15 μg/ml纳米氧化铜颗粒作用于小鼠胚胎成纤维细胞BALB 3T3,LDH活性显著增高,表明纳米颗粒能损害细胞膜,对细胞具有剂量相关性毒性效应,与本研究结果相符。
综上所述,40 nm氧化铜颗粒能抑制HepG2细胞增殖,使细胞形态发生改变,细胞膜发生损伤,对细胞产生毒性效应。

