二甲双胍改善内皮细胞胰岛素抵抗作用的研究
毕欣荣,陈泽姣,陈晨晨,印红梅*,陈海燕*
(1.吉林大学第一医院 干部病房,吉林 长春130021;2.长春市肿瘤医院)
二甲双胍是2型糖尿病的一线用药,已经成为全球应用最广泛的口服降糖药物,已有确切证据表明二甲双胍具有心血管保护作用,可以降低2型糖尿病患者心血管事件的死亡风险及急性心肌梗死的发生率,且这种心血管保护作用可能独立于降糖作用之外[1]。目前认为二甲双胍具有抑制动脉粥样硬化、改善胰岛素抵抗、提高心肌供能、抗炎、调脂、降压、降体重的综合作用,但其血管保护的确切机制仍然不明确。我们通过在体外培养人脐静脉内皮细胞(HUVEC),建立内皮细胞的胰岛素抵抗模型,加入药物二甲双胍,观察其对一氧化氮(NO),内皮一氧化氮合成酶(eNOS)的影响,探讨二甲双胍改善胰岛素抵抗内皮细胞功能的机制。
1 材料与方法
1.1 材料
1.1.1细胞 HUVEC由哈尔滨医科大学生物化学实验室馈赠。
1.1.2试剂 低糖DMEM培养基(美国Fisher Scientific公司),胰岛素(诺和灵R,丹麦诺和诺德公司),地塞米松(遂成药业有限公司),葡萄糖注射液(中国大冢制药有限公司),胰蛋白酶(美国Sigma公司),胎牛血清(GIBCO),二甲基亚砜(DMSO)(SIGMA公司),四甲基偶氮唑蓝(MTT)(美国Amerson公司),葡萄糖试剂盒(南京建成生物制品有限公司),NO试剂盒(南京建成生物制品有限公司),ET-1试剂盒(南京建成生物制品有限公司)。
1.2 方法
1.2.1血管内皮细胞胰岛素抵抗模型的建立及鉴定 HUVEC 用 5.5 mM 的 DMEM 培养基培养。第3至4代内皮细胞,待细胞长满培养瓶底后,倒掉旧培养基,用 D-Hanks 液轻轻荡洗 3 次,加入浓度为 0.25%的胰蛋白酶液,镜下观察,待大多数细胞变圆后,弃消化液,加入 DMEM 培养基终止消化,用吸管轻轻吹打,使细胞分散,倒置显微镜下观察,计数,然后用 DEME 培养液将细胞稀释为 1×105个/ml 的细胞悬液,将处于对数生长期的细胞接种于 96 孔板上(接种密度 1×105个),在 37℃,5% CO2饱和湿度培养箱中培养,于接种 12 h后,弃去原培养基,用 PBS 洗两次,将细胞分为9组,每组6孔,加入200 μl不同胰岛素浓度的培养液,其中一组为低糖DMEM培养基,即阴性对照组。其余8组分别在低糖完全培养基的基础上配制成8种胰岛素浓度不同的高糖培养液,配制浓度如下:1×10-2胰岛素组(1×10-2mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-3胰岛素组(1×10-3mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-4胰岛素组(1×10-4mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-5胰岛素组(1×10-5mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-6胰岛素组(1×10-6mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-7胰岛素组(1×10-7mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-8胰岛素组(1×10-8mM胰岛素+30 mM葡萄糖+1 μM地塞米松)、1×10-9胰岛素组(1×10-9mM胰岛素+30 mM葡萄糖+1 μM地塞米松),分别于加药后继续培养24 h、48 h、72 h后另取一块 96 孔板,每孔加入工作液200 μl,选取 10 个孔分别加入标准液 1-10 μl并加入不同浓度的工作液使系统终体积为 210 μl。分别取各实验组及对照组中的培养基 2 μl分别加入含 200 μl 工作液不同孔中,再加入工作液 8 μl 使系统终体积为 210 μl,另设空白对照孔及完全培养基组,加入 2 μl完全培养基,检测 OD 值计算平均值。取培养基 2 μl,葡萄糖氧化酶法测定葡萄糖含量,于37℃继续培养15 min,酶标仪震荡15 min,于492 nm波长下,酶标仪测定吸光度。
1.2.2二甲双胍对胰岛素抵抗内皮细胞的保护作用 我们成功的建立了胰岛素抵抗的内皮细胞模型,选取1×10-4胰岛素组(1×10-4mM胰岛素+30 mM葡萄糖+1 μM地塞米松)培养液处理的内皮细胞作为研究对象,将细胞分为10组,每组有6个孔。在普通培养基中添加不同浓度的二甲双胍,配置成不同浓度的培养液。10组包括阴性对照组(正常的低糖培养基),模型组(1×10-4mM胰岛素+30 mM葡萄糖+1 μM 地塞米松),二甲双胍组(共8组,二甲双胍的药物浓度分别为:1×103mM、1×102mM/L、1×10 mM/L、1 mM/L、1×10-1mM/L、1×10-2mM/L,1×10-3mM/L、1×10-4mM/L)。各组在给药后48小时,弃去上清液,从每孔中吸取2 μl,用葡萄糖氧化酶法检测葡萄糖含量,严格按照试剂盒说明书操作。采用硝基还原酶法测定一氧化氮的含量,采用放射免疫方法测定内皮素含量,采用方差分析,用SPSS 20.0 for Windows统计软件对数据进行分析处理,组间两两比较用LSD-t检验,检测结果用平均值±标准差来表示,P<0.05被认为是有显著的差异,P<0.01代表非常显著的差异。
1.2.3Western blotting检测eNOS表达 通过上述实验,可筛选出二甲双胍的最佳浓度和作用时间,使用Western blotting方法检测eNOS的表达。通过目的蛋白与内参蛋白的灰度值来进行比较;使用SPSS 20.0软件进行统计分析。
2 结果
2.1 血管内皮细胞胰岛素抵抗模型的成功建立
本实验组在大量的前期工作中已经成功筛选出了内皮细胞胰岛素抵抗模型的最佳胰岛素及葡萄糖含量,本次实验中,再次对此模型进行鉴定,采用葡萄糖氧化酶法测定葡萄糖含量。如表1中所示,与对照组相比,1×10-4胰岛素组(1×10-4mM胰岛素+30 mM葡萄糖+1 μM地塞米松)的上清液中葡萄糖浓度明显增加,表明葡萄糖消耗显著降低(P<0.05),我们认为此时内皮细胞倾向于胰岛素抵抗模型,表明模型建立成功。
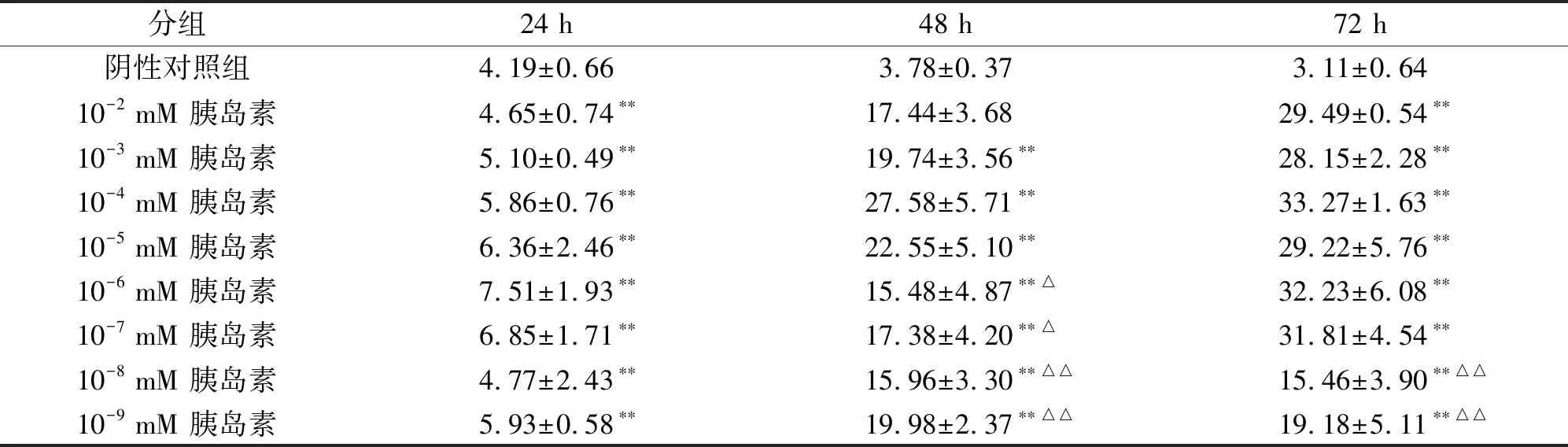
表1 胰岛素抵抗内皮细胞对葡萄糖的消耗
与对照组相比:*P<0.05,**P<0.01;与10-4mmol/L 胰岛素组相比:△P<0.05,△△P<0.01。葡萄糖水平用来表示,单位mmol/L。
2.2 二甲双胍对胰岛素抵抗的内皮细胞的保护作用
2.2.1二甲双胍对胰岛素抵抗的内皮细胞NO和ET-1的影响 在成功鉴定内皮细胞的胰岛素抵抗模型后,我们分别在低糖DMEM培养基上添加不同浓度的二甲双胍,继续作用48小时,再次进行葡萄糖氧化酶法检测葡萄糖含量,并检测反应内皮细胞功能的相关指标NO和ET-1。如表2及表3中所示,当药物二甲双胍作用48 h后,与对照组相比,在103-10-4mM二甲双胍组葡萄糖含量均明显减少(P<0.05),表明二甲双胍对胰岛素抵抗内皮细胞葡萄糖消耗具有显著改善作用。在10-1-10-3mM的二甲双胍组NO含量显著增加(P<0.05),NO和葡萄糖没有表现出明显相关性(P>0.05),反映出该药物可直接增加血管内皮NO含量,而不依赖于葡萄糖含量的变化。ET-1的水平在10-1-10-3mM药物组显著性减少(P>0.05),ET-1与葡萄糖也没有表现出明显相关性(P>0.05),表明二甲双胍在同一时间,降低了ET-1水平。
2.2.2二甲双胍对胰岛素抵抗的内皮细胞eNOS表达的影响 通过检测了胰岛素抵抗的血管内皮细胞模型组(IR组),阴性对照组即低糖培养基培养的血管内皮细胞(NC组)和4组浓度不同的二甲双胍组(二甲双胍浓度分别为1×10-1mM、1×10-2mM、1×10-3mM、1×10-4mM),通过半定量的分析方法检测eNOS的表达,见表4、图1。胰岛素抵抗模型组的血管内皮细胞中eNOS表达比阴性对照组中正常血管内皮细胞明显减少,而加入不同浓度的二甲双胍后胰岛素抵抗的内皮细胞中eNOS的表达均有明显的增强,差异有统计学意义(P<0.01),其中1×10-3mM的二甲双胍组eNOS的表达最强。
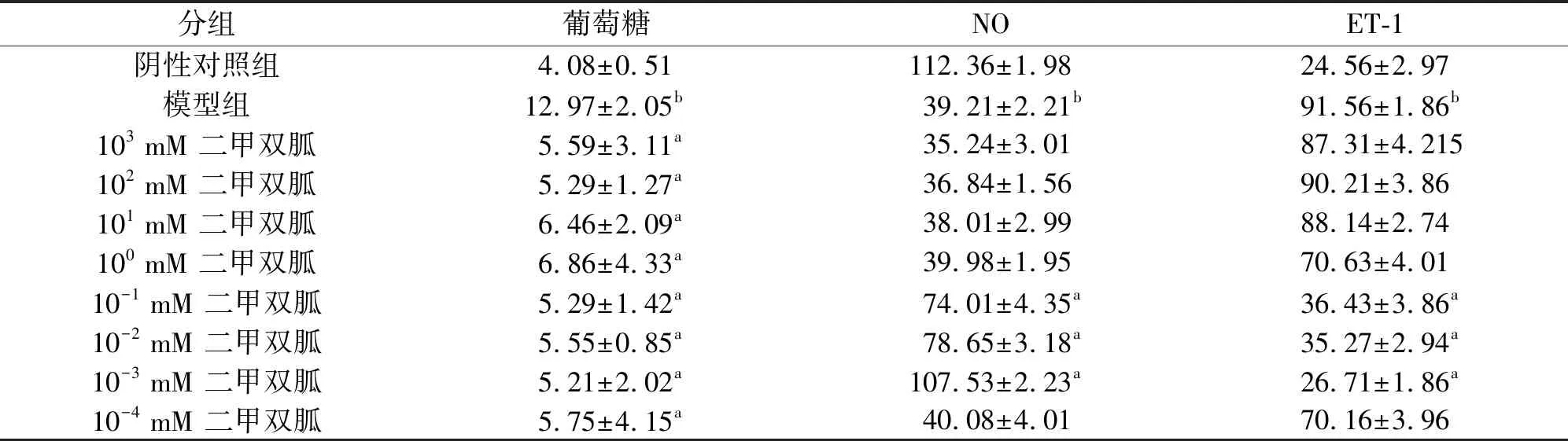
表2 二甲双胍处理HUVEC后NO 和ET-1的表达
A与模型对照组相比:P<0.01;b与阴性对照组相比:P<0.01;NO和ET1的水平用来表示,单位mmol/L。
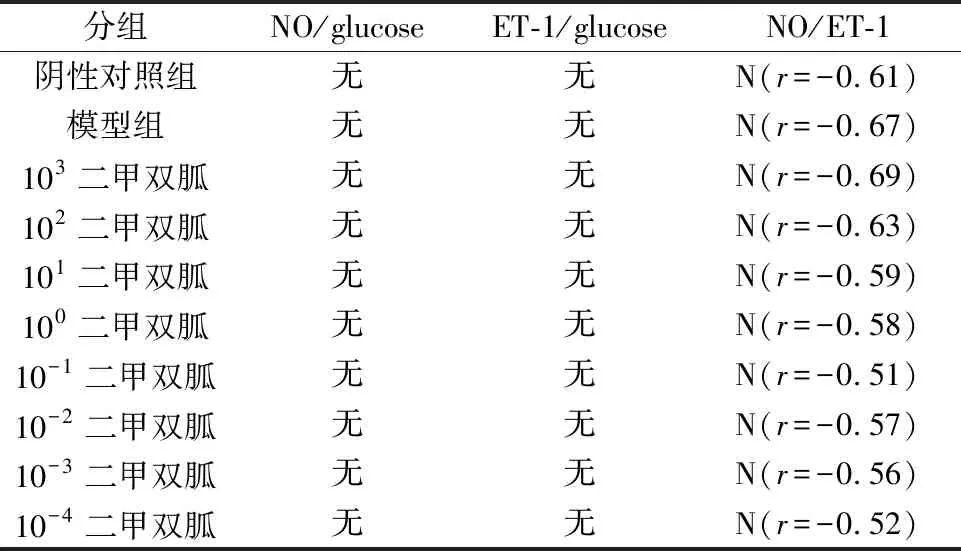
表3 二甲双胍处理HUVEC后血糖、NO 和ET-1的相关性
N=阴性,P=阳性 (P<0.05)
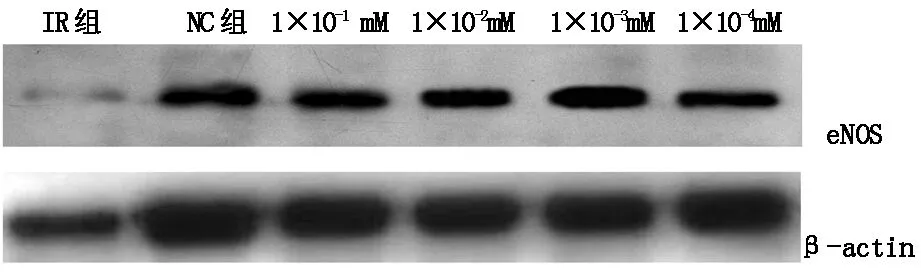
IR,insulin resistance,胰岛素抵抗;NC,Negative control,阴性对照组

eNOS/β 肌动蛋白IRNCmetformin0.051±0.1160.236±0.198a0.736±0.211ab
acompare to IR,P<0.01;bcompare to NC,P<0.05。
3 讨论
血管内皮功能异常是糖尿病血管病变的重要机制之一,目前认为胰岛素抵抗与内皮细胞功能紊乱明显相关。研究发现,生理浓度的胰岛素可以刺激机体内皮细胞产生NO,起到舒张血管、增加血流的作用;但胰岛素抵抗的病人由于其自身对胰岛素的敏感性降低,NO的生成也相应减少,对血管的保护作用随之减弱[2]。胰岛素抵抗对脂质代谢也产生明显影响,在胰岛素抵抗状态下,脂蛋白脂酶的敏感性降低,使得高密度脂蛋白生成减少,低密度脂蛋白生成增多,低密度脂蛋白是诱发动脉粥样硬化发生和促进动脉粥样硬化进展的独立危险因素[3]。而胰岛素抵抗是通过何种方式导致内皮功能障碍的,目前尚不明确。
目前胰岛素抵抗内皮细胞的机制研究主要是采用动物模型和体外细胞模型,而后者由于其快速、简便、节约的优势,发展迅速。本课题组采用葡萄糖/胰岛素/地塞米松多种药物联合作用进行体外细胞模型实验,成功建立了胰岛素抵抗的内皮细胞模型。我们筛选出了建立人脐静脉内皮细胞胰岛素抵抗模型的最佳胰岛素及葡萄糖含量,通过葡萄糖氧化酶法测定葡萄糖含量。与普通的DMEM低糖培养基相比,1×10-4胰岛素组(1×10-4mM胰岛素+30 mM葡萄糖+1 μM地塞米松)的上清液中葡萄糖浓度明显增加,葡萄糖消耗显著降低,这组内皮细胞成为最佳的胰岛素抵抗模型。
目前有大量的临床和基础研究结果证实二甲双胍对糖尿病的心脑血管并发症具有降糖作用以外的很多益处,可以改善血管内皮细胞的功能,可能与二甲双胍可增加eNOS的磷酸化及其表达,从而增加血浆NO水平及降低全身血管阻力,起到改善内皮功能的作用[4,5]。而胰岛素抵抗状态下,胰岛素受体依赖的磷脂酰肌醇 3-激酶活性降低导致 NO 合成及释放下降,内皮细胞失去 NO 的保护作用,从而加重粥样硬化的病理变化[6]。胰岛素抵抗可抑制eNOS活性使内皮细胞产生的NO减少,血管舒张功能进一步下降。而ET-1是一种强效的血管舒缩因子,NO 与 ET-1 是一对互相制约的因素,共同发挥作用维持血管内皮的平衡。而 eNOS 是激活 NO 发挥其生物学作用的重要物质。本实验结果发现不同浓度的二甲双胍处理后均出现血管内皮NO含量增加、ET-1水平下降,NO和ET-1之间呈负相关,且上述改变不依赖于葡萄糖含量的变化。同时我们通过半定量的分析方法检测eNOS的表达情况。如图1所示,胰岛素抵抗的血管内皮细胞中eNOS表达较正常血管内皮细胞明显减少,而加入不同浓度的二甲双胍后胰岛素抵抗的内皮细胞中eNOS的表达均有明显的增强,这与Noble等人的研究结果一致,他们均认为二甲双胍激活了内皮细胞AMPK活性,从而增强eNOS磷酸化及表达,达到改善血管内皮细胞功能的作用[7]。
二甲双胍作用于胰岛素抵抗的内皮细胞后,可以有效的升高NO水平,降低ET-1水平,增强eNOS的表达;在eNOS的作用下,血管内皮细胞通过上调NO和下调ET-1而起到对抗胰岛素抵抗、保护内皮细胞、对抗粥样硬化的作用。关于二甲双胍保护血管内皮细胞的作用,还有很多其他的机制参与其中。Goldberg等人[5]在一项应用二甲双胍14年的研究中发现该药物可以增加应用者肠道中嗜黏蛋白-艾克曼菌的含量,调控肠道菌群达到降糖及抗动脉粥样硬化的作用。也有研究表明二甲双胍可通过抑制内皮细胞血管紧张素II受体1表达,而达到保护血管内皮功能,减缓糖尿病患者心血管事件发生的有益作用[8]。
综上,二甲双胍是2型糖尿病患者的首选口服降糖药物,其确切的心血管保护作用已得到广泛认可。本研究进一步证实了二甲双胍改善胰岛素抵抗的血管内皮功能与增强eNOS表达、升高NO水平有关,但确切机制还有待深入研究。

