交叉引物扩增法检测食品中大肠杆菌不耐热肠毒素的研究
刘文鑫,袁超文,张力国,冯瑜菲
(1.湛江中心人民医院,广东湛江524045;2.东北大学生命科学与健康学院,辽宁沈阳110169;3.辽宁省重大动物疫情应急中心,辽宁沈阳110161;4.广东医科大学附属医院,广东湛江524001)
随着我国食品工业的快速发展,由食源性致病菌引起的食物中毒和食源性疾病爆发频率呈上升趋势,不仅危害人类的健康和生命,也对公共卫生事业和国家经济造成严重损失[1]。我国卫生部提供统计资料显示,2015年共爆发地区性食源性疾病总数为169 起,患病5 926 人,死亡121 人,其中微生物性食物中毒人数最多,占全年食物中毒总人数的53.7%。食源性病原微生物可通过食物链的任何一个环节随着污染的食物和水进入机体,现已确认有超过30 多种病原菌可以引发食源性疾病,常见的食源性致病菌包括肠出血性大肠杆菌 (enterohemorrhagicEscherichia coli,EHEC)、沙门氏菌(Salmonella spp)、产肠毒素大肠杆菌(enterotoxigenicEscherichia coli,ETEC)和金黄色葡萄球菌(Staphylococcus aureus)等[2]。ETEC 被视为引起人类腹泻的主要病原之一,在全球范围内,每年可导致数亿人发生腹泻,尤其是发展中国家的婴幼儿和儿童。同时也是引起旅行者腹泻的主要原因[3]。ETEC 产生的细菌定植因子(clonization factor,CF)和肠毒素是关键的毒力因子,首先CF 特异性黏附到小肠粘膜上皮细胞表面的受体,随后菌体大量合成并分泌耐热肠毒素(heat-stable enterotoxin,ST)或不耐热肠毒素(heat-labile enterotoxin,LT)刺激肠上皮细胞产生大量环磷酸腺苷(cyclic adenosine monophosphate,cAMP),致使细胞内液体及电解质流失引起人或动物发生严重腹泻[4-5]。随着我国食源性疾病爆发率不断上升,在食品污染所引发的肠道疾病中,LT 仍是不可忽略的重要因素之一[6],因此,快速、灵敏地检测食品中的LT 毒力基因已成为控制食品安全问题的关键。
目前对于不耐热肠毒素毒力基因的检测方法归纳起来可分为传统培养检测技术和分子检测技术,传统培养检测技术操作较为耗时、繁琐、检测灵敏度也较低,在应对突发性食品安全公共事件上,不能满足快速、准确、高灵敏和特异性等要求[7]。分子检测技术主要包括聚合酶链反应技术(polymerase chain reaction,PCR)、DNA 探针技术、生物芯片技术和等温扩增技术等,这些技术具有快速,特异,敏感和节约时间以及劳动成本的特点而被广泛使用。交叉引物等温扩增(cross priming amplification,CPA)技术是近年来被广泛应用的一种新型等温扩增技术,利用5 条特异性引物和具有链置换活性的Bst-DNA 聚合酶在等温条件下对靶基因不断地进行循环扩增[8]。与传统的PCR 方法相比,CPA 技术不仅摆脱了对昂贵仪器设备的依赖,降低检测成本,同时因具有较高的特异性和敏感性,极大程度地提高了检测效率,缩短检测时间[9]。该方法被视为继环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)之后的又一项被广泛用于科学研究、疾病诊断和食品微生物检测等领域的新型核酸等温扩增技术[10]。
本研究以LT 保守序列作为靶基因设计CPA 特异性引物,并与LAMP 和荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)方法进行对比,以期为不耐热肠毒素基因的诊断提供一种快速、灵敏、肉眼即可判断的快速检测方法。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂与样本
Trans 2k plus II DNA Marker、脱氧核糖核苷三磷酸 (deoxy-ribonucleoside triphosphate,dNTPs)、MgCl2、DNA 提取试剂盒:宝生物工程(大连)有限公司;甜菜碱:Sigma 上海贸易有限公司;琼脂糖:北京沃比森科技有限公司;SYBR Green I 染料:北京索莱宝科技有限公司;Bst-DNA 聚合酶大片段:NEB(北京)有限公司;华峰管:广州华峰生物科技有限公司;本研究所用引物均由苏州金唯智生物科技有限公司合成。
46 份生猪肉样品购自当地市场,经鉴定均不含不耐热肠毒素大肠杆菌。
1.1.2 菌种来源
大肠杆菌参考菌株C83903(LT+)、C83920(Sta+)、C44498(Stx2e+)和O157:H7:中国兽医药品监察所;大肠杆菌ATCC 43886(LT+)、产气荚膜梭菌ATCC 13124、嗜水气单胞菌ATCC 7966、肠炎沙门氏菌ATCC 13076、鼠伤寒沙门氏菌ATCC 13311、金黄色葡萄球菌ATCC 25923、金黄色葡萄球菌ATCC 29213、小肠结肠炎耶尔森氏菌ATCC 23715、副溶血性弧菌ATCC 27519、大肠杆菌OS-13(Stb+)均为东北大学生命科学与健康学院保存。
1.2 仪器与设备
电泳仪(DYY-2)、电泳槽(DCY-31D):北京六一仪器厂;生化培养箱(SPX-150B-Z):上海博迅实业公司;凝胶成像系统(Tanon 2500R):上海天能科技有限公司;台式高速离心机(TG16.5):上海卢湘仪离心机仪器有限公司;电热恒温水浴锅(欧莱博H-W420):山东博科科学仪器有限公司。
1.3 方法
1.3.1 引物设计与合成
以不耐热肠毒素家族A 亚基保守序列(GenBank登录号为JX504011.1)为靶基因,应用在线软件Primer-Explorer V4 设计CPA 特异性引物,Real-time PCR 和LAMP 引物序列见表1。

表1 CPA、LAMP和荧光定量PCR扩增引物Table 1 Primers of CPA,LAMP and qPCR assays
1.3.2 模板的制备
将C83903(LT+)菌株接种于麦康凯琼脂平板37 ℃倒置培养16 h~24 h。然后挑取单个菌落接种于LB 液体培养基中,37 ℃200 r/min 过夜振荡培养。取5 mL 培养物,经10 000 r/min 离心3 min,取上清液作为DNA模板,-20 ℃备用。
1.3.3 生猪肉人工随机污染
将C83903(LT+)菌株接种于新鲜无菌的麦康凯培养基中于37 ℃过夜培养后进行1 000 倍稀释,随后将稀释后的菌液随机污染不含LT 毒素的生猪肉样品匀浆液中。10 000 r/min 离心3 min,弃去上清液,用1 mL 0.9%生理盐水悬浮菌体,作为产肠毒素大肠埃希氏菌人工污染样本,并做好记录。
1.3.3 反应条件优化
首先对CPA 的特异性引物进行验证,25 μL 反应体系中含有2.5 mmol/L dNTPs 2 μL、25 mmol/L MgCl22 μL、10×Thermopol Buffer 2.5μL、0.8 mol/L Betaine 2 μL 、8 U/管Bst-DNA 聚合酶大片段,1s 5 μL,2a/3a各2 μL,4s/5a 各1 μL,以上引物浓度均为10 μmol/L,并在60 ℃恒温条件下作用60 min。反应结束后于80 ℃条件下加热5 min 以终止反应。随后将华峰管内反应产物与预先加入的1 μL(2 000×)SYBR Green I 染料混匀后分别于自然光和紫外下观察,并用浓度为2%的琼脂糖凝胶电泳对产物进行分析。
为确定CPA 最佳的反应温度、dNTPs 浓度、Bst 聚合酶浓度、Mg2+浓度、甜菜碱浓度和反应时间,每个反应均重复3 次,反应体系构成与步骤同上。分别改变反应温度(60、62、64、66、68、70 ℃)、dNTPs 浓度(0.2、0.3、0.4、0.5 mmol/L)、Bst 酶浓度 (6、8、10、12 U/管)、Mg2+浓度(1.0、2.0、3.0 mmol/L)、甜菜碱浓度(0.6、0.8、1.0、1.2 mol/L)以及反应时间(15、30、45、60、75、90 min),反应产结束后热终止反应,并用浓度为2%的琼脂糖凝胶电泳进行分析。
1.4 特异性检测
本研究共使用14 株试验菌(6 株大肠杆菌和8 株非大肠杆菌)对CPA 进行特异性检测,同时设定不添加模板的阴性对照并与LAMP 法进行比较。反应结束后将另一侧预先滴加的SYBR Green I 荧光染料与扩增产物缓慢混匀并于自然光和紫外灯下观察,并用浓度为2%的琼脂糖凝胶电泳对扩增产物分析。
1.5 敏感性检测
将C83903(LT+)菌株过夜培养后的新鲜菌液作为模板,进行平板计数,调整初始菌液浓度至8×106cfu/mL,10 倍倍比稀释至8×101cfu/mL,随后继续稀释至浓度为40、20、10 cfu/mL 共9 个稀释度;分别吸取2 μL 稀释后的菌液作为模板进行CPA 敏感性扩增试验,同时与LAMP 和qPCR 扩增结果进行比较。
1.6 人工污染生猪肉样本的检测
分别应用CPA、LAMP 和qPCR3 种方法对46 份经产肠毒素大肠埃希氏菌人工随机污染的生猪肉样本进行检测,用DNA 提取试剂盒对生猪肉样本进行处理并提取DNA 基因组作为模板,CPA 和LAMP 的扩增产物经浓度为2%的琼脂糖凝胶电泳作用后,并与qPCR 反应结果进行比较。
2 结果
2.1 检测方法的建立与优化
本研究应用的CPA 引物具有良好的特异性,可在60 min 内60 ℃条件下完成对LT 毒素基因的大量扩增,经2%琼脂糖电泳后,阳性产物呈不规则梯形条带,而阴性对照无条带。CPA 扩增结果见图1。
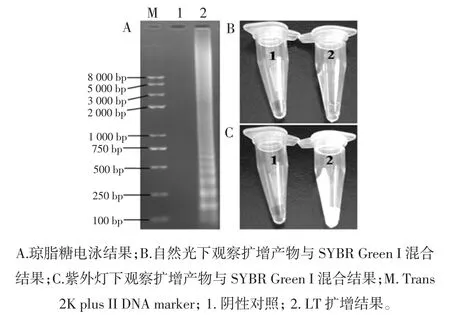
图1 CPA扩增结果Fig.1 Result from CPA amplification
将华峰管内另一侧的SYBR Green I 染料与反应产物缓慢混匀后,肉眼观察阳性管内呈现绿色,阴性呈淡橙色;紫外灯下观察,阳性管内呈现绿色荧光,而阴性管颜色无变化。
LAMP 和CPA 反应条件的优化结果见图2。

图2 LAMP和CPA反应条件的优化Fig.2 Optimization for CPA amplified condition
本研究对CPA 的反应温度、Bst 聚合酶浓度、dNTPs 浓度、Mg2+浓度、甜菜碱浓度和扩增时间分别进行了优化,结果可见在62、64 ℃和66 ℃条件下均可产生梯状条带,故选择62 ℃为最优扩增温度;使用8 U/管Bst 聚合酶浓度扩增时产生梯状条带最清晰,故选择8 U/管为最优浓度;dNTPs 浓度为0.3 mmol/L 扩增产生的条件最清晰;随着反应的进行,于45 min 时出现清晰明亮的梯形条带,随着反应时间的增加条带亮度变化不明显,故选择45 min 为最优扩增时间。根据以上原则CPA 反应的Mg2+浓度和甜菜碱浓度最优值分别为2.0 mmol/L 和0.8 mol/L。
2.2 特异性试验
LAMP 和CPA 特异性试验结果见图3。
用上述优化的CPA 方法分别对14 株不同菌株进行特异性检测,且重复3 次。琼脂糖电泳结果表明,CPA 法检测出携带大肠杆菌LI+基因菌株2 株,其他12 株为非携带LI+基因菌株,与LAMP 检测结果一致,说明建立的CPA 法具有高特异性。
2.3 敏感性试验
LAMP 和CPA 敏感性试验结果见图4。

图3 特异性试验Fig.3 Specificity test of the reactions
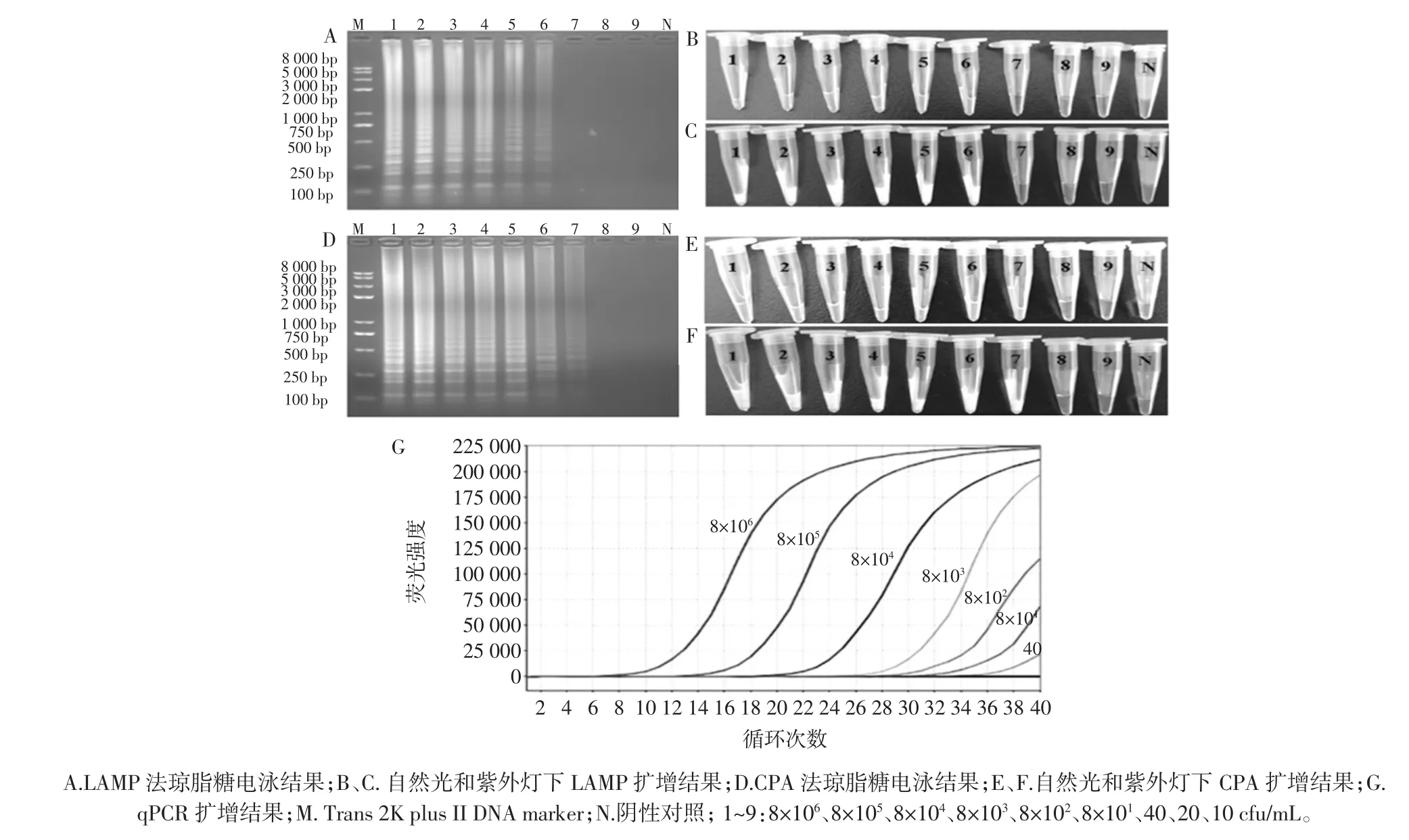
图4 敏感性试验Fig.4 Sensitivity test of the reactions
将过夜培养的纯菌液浓10 倍稀释至8×101cfu/mL,随后稀释40、20 cfu/mL 和10 cfu/mL 共9 个稀释度进行敏感性试验,每个稀释度重复3 次。琼脂糖电泳结果如图4所示,CPA 法与qPCR 法具有相同的检测灵敏度为40 cfu/mL,而LAMP 法灵敏度为8×101cfu/mL,可见CPA 法的检测灵敏度较LAMP 法高2 倍。
2.4 人工污染生猪肉样本检测结果
分别应用CPA 法和LAMP 法对46 份随机污染的生猪肉样本进行快速检测,以qPCR 结果作为参考。结果可见,CPA 和LAMP 方法共检测出携带LT 阳性基因7 株,与qPCR 法检测结果一致,且检出率均为15.2%。

表2 临床样本检测结果Table 2 The detection results of clinical samples
3 结论与讨论
本研究成功设计出针对食源性大肠杆菌不耐热肠毒素全基因保守序列的CPA 特异性引物,通过优化反应温度、Bst 酶浓度、dNTPs 浓度等参数,建立了一种快速、特异、敏感的新型检测方法。建立的CPA 法与LAMP 方法相比,二者均具有较高的特异性,从加样到反应结束整个过程仅需要1.5 h 即可完成对目的基因的特异性扩增,并对非携带目的基因菌株检测呈阴性。敏感性试验结果可见,与之前报道的LAMP 方法相比[11],CPA 等温扩增法和荧光定量PCR 方法具有相同的灵敏度,且较LAMP 法高出2 倍,仅为40 cfu/mL,可满足低拷贝目的基因的检测。本研究应用人工污染生猪肉方法模拟食品抽样检验,以荧光定量PCR 结果作为参照,CPA 和LAMP 方法对人工污染生猪肉的阳性检出率均为15.2%(7/46),说明CPA 作为一种新型的等温检测技术,能够满足食品卫生行业定性检验微生物学的要求。
在CPA 扩增过程中,随着体系内DNA 的不断合成会产生大量的焦磷酸镁沉淀,可根据是否生成白色沉淀判断反应结果,但本研究对LT 毒素基因扩增时,并未发现管内产生肉眼明显可见的白色沉淀,只观察到管内液体为混浊,通过浓度为2.0%琼脂糖凝胶电泳分析可见不同大小的区带阶梯式图谱。同时,为避免在开盖时反应体系产生的大量气溶胶污染周围环境,本研究选择广州华峰生物科技有限公司生产的华峰管进行可视化检测,反应前分别将SYBR Green I 染料和反应体系混合物加入华峰管两侧,反应结束后将二者混合即可判断反应结果,有效地防止气溶胶造成的交叉污染。
综上所述,本研究所建立的CPA 快速检测产肠毒素大肠杆菌的等温扩增方法,不仅具有时间短、低成本、高特异性和高特异性的特点,而且不需要依赖特殊的、精密昂贵的仪器设备和严格的试验条件,为食源性致病菌检测提供了新的解决思路,在感染性疾病诊断和食品卫生检验等领域具有广阔的应用前景。

