紫薯花色苷在贮藏过程中的降解特性
江 甜,李 佳,杨 宁,何 毅,祝振洲,李书艺,杨新笋,何静仁,*
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.湖北省农业科学院粮食作物研究所,湖北 武汉 430064)
紫薯(Ipomoea batat Poir.)又名黑薯,薯肉呈紫色至深紫色,属旋花科一年生草本植物。紫薯中富含花色苷类色素、蛋白质、多糖、硒、淀粉、果胶、纤维素和矿物质等多种营养成分[1],具有抗氧化[2]、抗癌[3]、降血糖[4]、降血压[5]等生理功效。国内外诸多学者对紫薯中的营养物质进行了研究,其中花色苷由于具有潜在的健康益处而受到广泛关注。
在自然状态下,植物组织中的花色苷非常稳定,日照、温度等对其几乎没有影响[6]。但是在纯化、加工及贮藏过程中,花色苷的稳定性易受温度、pH值、光照、抗坏血酸、氧气等因素的影响,导致花色苷降解,引起食品色泽的变化,造成食品品质的下降[7-8]。目前关于热处理、pH值、光照等因素对花色苷影响的研究较多,Li Jie等[9]研究了pH 2~6紫薯花色苷水溶液分别在80~100 ℃热处理条件下花色苷的降解情况,发现紫薯花色苷的降解速率随着温度的升高而增加,并且在相同温度下,pH 3的样品降解速率最慢。Li Jing等[10]研究表明添加抗坏血酸可以增加贮藏过程中紫薯花色苷的降解速率。目前这些研究主要集中于定量分析总花色苷的降解规律,而关于各单体花色苷的降解情况研究较少。为了进一步理解紫薯花色苷的降解特性,有必要研究各单体花色苷的降解规律及降解反应过程中发生的其他反应。本实验主要利用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法对紫薯花色苷的成分进行鉴定分析,并研究紫薯花色苷在不同温度下贮藏98 d期间总花色苷和各单体花色苷的降解情况以及褐变指数和聚合物颜色指数的变化情况,以期为食品中花色苷的稳定化控制提供有利的支持。
1 材料与方法
1.1 材料与试剂
紫薯品种为‘鄂薯12号’,由湖北省农科院粮食作物研究所提供。
磷酸氢二钠、柠檬酸、盐酸、氯化钾、乙酸、乙酸钠、偏重亚硫酸钠 国药集团化学试剂有限公司;AB-8型大孔树脂 沧州宝恩吸附材料科技有限公司;乙腈、甲酸、甲醇(均为色谱纯) 美国Tedia公司。
1.2 仪器与设备
VM0109食物搅拌器 美国Vitamix公司;JE2002电子天平 上海浦春计量仪器有限公司;AL204电子天平梅特勒-托利多仪器(上海)有限公司;STARTER 3100 pH计 奥豪斯仪器(上海)有限公司;TGCXZ-10B超声逆流循环提取机 北京弘祥隆生物技术股份有限公司;TGL205高速冷冻离心机 长沙平凡仪器仪表有限公司;Evolution 220紫外-可见分光光度计、Accela-LTQ XL HPLC-MS/MS仪 美国Thermo Fisher公司;ALPHA 2-4 LD plus冷冻干燥机 德国Christ公司;R-3旋转蒸发仪 瑞士Büchi公司。
1.3 方法
1.3.1 紫薯花色苷的提取纯化
紫薯洗净后切块,加入适量蒸馏水,用食物搅拌器打浆,按料液比1∶8加入体积分数60%乙醇-盐酸溶液(pH 4.0)搅匀,40 ℃超声辅助提取90 min,4 000 r/min条件下离心20 min,得到含有花色苷的上清液,37 ℃条件下减压浓缩除去乙醇,得到富含花色苷的浓缩液。选用已处理的AB-8大孔吸附树脂对紫薯花色苷进行动态吸附-解吸[11],上样流速为3~4 BV/h,吸附饱和后,用蒸馏水洗涤,去除花色苷中的蛋白质、糖类、有机酸等杂质,再用体积分数70%乙醇溶液以1~2 BV/h流速进行解吸,洗脱得到的溶液于37 ℃条件下减压浓缩除去乙醇,得到纯化的花色苷,于-20 ℃下冷冻,后转入冷冻干燥机中冷冻干燥,得到花色苷含量为37.2 mg/g的紫薯花色苷粉末。
1.3.2 紫薯花色苷的结构鉴定
1.3.2.1 HPLC条件
根据Li Jie等[9]的方法稍作改动,进行HPLC-MS/MS分析。色谱柱:反相C18色谱柱(250 mm×4.6 mm,5 μm);流动相:A相为体积分数10 %甲酸水溶液,B相为甲酸-乙腈(10∶90,V/V)溶液;线性梯度洗脱:0~60 min,6%~22% B;60~66 min,22%~30% B;66~68 min,30%~90% B;68~72 min,90% B;72~74 min,90%~6% B;74~80 min,6% B;流速1 mL/min;柱温25 ℃:进样量10 μL;检测波长525 nm;二极管阵列检测器。
1.3.2.2 MS条件
电喷雾离子源;正离子扫描;质量扫描范围m/z 500~2 000;N2流速20 L/min;毛细管电压26 V;毛细管温度270 ℃。
1.3.3 紫薯花色苷溶液的贮藏
称取一定量的紫薯花色苷冻干粉,加入磷酸氢二钠-柠檬酸缓冲液(pH 3.0)配成8 g/L的花色苷溶液,巴氏灭菌后在超净工作台分装,置于4、20、35 ℃避光贮藏,分别取0、7、14、21、28、35、42、49、53、63、70、77、84、92、98 d时的紫薯花色苷溶液,用于各项指标的测定。
1.3.4 总花色苷含量的测定
采用pH示差法测定黑豆花色苷含量[12]。0.3 mL样品分别用pH 1.0 HCl-KCl(取0.2 mol/L KCl溶液25 mL、0.2 mol/L HCl溶液67 mL定容至100 mL)和pH 4.5 CH3COOH-CH3COONa(取CH3COONa 1.8 g、CH3COOH 0.98 mL定容至100 mL)缓冲液稀释,在最大吸收波长λmax和700 nm波长处测定吸光度。总花色苷含量按矢车菊素-3-O-葡萄糖苷计,按公式(1)计算总花色苷含量。

式中:C为总花色苷含量/(mg/g);Ab=(Aλmax-A700nm)pH1.0-(Aλmax-A700nm)pH4.5;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(26 900 L/(mol·cm));L为比色皿宽度(1 cm);MW为矢车菊素-3-葡萄糖苷的摩尔质量(449.2 g/mol);D为稀释倍数;V为样品体积/mL;m为样品质量/g。
1.3.5 聚合物颜色的测定
采用偏亚硫酸氢盐漂白方法测定聚合物颜色指数[13-14]。0.5 mL样品用pH 2.2磷酸氢二钠-柠檬酸缓冲液(取0.2 mol/L磷酸氢二钠4.0 mL、0.1 mol/L柠檬酸106.0 mL混合至110.0 mL)稀释至10 mL。取4 mL稀释后的样品分别加入1 mL偏亚硫酸氢钠(1 mol/L)和磷酸氢二钠-柠檬酸缓冲液(pH 2.2)平衡40 min后,测定最大吸收波长λmax、420 nm和700 nm波长处吸光度,按公式(2)计算聚合物颜色指数。

式中:聚合物颜色=(A420nm-A700nm)+(Aλmax-A700nm)×稀释倍数,其中A是与偏亚硫酸氢钠混合的样品在特定波长处获得的吸光度;颜色密度=(A420nm-A700nm)+(Aλmax-A700nm)×稀释倍数,其中A是与磷酸氢二钠-柠檬酸缓冲液混合的样品在特定波长处的吸光度。
按公式(3)计算褐变指数。

式中:A是与磷酸氢二钠-柠檬酸缓冲液混合的样品在特定波长处的吸光度。
1.3.6 HPLC测定单个花色苷含量变化
HPLC条件同1.3.2.1节。根据液相图谱峰面积变化进行降解动力学分析。
1.3.7 降解动力学分析
研究表明可运用一级反应动力学模型分析花色苷的热降解[13,15-16]。按公式(4)、(5)计算一级反应速率常数(k)和半衰期(t1/2)。

式中:Ct为贮藏t/d时花色苷的含量/(mg/g);C0为0 d时花色苷的含量/(mg/g)。花色苷单体实验中,C0和Ct分别为初始时刻和贮藏t/d后各单体花色苷在525 nm检测波长下的色谱峰面积。
温度对降解速率的影响主要与动力学常数相关,热降解活化能Ea/(kJ/mol)可根据Arrhenius方程(式(6))计算得出。

式中:k0为频率常数/m i n-1;R为气体常数(8.314 J/(mol·K));T为处理温度/K。
根据方程(7)、(8)和(9)分别计算各温度下的焓变(△H/(kJ/mol))、吉布斯自由能(△G/(kJ/mol))和熵(△S/(kJ/mol))[13]。

式中:Ea是活化能/(kJ/mol);h是普朗克常数(6.626 2×10-34J·s);kB是玻尔兹曼常数(1.380 6×10-23J/K);T为绝对温度/K;k为降解速率/d-1。
1.4 数据统计分析
实验结果以平均值±标准差表示,动力学拟合采用Origin 2016软件进行线性拟合。数据显著性差异使用Duncan’s和最小显著性差异法(least significant difference,LSD)进行分析。
2 结果与分析
2.1 紫薯花色苷的结构鉴定
紫薯中含有丰富的花色苷类物质,通过HPLC-MS/MS分析,共分离出17 种化合物,与文献[9,17-19]数据比较,最终鉴定了13 种化合物,由于其他峰相对强度小而未具体分析。所得HPLC图谱见图1,鉴定出的13 种化合物质谱数据见表1。
紫薯花色苷提取物中的花色苷含有矢车菊素和芍药素两种苷元,且与葡萄糖和槐糖共轭形成糖基化。紫薯花色苷多数为酰化花色苷,与咖啡酸、阿魏酸、对羟基苯甲酸结合成单酰基花色苷和二酰基花色苷,且矢车菊素-3-槐糖苷-5-葡糖苷和芍药素-3-槐糖苷-5-葡糖苷是其他酰化花色苷的基本结构。该结论与Li Jie[9]和Liu Xingli[17]等的研究结果一致。另外,本研究鉴定出的13 种结构与Xu Jianteng[18]和Kim[19]等的研究结果存在一些差异,这可能是由于品种不同导致花色苷的组分存在差异。
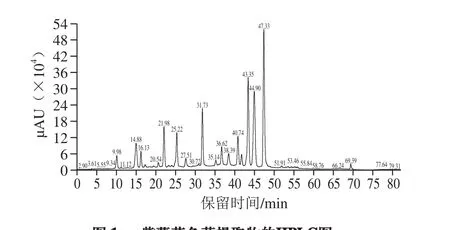
图1 紫薯花色苷提取物的HPLC图Fig. 1 HPLC profile of purple sweet potato anthocyanin extract

表1 紫薯提取物中主要花色苷化合物的质谱数据Table 1 Mass spectral data for the predominant anthocyanin compounds in purple sweet potato extract
2.2 紫薯花色苷提取液贮藏过程中总花色苷的降解动力学

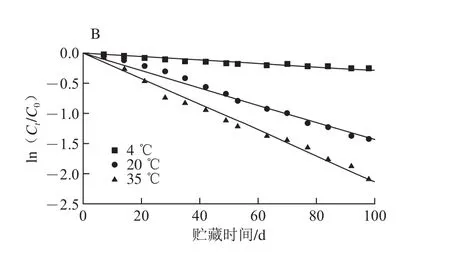
图2 紫薯提取液贮藏过程中总花色苷含量变化(A)和其降解动力学(B)Fig. 2 Changes (A) and degradation kinetics (B) of anthocyanins in purple sweet potato extract during storage at different temperatures

表2 紫薯提取液在不同温度下总花色苷动力学参数Table 2 Kinetic parameters of total anthocyanins in purple sweet potato at different temperatures
温度是影响花色苷稳定性的一个重要因素,温度对花色苷的降解有显著影响[20-22]。由图2A可知,紫薯花色苷随贮藏时间和贮藏温度的变化发生不同程度降解,花色苷随着贮藏时间的延长不断发生降解反应,贮藏温度越高,降解速率越快。贮藏98 d后,4、20 ℃和35 ℃花色苷溶液的残留率分别为77.2%、24.1%和12.3%。结果表明总花色苷的降解随着贮藏温度的升高明显增强,低温条件下贮藏有利于紫薯花色苷的稳定。
赵玉红[23]和Cisse[24]等的研究表明在贮藏过程中花色苷的降解符合一级反应动力学模型特征。图2B和表2表明,在本研究中各温度下紫薯总花色苷的降解也符合一级反应动力学模型特征(R2>0.95)。总花色苷的降解速率常数和半衰期受贮藏温度的影响,贮藏温度越高,紫薯花色苷的降解速率越大,同时伴随着半衰期逐渐缩短。4 ℃时紫薯总花色苷的降解速率为3.03×10-3d-1,半衰期为228.8 d,明显低于35 ℃时的降解速率21.28×10-3d-1,长于35 ℃时的半衰期32.6 d。Li Jing等[10]的研究表明,紫薯花色苷在pH 3.0的柠檬酸-柠檬酸钠缓冲液中,70~90 ℃热处理条件下总花色苷的半衰期为29.4~21.7 h。Li Jie等[9]的研究表明,紫薯花色苷水溶液在pH 3.0、80~100 ℃热处理条件下总花色苷的半衰期为96.3~12.6 h。这些研究结果与本实验结果相似,温度越高,花色苷降解速率越快。吴文丽等[1]报道,紫薯酒在5、25 ℃和37 ℃贮藏条件下,总花色苷的半衰期分别为9 902、1 732 d和59 d,明显比本实验中紫薯花色苷的半衰期长,可能是由于花色苷溶液的体系不同对花色苷的稳定性有不同的影响,或者花色苷的种类差异性影响其稳定性。
活化能通常用来描述分子从常态转变为容易发生化学反应的活跃状态所需的能量[25]。通过使用Arrhenius模型,得到紫薯花色苷的活化能Ea为45.2 kJ/mol。Li Jie等[9]报道,紫薯花色苷的活化能为66.56~111.57 kJ/mol,本研究活化能低于其结果,高于Li Jing等[10]报道的紫薯花色苷活化能16.46 kJ/mol,这可能与紫薯的品种和花色苷溶液的体系不同有关。
热力学参数可以深入解释热降解反应中发生的物理和化学现象。表3显示了不同贮藏温度下花色苷降解的焓(ΔH)、吉布斯自由能(ΔG)和熵(ΔS)的变化。ΔH表示反应物和活化络合物之间的能量差,它与反应物化学键的强度有关[13,26]。如表3所示,在4~35 ℃贮藏温度下,紫薯花色苷降解的ΔH为55.0~55.3 kJ/mol,这表明一定范围内的温度变化对紫薯花色苷降解的ΔH影响较小。表中ΔH都是正值,表明花色苷降解反应为吸热反应[13,26-27],同时证明了温度越高,花色苷降解速率越快。ΔG代表反应物的能量和活化状态之间的差异,通常被当作过程自发性的标准[13,26]。在4~25 ℃贮藏温度下,紫薯花色苷降解的ΔG都是正值(107.2~114.5 kJ/mol),这表明花色苷降解是非自发反应[13,26]。ΔS表示反应体系中分子无序的变化,它通常与具有可以实际反应能量的分子数量有关[13,26]。在本研究中ΔS均为负值(-193.0~-186.2 kJ/mol),表明活化络合物的结构自由度低于反应物[13,26]。且在研究温度范围内ΔS值非常接近,表明温度变化对花色苷降解的ΔS影响较小。

表3 紫薯花色苷在不同温度下热力学参数Table 3 Thermodynamic parameters of anthocyanins in purple sweet potato at different temperatures
2.3 紫薯花色苷提取液贮藏过程中单体花色苷的降解特性
为深入研究紫薯提取液在贮藏过程中花色苷的降解规律,对各单体花色苷进行一级动力学模拟研究。紫薯提取液在贮藏过程中12 种单体花色苷的动力学参数如表4所示,各单体花色苷的降解符合一级反应动力学模型特征。随着贮藏温度的升高,花色苷降解的速率常数增加,半衰期也相应地缩短。速率常数结果表明花色苷的稳定性随着温度的升高而降低。矢车菊素-3-槐糖苷-5-葡糖苷和芍药素-3-槐糖苷-5-葡糖苷两种未酰化的花色苷在4 ℃时的半衰期分别为123.3 d和135.1 d,明显长于在20 ℃和35 ℃贮藏时的半衰期,这说明贮藏温度是影响花色苷降解的主要原因。此外,研究发现矢车菊素-3-槐糖苷-5-葡糖苷和芍药素-3-槐糖苷-5-葡糖苷两种未酰化的花色苷的半衰期比相对应酰基化的花色苷的稍短,说明酰基化花色苷较为稳定[8,28];同时,二酰基花色苷的半衰期稍长于相对应的单酰基花色苷的半衰期,如在35 ℃贮藏条件下,矢车菊素-3-(6’-咖啡酰-6’对羧基苯甲酰槐糖苷)-5-葡糖苷的半衰期为33.4 d,长于矢车菊素-3-对羧基苯甲酰槐糖苷-5-葡糖苷的半衰期22.7 d和矢车菊-3-咖啡酰槐糖苷-5-葡糖苷的半衰期31.3 d。另一方面,从表4中可以看出,在糖苷相同的情况下,矢车菊素的半衰期要短于芍药素,这可能是因为矢车菊素较芍药素多一个羟基,从而更易被氧化。表明花色苷的稳定性可能与其本身的羟基相关[8,25]。对于各单体花色苷的降解,不同的文献稍有差异。这些差别可能与实验原料品种或实验条件有关。在本实验中,在20 ℃和35 ℃贮藏温度下,总花色苷的半衰期分别为48.1 d和32.6 d,和单体花色苷的半衰期差别不明显。但是,在4 ℃贮藏温度下总花色苷的半衰期228.8 d,长于大部分单体花色苷的半衰期,究其原因,可能是因为在紫薯中还含有少量未检测出的酰基化花色苷,在较低贮藏温度下降解缓慢。
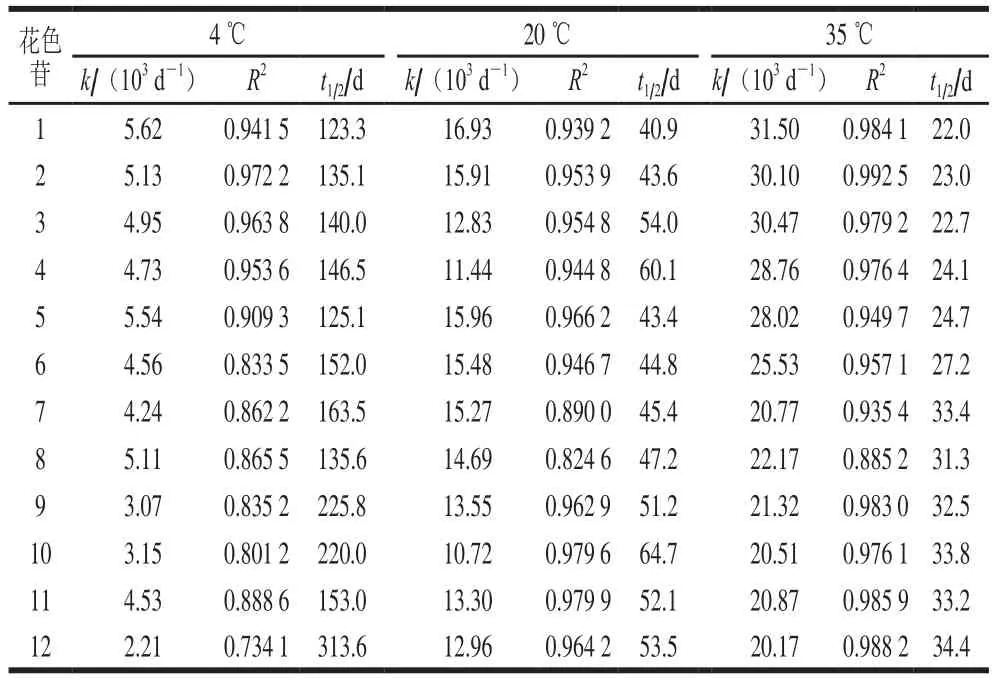
表4 紫薯提取液在不同温度下单个花色苷动力学参数Table 4 Kinetic parameters for indvidual anthocyanins in purple sweet potato at different temperatures
2.4 紫薯花色苷提取液贮藏过程中聚合物颜色指数的动力学
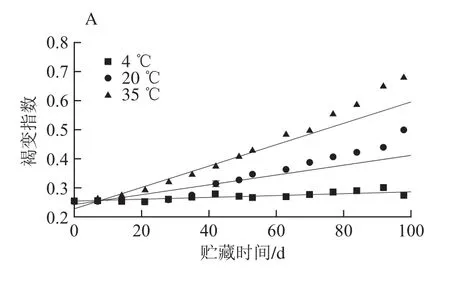

图3 紫薯提取液贮藏过程中花色苷褐变指数(A)、聚合物颜色指数(B)、花色苷含量与聚合物颜色指数之间的关系(C)Fig. 3 Browning index (A), polymeric color (B) and correlation between anthocyanin content and polymeric color (C) of anthocyanins in purple sweet potato extract during storage

表5 紫薯花色苷在不同温度下褐变指数形成和聚合物颜色指数形成的动力学参数Table 5 Kinetic parameters for browning index and polymeric color index of purple sweet potato anthocyanins at different temperatures
花色苷的降解致使最大吸收波长处吸光度减小,而花色苷降解过程中结构的分解产生褐变,引起420 nm波长处吸光度的增加。因此褐变指数可以作为花色苷降解的考察依据[15]。不同贮藏温度下紫薯花色苷褐变指数的变化如图3A所示,褐变指数随着贮藏温度的升高和贮藏时间的延长而增大。如在贮藏时间为42 d时,4、20 ℃和35 ℃花色苷溶液的褐变指数分别为0.28、0.31和0.37,而在贮藏时间为92 d时,4、20 ℃和35 ℃花色苷溶液的褐变指数分别为0.30、0.44和0.65。由表5可知,4、20 ℃和35 ℃贮藏条件下花色苷褐变指数形成的速率常数分别为3.31×10-4、17.12×10-4d-1和36.22×10-4d-1。表5表明在贮藏过程中褐变指数形成的动力学符合零级反应模型(R2>0.83)。Sinela等[15]在玫瑰茄提取物中同样发现随着温度的升高和贮藏时间的延长,花色苷的褐变指数随之增大。
聚合物颜色指数是指聚合物颜色与颜色密度之比。在紫薯花色苷提取物贮藏过程中聚合物颜色指数显著增加(P<0.05)。图3B和表5表明在各温度下紫薯中聚合物颜色指数的形成符合零级反应动力学模型特征(R2>0.88)。4、20 ℃和35 ℃贮藏条件下花色苷聚合颜色形成的速率常数分别为2.95×10-4、18.41×10-4d-1和29.31×10-4d-1。与花色苷降解相似,聚合物颜色形成的速率常数随着温度的升高而增加。在贮藏过程中,聚合物颜色形成逐渐增加可能是由各种反应造成,比如花色苷的降解反应、花色苷的聚合反应以及由还原糖和氨基酸之间的非酶促褐变反应产生络合物与类黑色素颜料[15,21]。在这些反应中,最可能的反应之一是花色苷的降解。如前所述,花色苷降解的速率随着温度的升高而增加。花色苷降解的同时伴随着聚合物颜色指数的增加[15,29]。图3C显示,紫薯花色苷提取液在贮藏过程中花色苷含量(C/(mg/g))与聚合物颜色指数之间呈负相关关系,可用指数关系表示:聚合物颜色指数=0.081 9+0.525 0×e-0.1187C(R2=0.98)。
本研究结果与Martynenko等[13]研究蓝莓汁中花色苷含量与聚合物颜色指数关系的结果一致。紫薯提取液在贮藏期间聚合物颜色增加的第二个最可能的原因是花色苷之间,或者花色苷与其他(非)酚类物质发生缩合反应形成聚合物。

图4 紫薯提取液在不同贮藏温度下的呈色情况Fig. 4 Color of purple sweet potato extract at different storage temperatures
由图4可知,在同一贮藏温度下,随着贮藏时间的延长,紫薯提取液的颜色变化不明显。究其原因,可能是‘鄂薯12号’中含有多酰基化花色苷,而这类花色苷结构的特异性使样品具有色泽保持性。这同时表明花色苷之间,或者花色苷与其他(非)酚类物质可能发生缩合反应形成聚合物使样品具有色泽保持性。因此,需要深入研究花色苷本身或与其他酚类化合物的缩合反应,鉴定花色苷聚合物并确定其体内生物利用度。Sinela[15]和Türkyilmaz[21]等的研究同样发现在贮藏过程中花色苷之间,或者花色苷与其他(非)酚类物质发生缩合反应形成聚合物。
3 结 论
通过研究不同贮藏温度对紫薯总花色苷和各单体花色苷含量变化的影响,模拟动力学模型,分析紫薯总花色苷和各单体花色苷的降解情况以及褐变指数和聚合物颜色指数变化情况,探索紫薯花色苷变化规律,这将有助于抑制贮藏过程中紫薯提取物中花色苷的降解,为紫薯加工产品的花色苷降解提供理论依据,具体得出以下结论:
紫薯中含有丰富的花色苷类物质,通过HPLC-MS/MS分析鉴定出13 种主要的花色苷类化合物。
紫薯提取液在4、20 ℃和35 ℃贮藏条件下,总花色苷和各单体花色苷的降解符合一级动力学模型,且温度越高,花色苷的降解速率越快,半衰期t1/2越短;在糖苷相同的情况下,矢车菊素的半衰期要短于芍药素;在相同花色素配体情况下,酰基化花色苷的半衰期要长于未酰基化花色苷,且二酰化花色苷的半衰期长于单酰化花色苷;通过热力学分析表明热降解反应为吸热非自发反应。
花色苷褐变指数和聚合物颜色指数随贮藏时间的延长和贮藏温度的升高而增大,并且聚合物颜色指数与花色苷含量之间呈指数关系。

