脑血管内皮细胞Prmt5在脑血管发育过程中的表达及其下游靶分子
梁爽,杨晓,王俊
军事医学研究院 生命组学研究所,北京 102206
血管发育过程主要经历2 个阶段:血管发生指来自中胚层的成血管细胞形成原始血管网络的过程;原始血管丛的内皮细胞经历出芽、增殖、修剪等复杂的重塑过程发育形成成熟血管网络的过程即为血管形成。脑血管主要通过血管形成过程发育而成[1]。胚胎期8.5~9.5 d 时脑膜血管丛开始在神经管周围发育,胚胎期10 d 左右侵入神经管,通过血管形成完成神经管的血管化。与其他组织血管相比,脑血管在发育过程中还需要建立获得独特的血脑屏障(blood-brain barrier,BBB)。表达丰富的紧密连接及多种转运蛋白的脑内皮细胞与覆盖其外的周细胞、星型胶质细胞等共同构成了血脑屏障,严格控制各种物质进出中枢神经系统,保障中枢神经系统营养与氧气供应的同时,也保护大脑免受毒素和病原体的侵害,维持了中枢神经系统的稳定[2]。此前研究发现,血脑屏障在胚胎期15.5 d 时开始逐渐发育成熟,这个过程中紧密连接分子细化、细胞转胞吞过程减少、白细胞黏附分子下调和外排转运蛋白表达增加[3-6]。然而对这个时期调节血管内皮细胞特化的分子机制仍然了解很少。
蛋白精氨酸甲基化是一种普遍的翻译后修饰,影响包括基因表达、RNA 剪接、DNA 损伤和信号转导在内的多种生物学过程[7]。哺乳动物细胞中,蛋白精氨酸甲基转移酶(protein arginine methyltransferases,PRMT)家族负责将甲基基团从S-腺苷甲硫氨酸转移到精氨酸的氮原子上,其中PRMT5 是主要的Ⅱ型精氨酸甲基酶,是已知惟一的负责对称二甲基化的家族成员。PRMT5 可以催化多种底物,在细胞的细胞核、细胞质及细胞膜都能发挥重要功能[8-9]。此前已报道,哺乳动物中的PRMT5 可以与MEP50 结合形成复合体,调节组蛋白的H2A、H4R3 和H3R8 甲基化,维持基因在常染色质中的稳态,导致靶基因转录激活或抑制[10]。此前研究发现,发育过程中Prmt5的表达特征会随之改变,提示其在不同发育阶段具有不同功能。如在原始生殖细胞(PGC)中,PRMT5的表达能在细胞质和细胞核间转移。PGC 和着床前的胚胎经历了表观遗传重编程,PRMT5 在这个过程中从细胞质转移到细胞核(持续到胚胎期8.5 d)[11-12]。脑血管发育过程中,内皮细胞PRMT5表达特征是否会有变化,Prmt5所介导的精氨酸甲基修饰是否发挥作用仍未见报道。
本研究中,我们观察了胚胎期脑血管发育及BBB 建成过程中关键时间点内皮细胞上的PRMT5 表达特征,并初步探索了Prmt5在脑血管内皮细胞中的下游靶分子,以期为PRMT5 在脑血管中的相关研究提供理论依据。
1 材料和方法
1.1 材料
野生型昆明小鼠购于维通利华公司;bEnd3细胞系为实验室保存;羊血清工作液、一抗稀释液、兔二步法试剂盒均购于北京中杉金桥有限公司;ERG(ab92513)、PRMT5(ab109451)、H3R2me2s(ab194684)抗体购于Abcam 公司;IB4(L2140)抗体购于Sigma 公司;流式分选所用抗体CD31(12-0311-81)、7AAD(00-6993-50)均购于eBioscience公司;DMEM 细胞培养基购于Gibco 公司;TRIzol试剂购于 Invitrogen公司;ChIP级蛋白A/G磁珠(26162)购于Thermo 公司。
1.2 小鼠脑组织取材、石蜡包埋及切片
怀孕母鼠断颈处死,腹部开口,取出完整子宫,置于冰PBS 中。体视镜下剖取胚胎脑组织,放入4% PFA 中,4℃固定过夜。将固定好的脑组织依次放入浓度为70%、80%、90%、95%、100%、100%乙醇中停留10~15 min,取出后放入二甲苯中10~20 min,中途更换新的二甲苯,最后于60℃将组织置于融化的石蜡中,浸泡80 min,中途换蜡4 次(胚胎期8.5~10.5 d的胚胎此步骤缩短至30 min),最后将组织置于蜡托并加入新的熔蜡,室温凝固。将蜡块修整成所需大小,放置在石蜡切片机上并调整角度进行切片,将形成的蜡带转移至42℃蒸馏水中,使组织展平,移至载玻片上,37℃干燥过夜。
1.3 免疫荧光
石蜡切片于60℃烘烤30~60 min,脱蜡后系列乙醇复水;将组织切片至于0.1×柠檬酸盐缓冲液中,高压修复4 min;PBS 缓冲液浸泡3 次,每次5 min,3% H2O2溶液室温孵育 15~20 min,PBS 浸泡;山羊封闭液室温封闭30 min,倒去封闭液,滴加经抗体稀释液适当比例稀释后的一抗,4℃过夜,PBS 浸泡3 次,每次5 min,滴加相应属性二抗,37℃孵育1 h,PBS 浸泡3 次,每次5 min,滴加适当比例稀释的TSA 显色液显色,显色时间依抗体而定。荧光显微镜观察显色情况。
1.4 胚胎脑内皮流式分选
提前打开通风橱紫外线照射30 min,器械须提前用70%~75%的乙醇浸泡消毒。母鼠断颈处死后将整个子宫浸泡于冰PBS 中,显微操作取出胚胎脑组织,置于300 μL 无菌PBS,并放在冰盒上,一支离心管中放入1/2 个脑组织,待取材完毕,每支离心管加入300 μL 0.2%胶原酶H,置于冰上,用镊子捣碎,37℃消化15 min,重复捣碎及消化步骤直至组织无明显团块,加入300 μL 无菌 PBS 终止消化,310 rcf 离心 5 min,去上清,加入 1.5 mL 20% BSA,混匀,310 rcf 离心 10 min,去上清,用 100 μL FBS/PBS 重悬细胞,用 100 目细胞筛过滤,并预留一部分细胞不标抗体作为空白对照。根据需要标记相应抗体,4℃ 30 min,加入1 mL 0.1% BSA/PBS 终止,离心去上清,100 μL 1% BSA/PBS 重悬,标 7AAD,移入流式管。BD FACSAriall 流式细胞仪上机分选。
1.5 内皮细胞RNA提取与逆转录
将流式分选获得的内皮细胞离心去上清,加入1 mL TRIzol。冰上放置5 min,加入200 μL三氯甲烷,振荡混匀后室温放置2~3 min,4℃、12 000 r/min 离心15 min,吸取上层水相至另一离心管中,加入500 μL 异丙醇,混匀,室温放置10 min,4℃、12 000 r/min 离心 10 min,弃上清,加入1 mL 75%乙醇,上下翻转离心管使沉淀悬浮,4℃、7500 r/min 离心 5 min,弃上清。室温晾干,加入适量DEPC 水溶解,测量RNA 浓度。按如下反应体系进行反转录:RNA 1 μg,5×RT Mix(Toyobo 公司)4 μL,用 DEPC 水补足20 μL。反应条件:37℃ 15 min,50℃ 5 min,98℃ 5 min。
1.6 实时荧光定量PCR
用反转录得到的cDNA 进行实时荧光定量PCR,体系为cDNA 1 μL、水3.5 μL、引物1 μL、2×Mix 4.5 μL。引物为 PRMT5-s(5'-TTCTTCTC CACAGCATACAG-3')和 PRMT5-a(5'-GAACCAA CCACTCAG-3'),GAPDH-s(5'-TGCCCAGAACAT CATCCT-3')和 GAPDH-a(5'-GGTCCTCAGTGTA GCCCAAG-3')。
1.7 内皮细胞干涉、蛋白提取和Western印迹检测
稀释 5 μL 小干扰 RNA(siRNA)于 200 μL Jet PRIME 缓冲液中,用枪头上下混匀,加入与siRNA 等体积的Jet PRIME,涡旋10 s,快速离心,室温孵育10~15 min,将转染混合物滴加到6 孔板细胞中,轻柔摇匀,孵育48 h。PRMT5 siRNA 靶序列为GCACAGTTTGAGATGCCTT。用细胞刮将6 孔板内的bEnd3 细胞收集到1.5 mL 离心管中,加入60 μL RIPA 裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)。充分超声波破碎后,4℃、12 000 r/min 离心20 min,吸取上清至新的离心管中,BCA 法测量蛋白浓度。蛋白样品加入5×上样缓冲液后煮沸5 min,进行SDS-PACE,湿转法转移至PVDF 膜,5%脱脂奶粉封闭液室温封闭1 h,根据marker 裁取目的条带,敷上一抗,4℃摇床过夜。PBST 洗3 次,每次5 min,室温孵育相应属性二抗 1 h,PBST 清洗 3 次,每次 5 min,显影。
1.8 染色质免疫共沉淀(ChIP)
细胞培养于10 cm 细胞培养皿,培养基用量为10 mL,加入270 μL 甲醛,轻轻混匀,室温放置10 min,加入1 mL 甘氨酸缓冲液,轻轻混匀,室温放置5 min。将培养皿置于冰上,吸净液体,用冰PBS 洗2 次,细胞刮刮下细胞,置于1.5 mL 离心管中。加入200 μL 溶解缓冲液,冰上放置10 min,超声波处理,将 DNA 片段断裂成 200~1000 bp,4℃、15 000 r/min 离心10 min。取上清,置于15 mL 离心管中,加入稀释缓冲液稀释至1/10。加入 10 μL 蛋白 A/G 磁珠,4℃转动 30 min,完成预杂交。用磁力架去除磁珠,取10 μL 作为In⁃put,保存于-80℃,其余加入抗体,4℃孵育过夜。加入25 μL 磁珠,4℃转动4 g,磁力架去除磁珠,用低盐缓冲液、高盐缓冲液、LiCl 缓冲液及TE 缓冲液各洗1 次,每次5 min。所有离心管(包括In⁃put)加入洗脱缓冲液分 2 次补齐到 200 μL,65℃转动各15 min。磁力架去除磁珠,所有离心管加入8 μL 5 mol/L NaCl,65℃水浴过夜。所有离心管加入 1 μL RNaseA,30℃ 30 min,加入 4 μL 0.5 mol/L EDTA,8 μL 1 mol/L Tris-HCl 和1 μL蛋白酶 K,55℃ 30 min。DNA 提纯,测浓度。PCR 扩增,引物序列为 Bmp4-s(5'-TACGGAAGG CCACCCTTTAAACCA-3')和 Bmp4-a(5'-AAATAC CCATGGGAGTCTGGGCTT-3')。
2 结果
2.1 PRMT5在脑血管发育过程中表达位置发生改变
脑膜血管丛自胚胎期8.5~9.5 d 开始从神经管周围向神经管中发生血管形成过程,胚胎期15.5 d 时BBB 初步建成,至出生时进一步发育成熟。为了观察脑血管发育过程中Prmt5在内皮细胞中的表达变化,我们分别取材胚胎期(E)10.5、12.5、14.5、16.5、18.5 d 和出生后 1 d(P1)小鼠脑组织,通过免疫荧光染色观察不同发育时期小鼠脑血管内皮细胞PRMT5的表达。利用酪氨酸信号放大技术(TSA)多色荧光标记PRMT5、ERG(ETS related gene,内皮细胞核标志物)及IB4(isolectin B4,血管内皮标志物)后,我们发现E8.5时,神经管内仍缺乏血管的分布,神经管边缘的血管内皮细胞核和细胞质中均可检测到PRMT5的表达(数据未示)。E10.5 小鼠神经管内出现血管,PRMT5 在血管内皮细胞的细胞核与细胞质中均有表达。从E10.5~E18.5,均可检测到血管内皮细胞的细胞核与细胞质中PRMT5的表达,且不同区域中血管内皮细胞PRMT5 表达未见显著差异。小鼠出生后1 d,血管内皮细胞PRMT5的胞内表达位置发生明显变化,主要表达在细胞核中(图1A)。该结果表明,胚胎期至围产期,脑血管内皮细胞中PRMT5 表达出现了细胞质-细胞核的变化。进一步利用流式分选技术分离E10.5、E12.5、E14.5、E16.5、E18.5 和 P1 小鼠脑中 CD31(platelet endothelial cell adhesion molecule-1)阳性的原代内皮细胞,提取RNA 后实时荧光定量PCR 定量分析Prmt5的表达情况。Prmt5在E18.5时 RNA 表达水平明显升高(P<0.05),而除 E18.5外其他时间点表达量并无明显变化(图1B)。
2.2 内皮细胞系基因敲降Prmt5调节Bmp4表达

图1 小鼠脑血管发育过程中内皮PRMT5的表达变化
Prmt5在脑血管发育过程中持续表达,且表达量和分布随着发育时期不同而变化,暗示其在脑血管发育中发挥着不同的功能。Prmt5在内皮细胞中的功能未见报道,此前研究发现在多种类型细胞中组蛋白H3R2 和H4R3 是Prmt5的经典底物。为了探索Prmt5的功能,我们在脑血管内皮细胞系b.End3 中基因敲降Prmt5,检测脑血管内皮细胞中Prmt5介导的组蛋白甲基化产物H3R2me2s 及H4R3me2s 是否受到影响。Western印迹发现Prmt5基因敲降48 h 后,小鼠脑血管内皮细胞H4R3me2s 及H3R2me2s 表达均明显下降,说明脑内皮细胞中这2 种组蛋白分子精氨酸对称甲基化受Prmt5的调控(图2A)。转化生长因子β(TGF-β)信号通路在脑血管发育成熟中发挥重要作用。此前有研究发现肺发育过程中Prmt5可以通过修饰组蛋白H3R2 精氨酸位点,调节TGF-β信号通路。为了验证脑内皮细胞中TGF-β信号通路是否受Prmt5调节,我们在b.End3 细胞系中基因敲降Prmt5,提取RNA 后通过实时荧光定量PCR 检测TGF-β信号通路中关键配体TGF-β1、Bmp4、Bmp9,胞内信号介导分子Smad4及下游靶分子Id1、Id3和PAI-1的表达,其中Bmp4表达显著上调,相应地其下游靶分子PAI-1的表达也显著升高(P<0.05)(图2B)。为进一步验证与Bmp4启动子结合的H3R2 能否被Prmt5对称二甲基化,我们通过免疫共沉淀实验,利用H3R2me2s 抗体,发现Bmp4的启动子区域转录起始位点上游236~436 bp 区域具有 H3R2me2s 修饰,Prmt5基因敲降后该组蛋白精氨酸甲基化修饰显著减少(图2C)。这些结果表明内皮细胞中H3R2 和H4R3 是Prmt5的作用底物,脑血管内皮细胞中Prmt5可能通过对Bmp4启动子组蛋白H3R2 进行二甲基化修饰,调节Bmp4的表达,从而影响TGF-β信号通路。
3 讨论
本研究首次发现了PRMT5 在脑血管发育及BBB 建成的关键时期存在内皮细胞核与细胞质之间表达位置和表达量的变化;小鼠脑内皮细胞系中PRMT5 可以修饰组蛋白H3R2,Bmp4的启动子区域具有H3R2me2s 修饰,Prmt5在脑血管内皮细胞中抑制Bmp4的表达。
我们首次研究了Prmt5在脑血管发育过程中的表达变化,并发现对血管发育具有重要作用的Bmp4是Prmt5的下游靶分子。近年来一些研究利用新型测序技术和基因修饰小鼠模型,发现随着发育时间推移,脑血管内皮逐步获得特化的分子表达特征,从而获得了独特的血脑屏障特征。如紧密连接分子occludin、claudin 和 ZO-1 在E12 左右在内皮细胞连接处表达,BBB 重要的建成标志分子Mfsd2a 在E15 左右开始表达,一系列配体特异的转运蛋白也在E14.5 左右开始表达。如BBB 特异性外排转运蛋白Pgp 在胚胎发育过程中表达较低,但出生后发育过程中表达增加[3-4]。我们发现在此过程中Prmt5表达也发生着表达量和表达位置的改变,更重要的是Prmt5可以调节TGF-β 信号通路。Bmp4的启动子区域具有H3R2me2s 修饰,Prmt5基因敲降后该组蛋白精氨酸甲基化修饰显著减少。这一作用与在肺分支过程发现的Prmt5通过甲基化与Bmp4启动子结合的H4R3 从而抑制其转录类似[13]。此前人类和小鼠遗传学证据均表明,TGF-β信号通路可以通过调节周细胞黏附等多种方式在BBB 发育成熟过程中发挥关键作用。这些结果暗示蛋白精氨酸甲基化这一表观遗传调节方式可能通过调节TGF-β等在BBB 发育过程中发挥重要作用的信号通路,参与调节BBB的发育和成熟[14]。目前表观遗传调节在血管发育过程中的功能研究仍十分有限,但近年来一些基于遗传修饰小鼠的体内研究也有重要发现,例如抑制DNA 甲基化可以促进小鼠胚胎干细胞(mESC)向内皮细胞分化[15]。小鼠中组蛋白去乙酰化酶(HDAC)敲除后会引起血管扩张和破裂,最终导致小鼠胚胎死于妊娠中期[16]。然而目前关于表观遗传修饰对脑血管发育作用的研究仍很少,精氨酸甲基转移酶在脑血管内皮细胞中的功能也未见报道。Prmt5在BBB 发育和成熟过程中的功能仍须借助遗传修饰动物做进一步体内研究。
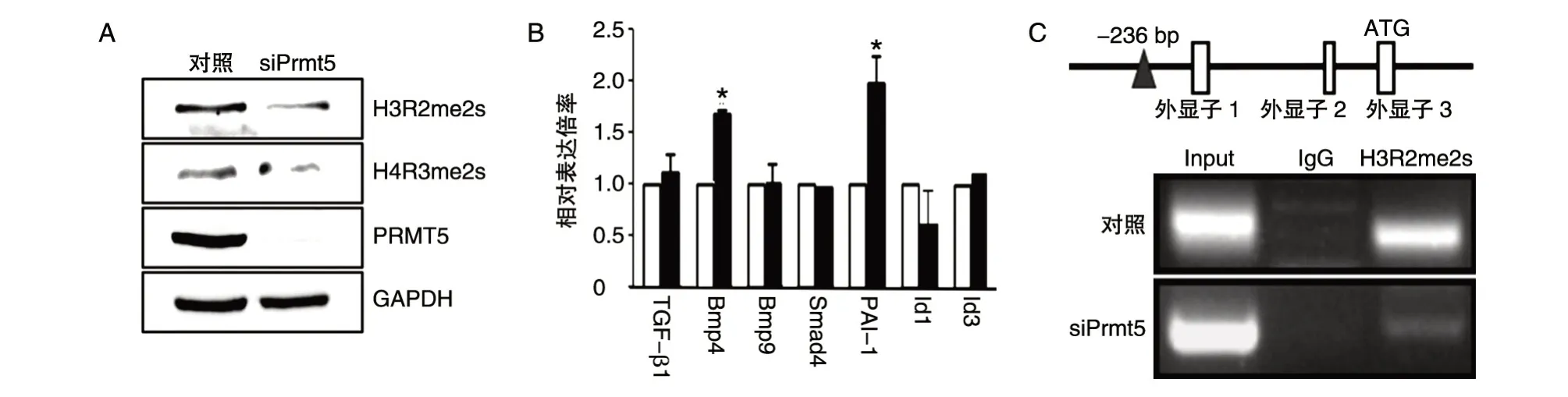
图2 内皮细胞系中Prmt5通过甲基化Bmp4启动子组蛋白H3R2调节Bmp4的表达

