2型猪链球菌葡萄糖胺-6-磷酸脱氨酶基因的克隆表达及酶活性测定
钱思彤,龚秀芳,丁晨曦,胡丹,艾乐乐,诸葛尧尧,王长军
1.徐州医科大学,江苏 徐州 221004;2.解放军东部战区 疾病预防控制中心,江苏 南京 210002
猪链球菌(Streptococcus suis)是一种重要的人兽共患病病原,属于链球菌属,为革兰阳性厌氧菌,该菌感染猪或人可引起脑膜炎、关节炎、肺炎、败血症等病症,甚至急性死亡[1-2]。2 型猪链球菌是猪链球菌35 种血清型中分布最广、致病力最强的分型,是重要的人兽共患病病原[3]。1998年和2005年,我国的江苏苏中、四川资阳地区均暴发了由2 型猪链球菌引起的突发性公共卫生事件,共感染200 余人及10 万余头猪,患者中首次报道出现病死率极高的链球菌中毒性休克综合征(streptococcal toxic shock syndrome,STSS),引发医学界广泛关注。2 型猪链球菌在严重威胁养猪业从业人员健康的同时,也给社会带来了巨大的经济损失[3-4]。
2 型猪链球菌致病机制复杂,涉及毒力因子等介导的细菌黏附、入侵、定植和扩散等各个方面[5-7],其中蛋白酶或其他具有催化功能的酶可通过参与细菌的代谢过程影响其致病性,提高细菌感染宿主的成功率[8-13]。氨基糖代谢在细菌的代谢与增殖过程中发挥重要作用,半乳糖胺/乙酰半乳糖胺(GalN/GalNAc)分解代谢途径是氨基糖代谢的重要组成部分,而葡萄糖胺-6-磷酸脱氨酶(glucosamine-6-phosphate deaminase,NagB)是参与该代谢途径的核心代谢酶,它可以将葡萄糖胺-6-磷酸(glucosamine-6-P,GlcN6p)进一步分解为果糖-6-磷酸(fruetose-6-P,F-6-P)与氨,这是GalNAc 代谢中的最后一个步骤,决定了GalNAc代谢的命运,同时它还可通过影响脂多糖合成和细胞壁氨基糖的回收,影响细菌细胞壁的生成[14]。
本课题组在对2 型猪链球菌中国强毒株05ZYH33 进行全基因组测序和功能注释时,发现ssu05_0195基因与大肠杆菌中葡萄糖胺-6-磷酸脱氨酶编码基因nagB的序列同源性较高,推测其可能编码NagB。在此,我们利用原核表达系统克隆表达目的基因nagB,纯化获得了具有生物活性的重组NagB,建立准确的检测方法分析其酶反应体系活性,为研究NagB 在2 型猪链球菌糖代谢及致病过程中可能发挥的作用奠定了基础。
1 材料与方法
1.1 材料
2 型猪链球菌05ZYH33 菌株由本室保存,分离自2005年四川资阳猪链球菌STSS 患者;表达载体pET32a 购自华大公司;PCR 扩增试剂盒、限制性内切酶BamHⅠ和XhoⅠ、DNA 胶回收试剂盒、质粒提取试剂盒、DNA marker等购自TaKaRa公司;High Affinity Ni-Charged Resin FF Pre⁃packed Column 购自金斯瑞公司;GlcN6p、烟酰胺腺嘌呤二核苷酸磷酸(NADP)、糖磷酸异构酶、葡萄糖-6-磷酸脱氢酶购自Sigma Aldrich 公司;还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)购自南京碧云天公司。
PCR 扩增仪购自Biometra 公司;凝胶成像分析系统购自上海Tanon 公司;TY92-2D 超声波细胞破碎机购自宁波新芝公司;UV2550 型紫外分光光度计购自岛津公司。
1.2 NagB的原核表达
1.2.1 pET32a:nagB质粒的构建及鉴定ssu05_0195(nagB)基因序列单碱基连续重复率极高,以05ZYH33 全基因组为模板进行简单PCR 无法直接扩增出目的序列,故将目的基因序列送华大基因公司进行优化并全合成,获得目的基因片段。
用BamHⅠ/XhoⅠ内切酶分别双酶切构建的pUC57:nagB质粒与pET32a 空载体质粒,1%琼脂糖凝胶电泳分离nagB目的片段和线性化的pET32a 片段,DNA 高效连接酶连接后,重组质粒转化至大肠杆菌BL21 感受态,挑选阳性单克隆,提取质粒。pET32a:nagB质粒经双酶切鉴定正确后,送金唯智公司测序,分析测序结果。
1.2.2 重组NagB的诱导表达与纯化 将重组大肠杆菌BL21/pET32a:nagB接种于LB(含氨苄青霉素)液体培养基中,16℃下IPTG 诱导过夜,离心收集菌体,冰浴条件下超声波破碎。用Ni 离子亲和层析柱纯化上清中的目的蛋白,SDS-PAGE 观察纯化程度。重组菌的上清经第一次纯化后,SDSPAGE 分析表明其中依然含有杂蛋白,将目的蛋白与Ni 离子亲和层析柱进行二次螯合,二次纯化后的蛋白再进行SDS-PAGE,查看结果。
1.2.3 重组NagB的Western 印迹鉴定 重组NagB经 SDS-PAGE 后转至 PVDF 膜上,4℃封闭 2 h,TBST 清洗 3 次,膜与一抗(1∶1000 稀释的 His-Tag单抗)孵育过夜,TBST 再清洗,37℃与二抗(1∶5000 稀释带HRP 标记的羊抗鼠IgG)孵育1 h,TBST 清洗后,加入DAB 显色液显色曝光。
1.3 NagB体外酶活性检测
1.3.1 NagB 酶促反应体系活性测定原理 NagB介导的是GlcN6p的脱氨异构反应,其酶活性定义为25℃下,每分钟消耗 1 μmol 底物生成1 μmol产物的酶量为1 个酶单位。由于该反应的产物和反应物在固定波长下均无特征紫外吸收,直接利用紫外分光光度法无法检测其酶活性。通过查阅文献[15],我们最终确定采用酶偶联法与紫外分光光度法相结合的方法来检测NagB 酶促反应体系的活性。NagB 酶促反应的产物是F-6-P,它可以在糖磷酸异构酶作用下反应生成葡萄糖-6-磷酸,后者在葡萄糖-6-磷酸脱氢酶作用下将NADP还原为NADPH,NADPH 在340 nm 处有特征紫外吸收,通过测量反应体系的D340nm值的变化量便可确定其中生成的NADPH 量,进而确定NagB 酶促反应生成的产物量,测定其反应体系的酶活性。
1.3.2 NagB 酶促反应体系活性测定方法 根据NagB 酶促反应体系活性的测定原理确定其检测方法。在总体积为1 mL的Tris-HCl 缓冲液(50 mmol/L Tris-HCl,pH9.5)中构建反应体系,包括GlcN6p 15 mmol/L、重组NagB 0.15 μg、糖磷酸异构酶4 U、葡萄糖-6-磷酸脱氢酶1.5 U、NADP 0.2 mmol/L。
酶促反应结束后,体系置于沸水中5 min 终止反应,检测反应体系的D340nm值,通过吸光度值的增加量计算反应生成的产物量。按下式计算NagB 酶促反应体系的活性:
酶活性(U/mL)=[(D340nm+b)/a]×2000/40
其中,2000 为将0.5 μL 稀释酶液中的酶活性折算为 1 mL的酶活性,40 为反应时间 40 min,a与b为标准曲线系数。
1.3.3 NADPH-光密度标准曲线测定 NADPH 在340 nm 处有特征紫外吸收,配制不同浓度(浓度分别为0、0.08、0.1、0.12、0.14、0.16、0.18 mmol/L)的NADPH 溶液,定容至1 mL,各取200 μL,测定D340nm值,做NADPH 光密度标准曲线。
1.3.4 NagB 酶促反应体系最适温度确定 为确定反应温度对NagB 酶促反应体系活性的影响,在pH9.5、反应时间40 min 条件下,分别测定温度为16℃、20℃、25℃、30℃、37℃、42℃、50℃、60℃、70℃时的酶反应体系活性,以确定其最适反应温度。
1.3.5 NagB 酶促反应体系最适反应时间确定 为探究NagB 酶促反应体系的最适反应时间,在温度25℃、pH9.5的条件下,分别测定反应时间为10、20、30、40、50、60、90 min 时的 NagB 酶促反应体系活性,以确定其最适反应时间。
1.3.6 NagB 酶促反应体系最适pH 确定 为探究pH 对NagB 酶促反应体系活性的影响,利用盐酸调节反应缓冲液pH 至固定值,在25℃、反应时间40 min 条件下,分别测定 pH 为 3、3.7、6、7、7.5、8、9、9.5、10、10.5 时 NagB 酶促反应体系的活性,以确定其最适pH。
1.3.7 底物浓度对NagB 酶促反应体系活性的影响 底物浓度能影响酶促反应速率,为探索底物浓度对NagB 酶促反应体系活性的影响,在25℃、反应体系pH9.5 条件下,分别测定底物浓度为1、5、8、10、13、15、18、20 mmol/L 时 NagB 酶促反应体系的活性,以确定其最适底物浓度。
1.3.8 NagB 酶促反应体系中动力学参数测定 在25℃、pH9.5 条件下,通过测定不同浓度的GlcN6p底物对应的D340nm值,确定其反应速率。根据双倒数做图法将米氏方程改写,计算NagB 酶促反应体系所对应的米氏常数Km和最大反应速率Vmax。
2 结果
2.1 重组表达载体pET32a:nagB的酶切验证
pET32a:nagB质粒与pET32a 空载质粒经BamHⅠ/XhoⅠ双酶切后进行琼脂糖凝胶电泳,结果如图1。pET32a:nagB重组质粒双酶切后得到2条带,其中1200 bp 左右的为目的基因条带;测序结果也表明该片段与2 型猪链球菌05ZYH33 株的NagB 编码基因ssu05_0195的优化序列一致,证明重组质粒构建成功。
2.2 重组NagB的表达与纯化
2.2.1 重组NagB的诱导表达及鉴定 分别取10 μL 大肠杆菌BL21/pET32a 诱导、未诱导菌液,以及重组大肠杆菌BL21/pET32a:nagB的诱导、未诱导菌液进行SDS-PAGE,结果如图2,可以明显观测到重组菌诱导产生的特异性条带(相对分子质量约为56×103)。
16℃过夜诱导表达的重组菌经超声波破碎离心分离后,上清与沉淀分别进行SDS-PAGE,发现目的蛋白主要表达于上清中,仅有不到10%的目的蛋白以包涵体形式表达,显示目的蛋白主要以可溶性形式存在(图3)。
2.2.2 重组 NagB的纯化 重组 NagB带6×His标签,利用镍离子亲和层析柱对上清表达产物进行2 次纯化(1 次纯化后存在杂蛋白),最终获得的纯化产物经SDS-PAGE 鉴定,显示为单一特异性蛋白条带(图2泳道5)。
2.2.3 重组NagB的Western 印迹 重组NagB的N端带有6×His 标签,利用抗His-Tag 单抗能够有效地鉴定重组蛋白。Western 印迹(图4)显示,NagB泳道在相对分子质量约56×103处有明显的蛋白印迹带,与纯化的NagB 大小相同,证实NagB 获得诱导表达并纯化。
2.3 NagB酶促反应体系活性检测
NADPH-光密度标准曲线如图5。
2.3.1 温度对NagB 促反应体系活性的影响 在pH9.5、反应时间40 min 条件下,当温度低于25℃时,NagB 酶促反应体系活性随温度的升高而升高,25℃时达到峰值,此后逐渐下降,推测NagB 酶促反应体系最适反应温度约为25℃(图6)。

图1 pET32a:nagB重组质粒的酶切鉴定

图2 SDS-PAGE检测蛋白表达和纯化

图3 重组NagB的可溶性表达鉴定
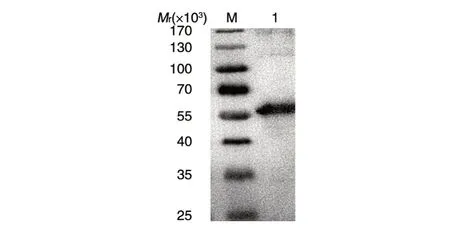
图4 重组NagB的Western印迹

图5 NADPH-光密度标准曲线
2.3.2 反应时间对NagB 酶促反应体系活性的影响 在pH9.5、温度为25℃的条件下,反应时间为10~40 min 时,NagB 酶促反应速度随反应时间的延长而提高,当反应时间为40 min 时反应速度达最大值,酶促反应饱和,推测NagB 酶促反应体系的最适反应时间约为40 min(图7)。
2.3.3 pH 对NagB 酶促反应体系活性的影响 在温度25℃、反应时间40 min 条件下,在碱性条件下NagB 酶促反应体系的活性远高于酸性条件,pH9.5 时显示最大活性(图8)。
2.3.4 底物浓度对NagB 酶促反应体系活性的影响 在pH9.5、温度为25℃的条件下,当底物浓度为 1~15 mmol/L 时,NagB 酶促反应体系的反应速度随底物浓度的增加而提高,底物浓度为15 mmol/L 时NagB 酶促反应达到饱和,考虑相关成本因素,默认底物浓度为15 mmol/L 时NagB 酶促反应体系活性最大(图9)。

图6 反应温度与NagB酶促反应体系活性关系

图7 反应时间与NagB酶促反应体系活性关系
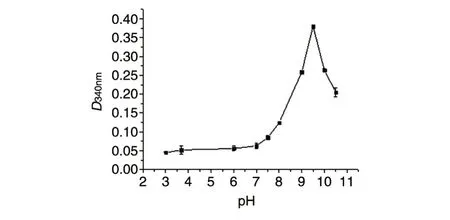
图8 pH与NagB酶促反应体系活性关系
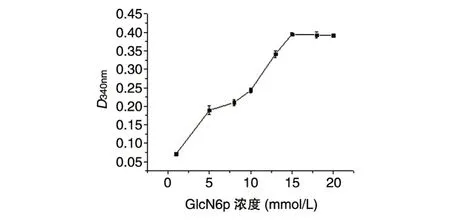
图9 底物GlcN6p浓度与NagB酶促反应体系活性关系
2.3.5 NagB 酶促反应体系的酶活性测定 根据NADPH-光密度标准曲线(图5)与NagB 酶促反应体系的活性计算公式,可得纯化后的2 型猪链球菌NagB 酶促反应体系的体外酶活为3.73 U/mL,通过One-Drop 测定纯化后的重组NagB 含量为0.3 mg/mL,计算可得酶比活为12.43 U/mg。
2.3.6 NagB 酶促反应体系的酶学动力学分析 根据NagB 酶促反应体系活性定义及米氏方程的改写式,NagB 酶促反应体系中酶活动力学参数Km为7.02 mmol/L,Vmax为0.02 mmol/L。
3 讨论
氨基糖代谢在细菌代谢与增殖中发挥重要作用,而GalN/GalNAc 分解代谢途径是氨基糖代谢中的重要组成部分,NagB 则是GalN/GalNAc 分解代谢途径中的核心代谢酶,可使GlcN6p 脱氨异构为F-6-P,产物进入糖代谢途径发挥作用,是脂多糖合成和细胞壁氨基糖回收的重要步骤[16-18]。
本课题组在进行05ZYH33 全基因组注释时发现基因ssu05_0195可能编码NagB。基于此,本研究构建了重组大肠杆菌BL21/pET32a:nagB,诱导表达目的蛋白,并通过2 次纯化获得了纯度较高且具有生物活性的重组NagB。
采用酶偶联与紫外分光光度法相结合的方法检测发现2 型猪链球菌来源的重组NagB 具有酶活性,酶反应体系的最适反应温度为25℃,最佳反应时间为40 min,最适反应pH 为9.5,最佳底物浓度为15 mmol/L。在最适反应条件下,重组表达的NagB 酶反应体系活性为3.73 U/mL,酶比活为12.43 U/mg。此结果较2 型猪链球菌来源的NagA[19]和BgaC[20]的酶活性偏低,推测可能与其复杂的反应体系有关。NagB 酶促反应体系活性受偶联反应中其他酶活性制约,只能通过控制变量的方法筛选出最优反应条件,测得的活性是NagB 酶促反应体系的活性,而不是单纯的NagB酶的活性,故相对较低。不过有研究者以类似方法检测过枯草芽孢杆菌IG20 株NagB 酶促反应体系的活性,结果处在相似水平[9]。
综上,我们克隆表达了2 型猪链球菌中葡萄糖胺-6-磷酸脱胺酶的编码基因,并测定了其重组蛋白的酶反应体系活性,为进一步分析NagB 在2 型猪链球菌糖代谢及后续感染致病过程中的作用奠定了基础。

