烟草黑胫病拮抗菌XA-1的筛选?鉴定及其抑制作用研究
李娜 陈胜 程书锋 祃志明 彭建
摘要[目的]有效预防和控制恩施种植区域烟草黑胫病害。[方法]通过表面消毒分离、平板共培养、分子生物学鉴定、室内盆栽方法筛选、鉴定及评价菌株抑制活性。[结果]从恩施健康烟草植株中分离筛选出一株对烟草黑胫病病原菌有显著拮抗活性的菌株XA-1,该菌株的胞外分泌物对病原菌菌丝有强烈的抑制作用,通过Biolog微生物系統和分子生物学分析,初步鉴定该菌株属于解淀粉芽孢杆菌(Bacillusamyloliauefaciens),经室内盆栽试验评价,拮抗菌XA-1能有效地降低烟草黑胫病的病情指数,在第20天时相对防效最高为52.38%。[结论]菌株XA-1在防治烟草黑胫病方面效果明显,具有潜在的生物防治应用价值。
关键词烟草黑胫病;生物防治;解淀粉芽孢杆菌
中图分类号S435.72文献标识码A
文章编号0517-6611(2019)01-0123-04
doi:10.3969/j.issn.0517-6611.2019.01.038
开放科学(资源服务)标识码(OSID):
由烟草疫霉变种(PhytophoranicotianaBredadeHaan)引起的烟草黑胫病给烟草种植带来毁灭性破坏,病害植株生长缓慢,严重的甚至全株死亡[1-2]。烟草黑胫病作为一种土传病害,到目前为止尚无行之有效的防治措施,烟草黑胫病在种植上采取综合防治措施,包括种植抗病品种、农业防治、病害发生期的药剂防治,以及生物防治和植物诱导抗性的利用等。目前,烟草种植上用来防治烟草黑胫病的化学药剂多为甲霜灵、乙磷铝等杀菌剂,长期重复使用使烟草黑胫病菌产生了一定的抗药性[3],而且会造成一定农药残留。
近年来,烟草及烟草制品逐渐向安全化方向发展,对烟草质量的要求越来越高,因而,发展安全性高的拮抗微生物来防治烟草病害非常迫切。拮抗细菌在植物土传病害防治中起到非常重要的作用,其主要优势:细菌对病原菌的作用方式较广,可以通过竞争、拮抗以及寄生、诱导植物产生抗性等方式对病原菌产生影响;细菌的种类和数量众多,在植物根际和周围土壤大量存在;细菌繁殖速度非常快;许多细菌存在于植物根际和地上部,对植物生态比较适宜;细菌大多可以人工培养,便于控制,在实践中易于操作;有些细菌不仅能防治病害而且可以增加作物产量。国内外研究者已从各种样品中筛选出多种对烟草黑胫病具有良好拮抗效果的生防菌株,为烟草黑胫病的生物防治提供了丰富的种质资源[4-6]。国内外已报道的生防菌主要有芽孢杆菌(Bacillusspp.)、假单孢菌(Pseudomonasspp.)和放线菌。Fravel等[7]报道过一株B.cereussubsp,在烟草幼苗生物测定试验中能抑制黑胫病菌游动孢子对烟草幼苗的侵染。笔者主要针对恩施烟草种植区域的病害防治,从烟草黑胫病发病田块选取健康植株,采用表面消毒杀菌法从其根系中分离和筛选高效拮抗菌株,从中筛选效果最好的一个菌株进行相关生物学鉴定,研究该拮抗菌株的分类地位、生物学特性和抗菌活性物质。同时以微生物有机肥为载体,通过室内盆栽试验考察拮抗菌对烟草黑胫病的控制作用,旨在为开发土壤微生物资源、减少化学农药使用、发展基于有机肥的土传病害生物防治技术提供理论依据。
1材料与方法
1.1材料
烟草疫霉变种(Phytophthoravar.nicotianae);白肋烟B21(感黑胫病品种,湖北省烟草科研所提供);NB液体培养基:蛋白胨10.0g/L,牛肉膏5.0g/L,氯化钠10.0g/L,蒸馏水1000mL,灭菌前pH7.2~7.4。燕麦片30.0g/L,迹量盐1mL(FeSO40.1g,MnCl20.1g,ZnSO40.1g,蒸馏水100mL),琼脂粉18.0g/L,蒸馏水1000mL,灭菌前pH7.2。Waksman培养基:葡萄糖10.0g/L,蛋白胨5.0g/L,氯化钠5.0g/L,牛肉膏3.0g/L,琼脂18.0g/L,pH6.8。盆栽器具(均购自武汉市花卉市场):花卉培养土,富含N、P、K和微量元素,pH5.6~6.0;育苗穴盘和花盆等。
1.2方法
1.2.1拮抗菌株分离与筛选。
分别从恩施咸丰县、盛家坝和下云坝等烟草黑胫病高发田块选择健康烟株取样,样品分为两类收集:①病害严重田块的健康植株;②相邻不发病田块的健康植株。样品编号后放置5℃冰箱保存备用。烟根用自来水冲洗干净后,称取10g置于无菌平皿中,加入75%乙醇浸泡1min后,再转入1%次氯酸钠溶液中浸泡10min,处理后用无菌水漂洗3~5次,表面消毒后的烟根用灭菌解剖剪剪成约0.5mm的片段,将根片段加入到90mL装有玻璃珠的无菌生理盐水中,150r/min振荡30min,取出上清液分别稀释至10-3、10-4、10-5,移取100μL涂布于Waksman平板上。此外再移取最后一次漂洗的无菌水100μL涂布于平板上,作为检验表面消毒是否彻底的参照[8]。所有分离平板在30℃培养箱中培养36~48h,根据不同菌落形态特征挑取单菌落,然后转接至Waksman斜面上保存。
平板共培养初筛[9]:烟草疫霉变种在CA平板上活化后,用0.5mm的打孔器从菌落边缘取下新鲜菌饼,接入Waksman平板中心做指示菌,用接种环挑取分离纯培养物在距离菌饼3cm处接种,每个菌株做3次重复,以仅接种病原真菌菌块而未接种测试菌的作为对照。所有测试菌株放置在30℃培养约7d,对照平板菌落长满后,测量对照病原菌菌落直径(R1)及与拮抗菌对峙的烟草疫霉直径(R2),按照以下公式计算抑菌直径和抑菌率。
抑菌直径=R1-R2,抑菌率=(R1-R2)/R1×100%
复筛:将初筛拮抗效果好的菌株接种至装有30mL液体NB培养基的250mL三角瓶中,在30℃恒温和转速180r/min的回转式摇床中培养72h,培养物在10000r/min条件下常温离心5min,离心后除去沉淀收集上清液,上清液用无菌过滤器(0.22μm孔径的滤膜)过滤除菌备用,在平板中心接种指示菌,并在距离指示菌3cm处打孔添加25μL发酵上清液,每个3次重复,以不添加滤液的CA平板作为对照。然后放置30℃培养箱中约7d后测量菌落直径并计算抑菌率[10]。
1.2.2Biolog微生物系统和16SrDNA分子生物学鉴定。
待测菌株经芽胞染色和革兰氏染色后,确定菌株类型和合适培养基。从菌株保存斜面挑取菌落在BUY培养基平板划线,平板放置28℃培养箱中培养48h。用灭菌棉签挑取已经培养好的菌落,在无菌状态下接种至浊度管中。用空白调至100%,用標准液管调至指定刻度。再用接种后的浊度管进行测量,用无菌水不断调整浊度的大小,达到以上标准浊度值。将制备好的菌悬液倒人加样槽中,使用八道电动移液器,将其接种于微平板的96孔中。微平板在28℃生化培养箱中,在培养第6天和第1天后,将微平板放入读数仪测定反应结果,根据Microlog软件进行结果分析。
提取菌株基因组DNA为模板,以上游引物GACGAGTGGCGGACGGGTG(27F)和下游引物CCATGGTGTGACGGGCGGTGTG(1492R)进行PCR扩增。纯化后的产物测序由北京奥科生物技术有限责任公司的ABI3730XL自动测序仪完成。得到菌株的16SrDNA基因测序结果后,用NCBI的Blast软件进行序列相似性分析,从GenBank数据库和核糖体数据库选取相近种属代表性菌株的16SrDNA基因序列,通过Clustal1.8和MEGA4.0软件进行系统发育分析,用邻接法(Neighborjoining)构建16SrDNA基因序列的系统发育树,用于检验自举支持率(Bootstrap)的重复抽样次数为1000次[11]。
1.2.3室内盆栽试验。
烟草疫霉变种在CA平板上培养7d后加入0.1%KNO3溶液浸泡,在5℃低温冰箱放置30min后加入10mL1%的葡萄糖,收集孢子液后采用血球计数板计数,将孢子浓度调为105CFU/mL备用[12]。取拮抗菌发酵液1L,离心(转速为6000r/min)除去上清液,测定芽孢单位含量(CFU/g),然后按一定比例与麸皮混合均匀,调整菌剂芽孢含量为107CFU/g。白肋烟B21种子经表面消毒后催芽、播种,培养至第10片真叶展开,移至盆钵,盆钵置于温室中,温室条件为温度25℃~30℃、湿度70%~80%、16h/d光照(日光灯,800lx)。温室盆栽试验设置4个处理:①空白对照(不接种);②接种病原菌;③接种拮抗菌XA-1,48h后接种病原菌;④接种拮抗菌XS-2,48h后接种病原菌。每个处理30株烟。以株为单位分级调查,烟草黑胫病病情指数分为5个等级:0级,全株无病;1级,茎部病斑不超过茎围的1/3,或1/3以下叶片凋萎;3级,茎部病斑环绕茎围1/3~1/2,或1/3~1/2叶片轻度凋萎,或下部少数叶片出现病斑;5级,茎部病斑超过茎围的1/2,但未全部环绕茎围,或1/2~2/3叶片凋萎;7级,茎部病斑全部环绕茎围,或2/3以上叶片凋萎。统计发病率和病情指数,计算相对防治效果,病情指数及防治效果计算公式:
发病率=n/N×100%
其中,n为发病株数,N为调查总株数。
病情指数=(i×ni)/(H×N)×100%
其中,ni表示i病情下发病株数,H表示最高病情代表值,N表示调查总株数。
相对防效=(FCK-Ft)/FCK×100%
其中,FCK表示空白组病情指数,Ft表示处理组病情指数。
1.3数据分析采用Minitab10.0软件对试验数据进行分析,采用SPSS18.0软件进行显著差异性(P<0.05)分析。
47卷1期李娜等烟草黑胫病拮抗菌XA-1的筛选·鉴定及其抑制作用研究
2结果与分析
2.1拮抗菌的筛选
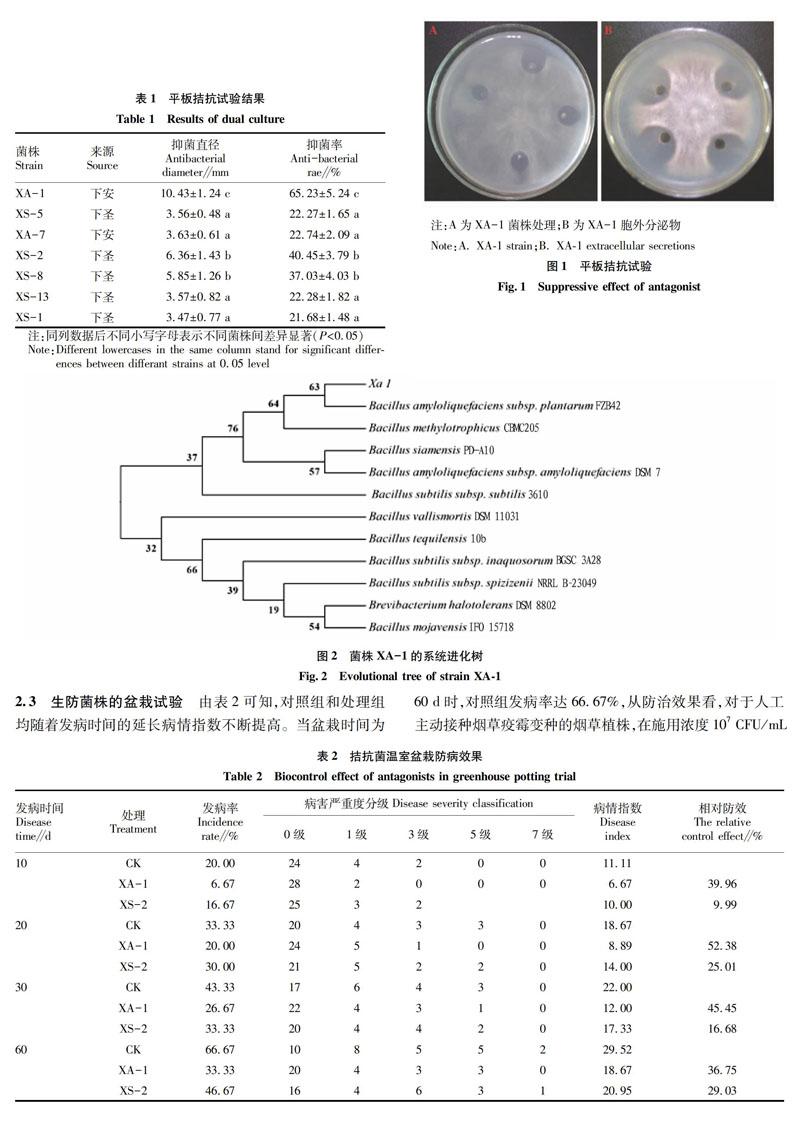
从恩施咸丰县、盛家坝和下云坝采集健康烟株样品20份,采用表面消毒杀菌法从根部共分离73株细菌,通过对峙平板筛选,发现拮抗效果较好的有7株(表1),其中菌株XA-1抑菌效果最佳,对烟草黑胫病菌的抑菌直径大于10mm,抑菌率达65.23%。菌株XA-1胞外代谢粗提液表现出较好的抑制作用(图1),对烟草黑胫病菌的菌丝生长抑制率达82.52%,表明菌株XA-1抑菌物质为胞外代谢分泌物。
2.2菌株XA-1的鉴定
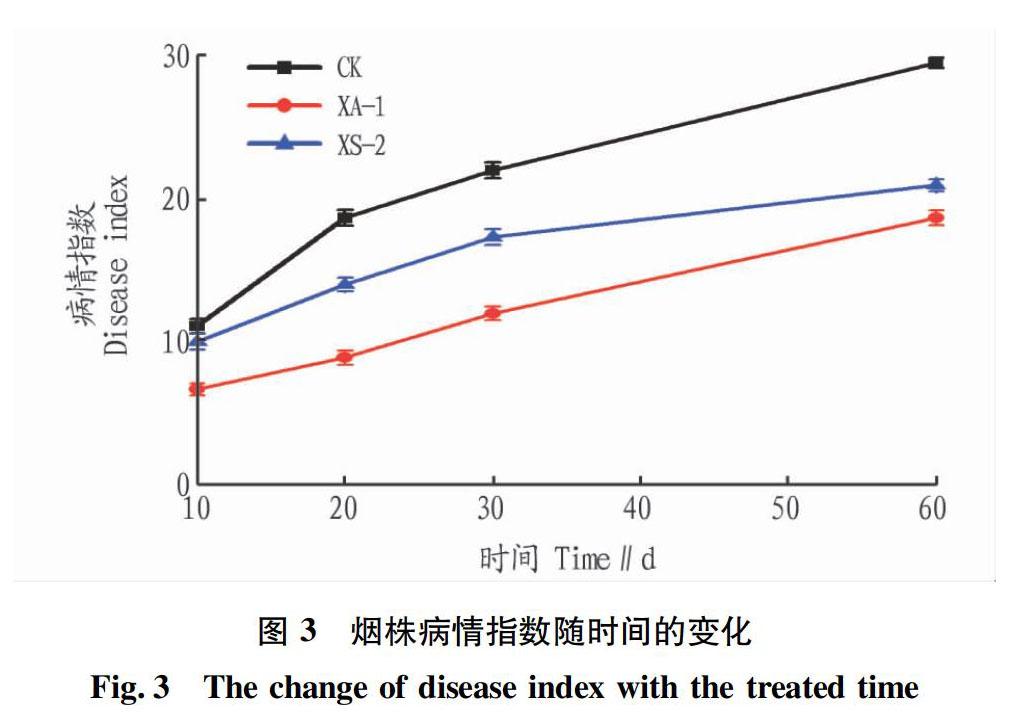
根据96孔板的反应结果,显示10个可能的ID,如果10个SIM值的总和大于0.5时,系统给出的鉴定结果ID是一个属名,菌株XA-1的10个ID值总和为0.595,XA-1属于芽孢杆菌属(图2)。将菌株XA-1的16SrDNA基因序列提交NCBI的GenBank数据库,得到序列号为JX069970,将核酸序列进行同源性比对(Blast)后结果显示,菌株XA-1与Bacillusamyloliquefacienssubsp.plantarumFZB42(CP000560)的相似性达99.73%。选取同源性97%以上相近种属菌株构建系统发育树,结果见图2。由图2可知,菌株XA-1与解淀粉芽孢杆菌属于同一个聚类,初步鉴定为Bacillusamyloliquefacienssubsp。
2.3生防菌株的盆栽试验
由表2可知,对照组和处理组均随着发病时间的延长病情指数不断提高。当盆栽时间为60d时,对照组发病率达66.67%,从防治效果看,对于人工
主动接种烟草疫霉变种的烟草植株,在施用浓度107CFU/mL的拮抗菌后,可以有效地降低烟草黑胫病的病情指数,其中XA-1在第20天时相对防效最高为52.38%。由图3可知,XA-1菌处理组病情指数显著低于CK和XS-2处理组,其中在第20天后,相比对照,XA-1菌处理组病情指数下降,因此拮抗菌XA-1具备生物防治的潜力,可以做进一步的研究。然而拮抗菌相对防治效果的整体趋势下降,一方面可能是烟草B21属于易感品种,病原菌孢子成功侵入植株后,在植株体内存在特定的庇护场所而不会受到拮抗菌的影响[13];另一方面可能是拮抗菌在烟草根部的数量减少,如需进一步验证,需要采用分子生物学技术考察拮抗菌在烟草根系中的定殖能力。
3結论与讨论
该研究从健康烟草根部分离筛选得到1株对烟草黑胫病菌拮抗活性较好的细菌XA-1。菌株XA-1分泌的胞外次生代谢产物对黑胫病菌丝有很强的抑制效果,一方面与发酵液中活性物质能够抑制病原菌正常生长的菌体蛋白的合成有关,另一方面与拮抗菌产生的某些溶菌酶有关[14]。经Biolog微生物和分子生物学分类鉴定,菌株XA-1初步鉴定为解淀粉芽孢杆菌B.amyloliauefaciens。温室盆栽试验结果表明,拮抗菌XA-1可有效地降低烟草黑胫病的病情指数,在第20天时相对防效最高为52.38%,因此拮抗菌XA-1具备生物防治的潜力。
在防治经济作物的土传病害过程中,生防研究为经济作物病害管理系统提供新的手段。农业可持续发展的需要必然会减少化学杀虫剂的施用量,低毒、无害、绿色、环保的生防菌剂将成为化学杀虫剂的替代产品。芽孢杆菌属细菌好氧或兼性厌氧,营腐生生活,生理特征多样化,抗逆性强,繁殖快,营养简单,适生性强。其突出的特征是产生耐热抗逆的内生芽孢,这有利于生防菌剂(Biologicalcontrolagent
BCA)的生产、加工和保存,也有利于菌体在环境中存活与
定殖[15]。Elliott等[16]考察了4种生防菌剂和化学农药在棉花和扁豆应用中的可靠性和稳定性。田间试验效果表明,芽孢杆菌菌剂在不同植物和不同年份比非芽孢杆菌菌剂稳定并能发挥长期的效用,而且可以与化学农药混合使用。
从理论上讲,任何能够降低植物病原微生物数量或致病性的微生物都属于生物防治的微生物资源,从丰富的微生物资源筛选出高效的拮抗菌是生物防治技术成功的关键。该研究从烟草植株中分离筛选的菌株XA-1对烟草黑胫病原菌有较高的拮抗性,具有潜在的应用前景。然而一种生防菌剂从实验室到田间推广是一个极其复杂的过程,该研究仅对XA-1菌株的分离鉴定、拮抗活性及室内盆栽效果进行研究,要最终实现田间推广应用,仍需借助分子生物学相关技术,了解菌株在烟株中的定殖情况和动态变化。
参考文献
[1]陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草科学,1997,18(4):1-7.
[2]罗咏梅,周佳民,朱三荣,等.植物源药剂防治烟草黑胫病的研究进展[J].安徽农业科学,2015,43(27):105-107.
[3]王革,郑小波,陆家云,等.云南省烟草黑胫病菌对甲霜灵抗性的检测[J].南京农业大学学报,1997,20(4):105-107.
[4]杨艺炜,黎妍妍,张安盛,等.烟草黑胫病拮抗菌XF10的筛选与鉴定[J].烟草科技,2018,51(4):20-27.
[5]马国胜,高智谋,陈娟.烟草黑胫病研究进展[J].烟草科技,2001(9):44-48.
[6]马冠华,周常勇,肖崇刚,等.烟草内生细菌Itb57的鉴定及其对烟草黑胫病的防治效果[J].植物保护学报,2010,37(2):148-152.
[7]FRAVELDR,SPURRHW.Biocontroloftobaccobrown-spotdiseasebyBacilluscereussubsp.mycoidesinacontrolledenvironment[J].Phytopathology,1977,67(7):930-932.
[8]SILVANIVA,FRACCHIAS,FERNNDEZL,etal.Asimplemethodtoobtainendophyticmicroorganismsfromfield-collectedroots[J].SoilBioandBiochem,2008,40(5):1259-1263.
[9]CHENC,BAUSKEEM,MUSSONG,etal.BiologicalcontrolofFusariumwiltoncottonbyuseofendophyticbacteria[J].Biologicalcontrol,1995,5(1):83-91.
[10]BERGERF,LIH,WHITED,etal.Effectofpathogeninoculum,antagonistdensity,andplantspeciesonbiologicalcontrolofPhytophthoraandPythiumdamping-offbyBacillussubtilisCot1inhigh-humidityfoggingglasshouse[J].Phytopathology,1996,86(5):428-433.
[11]WANGLT,LEEFL,TAICJ,etal.ComparisonofgyrBgenesequences,16SrRNAgenesequencesandDNADNAhybridizationintheBacillussubtilisgroup[J].IntJSystEvolMicr,2007,57:1846-1850.
[12]方敦煌,吴祖建,邓云龙,等.防治烟草赤星病拮抗根际芽孢杆菌的筛选[J].植物病理学报,2006,36(6):555-561.
[13]JOHNSONKB.Pathogenrefuge:Akeytounderstandingbiologicalcontrol[J].Annualreviewofphytopathology,2010,48:141-160.
[14]RYANRP,GERMAINEK,FRANKSA,etal.Bacterialendophytes:Recentdevelopmentsandapplications[J].FEMSMibiolLett,2008,278(1):1-9.
[15]FRAVELDR.Commercializationandimplementationofbiocontrol[J].AnnuRevPhysiol,2006,43:337-359.
[16]ELLIOTTML,DESJARDINEA,BATSONWEJR,etal.Viabilityandstabilityofbiologicalcontrolagentsoncottonandsnapbeanseeds[J].PestManagSci,2001,57(8):695-706.
(

