性类固醇激素在虾夷扇贝性腺发育周期的分布❋
谢欣冉, 张玲玲,2❋❋, 孙红振, 张 阳, 李婉茹, 张美溦, 包振民,2
(1.中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003;2.海洋渔业科学与食物产出过程功能实验室,青岛海洋科学与技术国家实验室,山东 青岛 266237)
类固醇(Steroids)是一种含有甾核的化合物,是以胆固醇(Cholesterol)为前体经过一系列酶促反应合成而来,一般作为激素在生物性别分化、生殖、发育以及内稳态维持等多种生理过程中发挥重要作用[1]。在脊椎动物中,与生殖调控相关的性类固醇激素主要包括孕酮、睾酮和雌二醇。已有研究显示,这三种激素在软体动物中也存在[2-3],而且软体动物性腺中性类固醇激素含量会随生殖周期发生季节性变化[4-5]。因此,性类固醇激素很可能参与软体动物的生殖调控。
虾夷扇贝(Patinopectenyessoensis)是一种沿日本北部海岸线,朝鲜半岛北部和俄罗斯远东地区自然分布的双壳贝类。由于其具有较高的商业价值,自1982年从日本引进以来,虾夷扇贝已成为中国北方地区最重要的海水养殖贝类之一[6]。由于虾夷扇贝在水产养殖中的重要性,对其性腺发育、繁殖规律的研究起步较早[7-8],已有研究者在虾夷扇贝性腺中检测到了雌激素,以及脊椎动物激素合成通路基因的活性[9-10]。但迄今为止,尚缺乏对虾夷扇贝性腺发育周期中多种性类固醇激素含量的系统研究。本文分析了虾夷扇贝性腺4个发育阶段中3种常见性类固醇激素(孕酮、睾酮和雌二醇)含量及相对比例的变化,为研究性类固醇激素在软体动物生殖、发育过程中的作用提供了参考。
1 材料及方法
1.1 实验材料
实验用二龄虾夷扇贝均取自山东省莱州市海益养殖厂。样品从2015年8月采集至次年7月,每次取样约100只。将采集的虾夷扇贝运回实验室置于过滤海水中暂养24 h,每次挑选40个活力良好的个体(雌雄各20个),将性腺剪为2部分,一部分用4%多聚甲醛固定24 h,后经换液保存于100%甲醇中,用于石蜡切片统计性腺发育时期的周年分布频率;剩余的性腺组织去除消化管后液氮快速冷冻,然后保存于-80 ℃,用于激素测定。
1.2 组织学观察
将多聚甲醛固定后的性腺样品从甲醇中取出,进行常规石蜡切片,并使用苏木精-伊红(HE)进行染色。简要流程如下:使用梯度乙醇脱水(70%、85%、95%乙醇3 min,无水乙醇5 min,2次),二甲苯透明(15 min,2次),石蜡包埋,石蜡切片(切片厚度为5 μm),切片完全展开后贴于载玻片上,在烤片机中烘干(37 ℃,3 h以上);使用二甲苯将切片脱蜡,梯度乙醇复水(100%、90%、85%、70%、50%、30%乙醇各3 min),使用苏木精染液染色5~10 min,自来水冲洗掉多余染液,酸水(0.5% HCl 溶液)分色,自来水冲洗 20~30 min复蓝;然后使用梯度乙醇脱水(30%、50%、70%、85%、95%乙醇各3 min),在伊红染液(1%伊红溶于95%乙醇溶液)中染色10~15 s,95%乙醇洗去多余染液,无水乙醇脱水(5 min, 2次),二甲苯透明,中性树胶封片;使用显微镜观察切片并拍照。
1.3 性类固醇激素水平检测
1.3.1 性类固醇激素的提取 每个性腺发育时期选取6个样品(精巢、卵巢各3个),采用二氯甲烷液液萃取法进行激素提取。取0.1 g性腺组织,用预冷的0.5 mL超纯水匀浆2次,每次2 min;使用超声波细胞破碎仪将组织匀浆破碎(200 w,超声10 s,暂停5 s,共3 min);加入400 μL预热的25 mmol/L的HCl,涡旋2 min并于40 ℃水浴孵育15 min;孵育结束后,加入1.25 mL 0.07 mol/L的Na2HPO4,向匀浆液中加入14 mL二氯甲烷,涡旋2 min后将匀浆液于3 000g离心10 min,使水与有机相分离;使用巴斯德管将下层有机相转移到50 mL离心管中;向残留有上层无机相的离心管中再次加入14 mL二氯甲烷并涡旋2 min,之后3 000g离心10 min,使用巴斯德管将下层有机相转移到50 mL离心管中;使用氮吹仪在室温将有机相中二氯甲烷吹干获得的固态残留物使用500 μL ELISA试剂盒中的EIA buffer溶解。
1.3.2 性腺性类固醇激素水平的测定 使用Cayman公司的酶联免疫吸附测定(ELISA)试剂盒测定卵巢和精巢中孕酮、睾酮和雌二醇的浓度,流程参照Cayman ELISA试剂盒中的说明书。每个样品设2个技术重复,使用Cayman公司提供的ELISA Double表格计算样品中的激素浓度。类固醇含量定义为每克性腺湿重的类固醇量(ng/g)。
1.4 数据统计分析
虾夷扇贝不同时期性腺激素的差异显著性采用单因素方差分析法(one-way ANOVA)分析;同一时期卵巢和精巢中性类固醇激素的差异显著性使用独立样本t检验分析;3种激素含量之间的关系通过Pearson相关分析法获得。显著性水平均设定为P<0.05。以上分析均使用SPSS 21.0软件计算。
2 结果与分析
2.1 性腺发育的周年分布
本研究通过组织学方法分析虾夷扇贝性腺4个主要发育阶段(休止期、增殖期、生长期、成熟期)的周年分布,统计结果见图1。休止期主要分布在7—9月,增殖期分布在10—12月,生长期主要分布在1—2月,成熟期主要分布在1—6月。有些月份性腺发育同步,比如8—9月份的精巢和卵巢均处于休止期,而3—5月份的精巢和卵巢都处于成熟期。相比之下,有些月份的性腺发育同步性差,在10和12月份的样品中尤为突出:这2个月份的精巢均同时出现了休止期、增殖期和生长期,10月份的卵巢也同时出现了上述3个时期,而12月份的卵巢则涵盖了休止期、增殖期、生长期和成熟期4个发育时期。

(A.精巢;B. 卵巢。A . Testis; B. Ovary.)图1 虾夷扇贝性腺发育的周年分布Fig.1 Annual distribution of gonadal developmental stages inPatinopecten yessoensis
2.2 性类固醇激素含量分析
如图2A所示,在虾夷扇贝性腺4个发育阶段,精巢和卵巢中孕酮含量的变化范围分别是(3.86±0.64)~ (6.24±1.51) 和(3.47±0.32 )~ (6.52±1.08) ng/g。无论是精巢还是卵巢,休止期的孕酮含量都高于其它3个时期。比较各发育时期的精巢和卵巢之间的差异,发现孕酮含量在整个发育过程中均无显著差异。
在性腺4个发育时期中,精巢的睾酮含量范围是(0.72±0.21)~ (1.01±0.37) ng/g,卵巢的睾酮含量范围是(0.64±0.10)~ (0.99±0.12) ng/g(见图2B)。虽然睾酮的含量在各发育时期的精巢和卵巢之间并无显著差异,但除休止期以外,精巢中睾酮的含量都高于卵巢。
虾夷扇贝精巢中雌二醇含量范围是(1.90±0.26)~(2.37±0.88)ng/g,卵巢中的含量范围是(2.43±0.59)~ (2.71±0.30) ng/g(见图2C)。尽管精巢和卵巢之间雌二醇的含量差异在性腺各发育时期均不显著,但卵巢中雌二醇的含量始终高于精巢。
统计每个样品中三种激素的总含量,结果如图2D所示。精巢和卵巢中激素总含量的变化范围分别是(6.69±0.94)~ (9.19±2.21)和(6.78±1.00)~ (10.21±0.66) ng/g,精巢和卵巢之间3种激素的总含量在增殖期差异最小,在休止期、生长期和成熟期虽有差异但并不显著。

图2 性类固醇激素在虾夷扇贝性腺4个发育时期的含量所有数据均表示为平均值±标准误 (n=3)Fig. 2 Sex steroids concentrations in the four gonadal developmental stages ofPatinopecten yessoensiseach value is represented as a mean±SEM (n=3)
分析虾夷扇贝精巢和卵巢中3种激素含量的相关性,结果如表1所示。在精巢中,3种激素间均呈显著正相关(P<0.01);而在卵巢中,仅孕酮与睾酮含量呈显著正相关(P<0.01),雌二醇与其它2种激素含量的相关性并不显著。
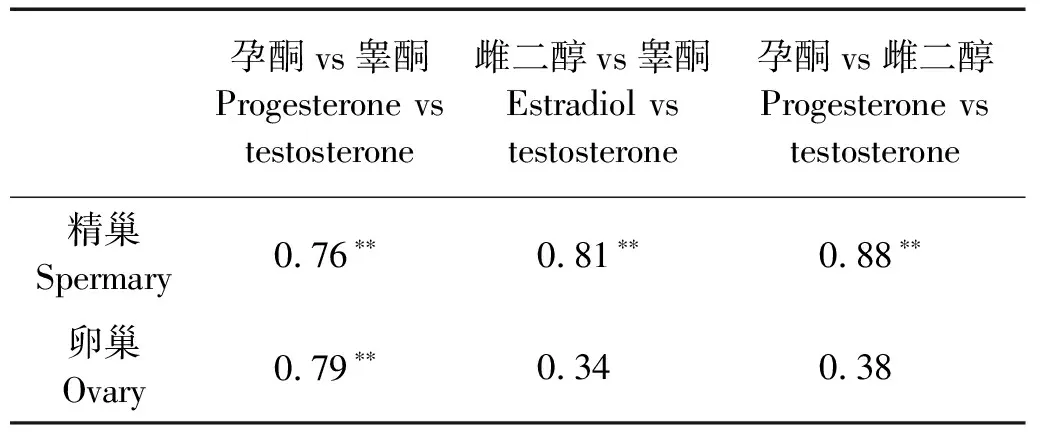
表1 虾夷扇贝精巢和卵巢中三种性类固醇激素之间的相关性Table 1 Correlation between the three sex steroids in the testis and ovary ofPatinopecten yessoensis
注:**表示Pearson相关系数显著性<0.01。
Note:**indicates the significance of Pearson correlation coefficient was<0.01.
2.3 3种激素占比随性腺发育的变化
分析孕酮、睾酮、雌二醇相对于激素总含量的百分比(见图3),结果显示,以上三种激素分别约占激素总含量的60%、10%、30%。除生长期外,精巢中孕酮的比例均略高于卵巢(见图3A)。睾酮比例在生长期精巢和卵巢之间差异显著(P<0.05),精巢高于卵巢,但在休止期、增殖期和成熟期中差异并不明显(见图3B)。虽然在4个性腺发育阶段中,雌二醇的比例在精巢和卵巢之间均不显著,但各时期卵巢中雌二醇所占比例均高于精巢(见图3C)。
2.4 激素相对比值的变化情况
本文进一步探究了精巢和卵巢中3种激素两两比值(睾酮/孕酮、雌二醇/睾酮和雌二醇/孕酮)随性腺发育过程的变化,结果如图4所示。精巢和卵巢中睾酮/孕酮变化范围分别是(0.12±0.02)~(0.24±0.02)和(0.14±0.03)~(0.19±0.01)。虽然精巢和卵巢中睾酮/孕酮在性腺4个发育时期差异都不显著,但可以看出,除休止期外,精巢中睾酮/孕酮都高于卵巢,生长期精巢和卵巢的睾酮/孕酮差异最大(见图4A)。
雌二醇/睾酮在精巢4个发育时期的变化范围是(2.08±0.23)~(3.19±0.41),在卵巢中的变化范围是(2.74±0.03)~(4.31±1.57)。卵巢中雌二醇/睾酮在增殖期、生长期和成熟期都高于精巢,在生长期二者差异显著(P<0.05)(见图4B)。
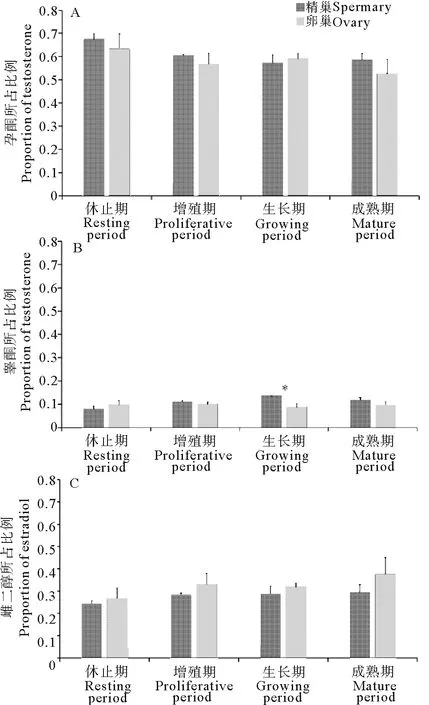

图3 性类固醇激素所占比例在虾夷扇贝性腺4个发育时期的变化
Fig.3 Variations of the percentage of three sex steroids in the four gonadal developmental stages ofPatinopectenyessoensis
雌二醇/孕酮在精巢和卵巢各发育阶段中的变化范围分别是(0.36±0.03)~(0.49±0.09)和(0.42±0.09)~(0.77±0.26)。虽然在性腺发育4个时期中,雌二醇/孕酮在精巢和卵巢之间差异均不显著,但卵巢中雌二醇/孕酮始终高于精巢,成熟期差异最大(见图4C)。
3 讨论
3.1 性腺发育阶段分布频率
本研究分析了山东莱州虾夷扇贝性腺四个主要发育阶段的周年分布:休止期(7—9月)、增殖期(10—12月)、生长期(1—2月)、成熟期(1—6月)。这与李文姬等对大连獐子岛虾夷扇贝性腺周年变化规律的分析结果基本一致[11]。在栉孔扇贝(Chlamysfarreri)中,性腺各发育阶段的分布为:增殖期(1—3月)、生长期(4月)、成熟期(5—9月)、生殖期(5—10月)和休止期(11—12月)[12]。相比栉孔扇贝,虾夷扇贝的性腺发育要早一些,这可能跟虾夷扇贝的最适生长温度低于栉孔扇贝有关。
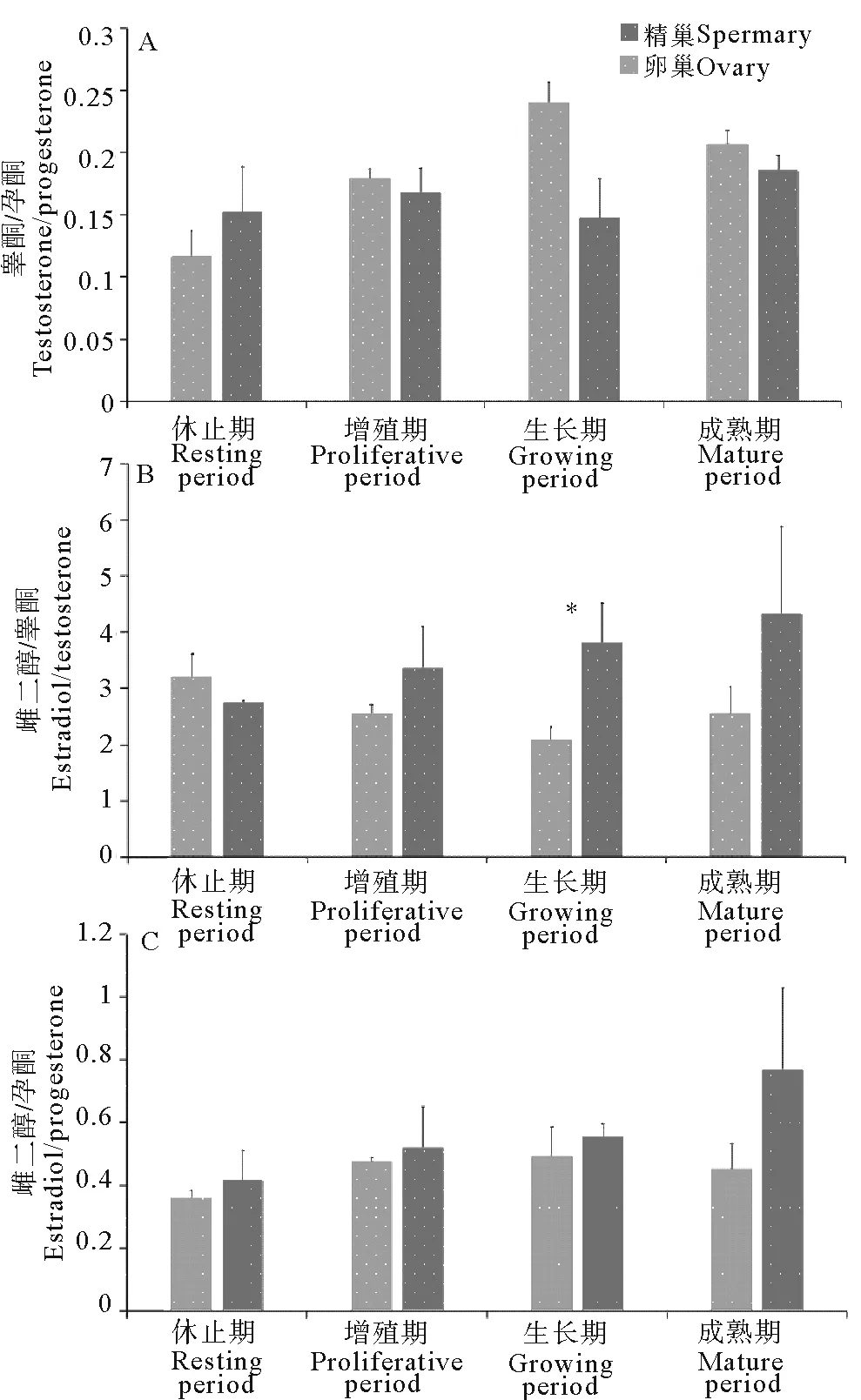

图4 睾酮/孕酮、雌二醇/睾酮和雌二醇/孕酮比值在虾夷扇贝性腺4个发育时期的水平
Fig.4 The levels of testosterone/progesterone, estradiol/testosterone and estradiol / progesterone in the four gonadal developmental stages ofPatinopectenyessoensis
研究发现虾夷扇贝在同一月份出现性腺发育不同步的现象。6—7月的精巢和卵巢都同时出现了休止期和成熟期(6月份精巢/卵巢:50%休止期和50%成熟期;7月份精巢:60%休止期和40%成熟期;7月份卵巢:66.7%休止期和33.3%成熟期);10月份和12月份的精巢同时出现休止期、增殖期和生长期(10月份:9.1%休止期、81.8%增殖期和9.1%生长期;12月份:14.3%休止期、78.6%增殖期和7.1%生长期),10月份的卵巢出现了休止期(5.9%)、增殖期(64.7%)和生长期(29.4%),12月份的卵巢则涵盖了休止期(15.4%)、增殖期(69.2%)、生长期(7.7%)和成熟期(7.7%)。类似现象在栉孔扇贝和青蛤(Cyclinasinensis)中也有报道。比如,2月份的栉孔扇贝性腺同时出现增殖期和生长期,12月份同时出现休止期和增殖期[5];4月份的青蛤性腺同时出现休止期和增殖期,5月份同时出现增殖期和生长期,6月份同时出现生长期和成熟期[13]。可见,相比栉孔扇贝和青蛤,虾夷扇贝的性腺发育同步性较差,同一月份可同时涵盖3种甚至4种发育时期。
3.2 不同贝类性类固醇激素含量的差异
本研究采用ELISA试剂盒检测了虾夷扇贝性腺中孕酮、睾酮、雌二醇三种激素的含量。其中,雌二醇的含量范围(1.90~2.71 ng/g)与之前日本学者用高效液相色谱(HPLC)检测的结果(1.6~4.6 ng/g)接近[9]。分析结果表明,虾夷扇贝性腺中孕酮含量最高,雌二醇其次,睾酮最低。而在蛤仔(Ruditapesdecussatus)的性腺中,孕酮含量也明显高于雌二醇和睾酮[4]。与已知的大多数软体动物相比,虾夷扇贝性腺中孕酮(3.47~6.52 ng/g)、睾酮(0.64~1.02 ng/g)和雌二醇(1.90~2.71 ng/g)的含量较高。比如:在蛤仔性腺中孕酮、睾酮和雌二醇的含量分别为0.18~2.46、0.04~0.38、0.01~0.24 ng/g[4],在栉孔扇贝性腺中雌二醇和睾酮的含量分别为0.08~0.67和0.09~0.51 ng/g[5]。虾夷扇贝性腺中性类固醇激素含量为何较高尚不清楚,有待后续研究。
3.3 贝类性类固醇激素随生殖周期的变化
在虾夷扇贝性腺4个发育阶段,孕酮、睾酮、雌二醇的含量在精巢和卵巢之间均无显著差异。而Osada等在之前的报道中也发现,在虾夷扇贝性腺发育过程中,雌二醇的含量在精巢和卵巢之间并无差异[9]。类似的现象也存在于其它物种,比如,在浅沟蛤(Scrobiculariaplana)中,雌二醇的含量在雌雄性腺之间无显著差异[14],砂海螂(Myaarenaria)两性性腺的睾酮和雌二醇水平差异也不显著[15]。但并非所有的软体动物都呈现一致的变化趋势,比如在缢蛏(Sinonovaculaconstricta)、福建牡蛎(Crassostreaangulata)、栉孔扇贝等物种的性成熟过程中,精巢和卵巢的性类固醇激素水平就存在明显差异,睾酮和雌二醇的含量随着生殖周期发生变化[5,16-17]。
虽然孕酮、睾酮、雌二醇含量在虾夷扇贝的精巢和卵巢之间并无显著差异,但是本研究发现,3种激素含量的相关性在精巢和卵巢中有明显不同,主要体现在雌二醇与其它两种激素含量的相关性上,在精巢中是显著的,但在卵巢中不显著。而且雌二醇/睾酮在生长期的精巢和卵巢之间差异显著,卵巢的雌二醇/睾酮高于精巢。这表明性类固醇激素的性别二态分布在虾夷扇贝生长期是存在的。性腺雌二醇与睾酮的比值变化在栉孔扇贝中也有报道,其卵巢中雌二醇/睾酮全年显著高于精巢,而且生长期是卵巢与精巢差异加剧的拐点[5]。以上结果暗示,虾夷扇贝和栉孔扇贝性腺可能都具有催化睾酮向雌二醇转化的能力,即存在芳香化酶,且该酶的催化活性在生长期的扇贝卵巢中高于精巢。但由于编码芳香化酶的基因Cyp19A1仅在脊索动物才开始出现[18],扇贝中的芳香化酶是否由P450家族的其它基因编码,有待后续研究。

