浅谈化学平衡在生活中的应用
何平
摘 要:现实生活中的很多现象和实际的应用与化学平衡密切相关,化学平衡又是化学中非常重要的概念,了解化学平衡的相关概念对于学习化学知识以及化学与生活生产的联系,用所学知识解决生产生活中的问题有着重要意义。
关键词:化学平衡 生活中 应用
化学平衡是化学中非常重要而又很难的概念,在生活中有很多应用,希望通过了解化学平衡的基本概念,了解各种化学平衡在人们生产生活中的一些应用,能解决生产生活中的实际问题。
一、什么是化学平衡
化学平衡是化学中的一个非常重要的概念。化学平衡是指在一定条件下的可逆反应中,化学反应的正反应速率和逆反应速率相等,反应物和生成物各组分浓度保持不变的状态。根据勒夏特列原理,如一个已达平衡的反应的条件被改变,该反应会随之改变来抗衡这种改变。简单来说,要研究和利用一个化学反应,不仅要知道它进行的方向,還应该知道反应达到平衡时产物有多少。就需要研究化学反应的限度,这个限度的存在就是化学平衡的意义所在。描述反应进行的程度就要用到平衡常数的概念,化学平衡常数只是温度的函数,与反应开始的方向和浓度大小无关。当然,任何化学平衡都是动态平衡。
二、化学平衡在生活中应用
化学平衡作为化学科学中的一条极其重要的规律,在生活和生产中的应用是非常广泛的。
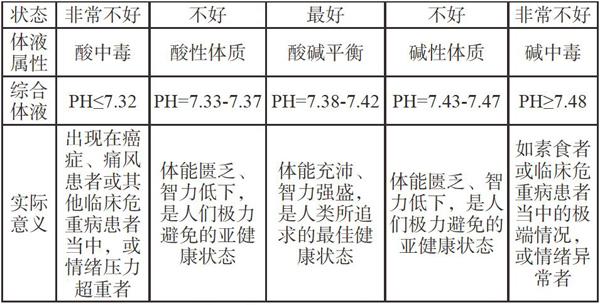
(一)人体血液中的酸碱平衡
人体内血液中的pH值是一个比较稳定的数值范围,正常值是7.4±0.05。这一相对稳定的数值范围保证了人体血液中进行的各种反应。人体新陈代谢所产生的酸(碱)性物质会不断地进入血液中,但血液的pH仍会保持相对稳定,这是因为血液中存在着两对电离平衡,其中一对是碳酸氢根(碱性)和碳酸(酸性)之间的平衡,另一对是HPO42-(碱性)和H2PO42-(酸性)的平衡。下面以HCO3-和H2CO3的电离为例说明血液pH稳定的原因。人体血液中H2CO3和HCO3-物质的量之比为1:20,维持血液的pH为7.4。当酸性物质进入血液时,电离平衡向生成碳酸的方向进行,过多的碳酸由肺部加重呼吸排出二氧化碳,减少的HCO3-由肾脏调节补充,使血液中HCO3-与H2CO3仍维持正常的比值,使pH保持稳定。当有碱性物质进入人体血液,跟H2CO3作用,上述平衡向逆反应方向移动,过多的HCO3-由肾脏吸收,同时肺部呼吸变浅,减少二氧化碳的排出,血液的pH仍保持稳定。如果出现肾功能障碍、肺功能衰退或腹泻、高烧等疾病时,血液中的HCO3-和H2CO3比例失调,就会造成酸中毒或碱中毒。临床指标:血液pH>7.35,为碱中毒;血液pH<7.35,为酸中毒。因此,在生活中要控制肉类和主食的摄入量,应该多吃蔬菜和水果,以利于维持人体内的酸碱平衡。
(二)神奇的酒精测试仪
华灯初上,总能看见交警在各条公路上或者各个路口拦下一辆辆车辆进行检查,要求每位司机对着交警手中的仪器吹气,如果司机喝了酒再去驾车,交警手中的仪器就会报警。实际上,交警手中的酒精测试仪中含有一种橙红色物质——重铬酸钾,一种具有强氧化性的物质。如果司机呼出的气体中含有乙醇的蒸汽,遇到测重铬酸钾,便会发生如下的反应:
Cr2O72-+3C2H5OH+8H+==2Cr3++3CH3CHO+7H2O
仪器中橙红色的Cr2O72-就会转化为绿色的Cr3+,当然,酒精测试仪中还需要加入H2SO4,这就利用了化学平衡原理,一方面是这个反应要在酸性溶液中进行,同时酸性溶液防止了Cr2O72-转化为CrO42-,酒精测定仪的发明和广泛应用为交警办案在技术上提供了大力的支持。
(三)菠菜的正确吃法
菠菜是生活中一种很好的食物,因为菠菜中含有维生素、铁质等营养物质。然而,大量地吃菠菜是错误的。因为过量食用菠菜,会造成人体缺钙。这个道理要从食用菠菜中存在的电离平衡说起。菠菜中含有一种叫草酸的物质,其学名是乙二酸,结构简式为HOOC-COOH,味苦涩,溶于水,是一种二元弱酸:HOOC-COOH——HOOC-COO-+H+、HOOC-COO-——-OOC-COO-+H+草酸进入人体后,在胃酸作用下,电离平衡向左移动。以分子形式存在的草酸,从药理上看,是一种有毒的物质,过量的草酸会腐蚀胃黏膜,对肾脏也会造成伤害。另外,草酸会跟人体内的Ca2+形成草酸钙沉淀,使摄入的钙质不易被利用,造成人体缺钙。那怎样才能吸收菠菜中的营养,又不被草酸伤害呢?一种方法是除去草酸,即在油炒前,先将菠菜用热水烫一烫,草酸溶于水而除去,且这样炒的菠菜没有苦涩味。另一种方法是把草酸转化为沉淀,这就是“菠菜烧豆腐”的方法。每100g菠菜中含300mg草酸,每100g豆腐约含240mg钙,因此,每70g豆腐中的Ca2+,可以结合100g菠菜中的草酸(不含菠菜自身的钙),当大部分草酸跟钙结合,可降低涩味,菜肴更加美味可口。草酸钙进入人体,部分被胃酸溶解后形成的Ca2+仍能被人体吸收,未溶解的部分则排出体外。因此,食物中的Ca2+正好是草酸的解毒剂,豆腐中流失的钙可以被其他食物补充。
(四)自来水消毒
很多城镇的自来水厂在进行消毒时会使用液氯作为消毒剂,为了提高液氯消毒的效果,有些自来水厂还同时加入少量的液氨,这是因为使用液氯消毒时:氯气与水发生如下的化学反应:Cl2+H2O=HCl+HClO。但在这个反应中生成的次氯酸不稳定,见光或者受热时容易发生分解:2HClO=2HCl+O2↑,这样可以缩短消毒时间,但会降低消毒的效果。当向氯水中加入液氨时,可以发生如下反应:NH3+HClO==H2O+NH2Cl,而NH2Cl较HClO稳定。这时,自来水中的次氯酸同时存在于两个平衡体系中,当其在进行消毒杀菌后,次氯酸的浓度会逐渐减小,使平衡向生成次氯酸的方向进行,当次氯酸浓度较高时,平衡又会向生成NH2Cl的方向移动,次氯酸相当于被暂时“贮存”,避免其分解所带来的损失。这样就延长了液氯的消毒时间,提高了消毒的效果。
(五)碱性物质在洗涤油污中的有效利用
在生活中,各种油脂因很难洗去而留下各种油污,因为油脂就是高级脂肪酸的甘油酯,难溶于水,但其水解产物是易溶于水甘油和高级脂肪酸,如果能想办法让油脂水解,那就很容易洗去。油脂水解的方程式是:(RCOO)3C3H5+3H2O==3RCOOH+C3H5(OH)3
这个反应是可逆的,日常生活中的洗涤剂通常用洗衣粉(厨房可用纯碱),其水溶液呈碱性,能与高级脂肪酸作用,使化学平衡向正反应方向移动。高级脂肪酸转化为钠盐,在水中溶解度增大,因此用碱性物质来洗涤油污,更容易洗净。
三、結语
可见,化学平衡存在于生活中的方方面面,有化学平衡的存在,才使生命的存在成为可能。了解化学平衡在生活中的应用对化学平衡的学习和研究是有积极意义的。
参考文献
[1]任传磊.生活中的化学平衡[J].中学生数理化(高二版),2007(9):85—87.
[2]尹静,陈燕,徐墨涵.例说生命活动中的“平衡”[J].生物学教学,2009,34(4):62—64.

