光合作用中光反应的机制和由来(5)
朱钦士
(美国南加州大学医学院)
(上接2019年第5期第10页)
8 叶绿素分子通过还原醌分子建立跨膜质子梯度
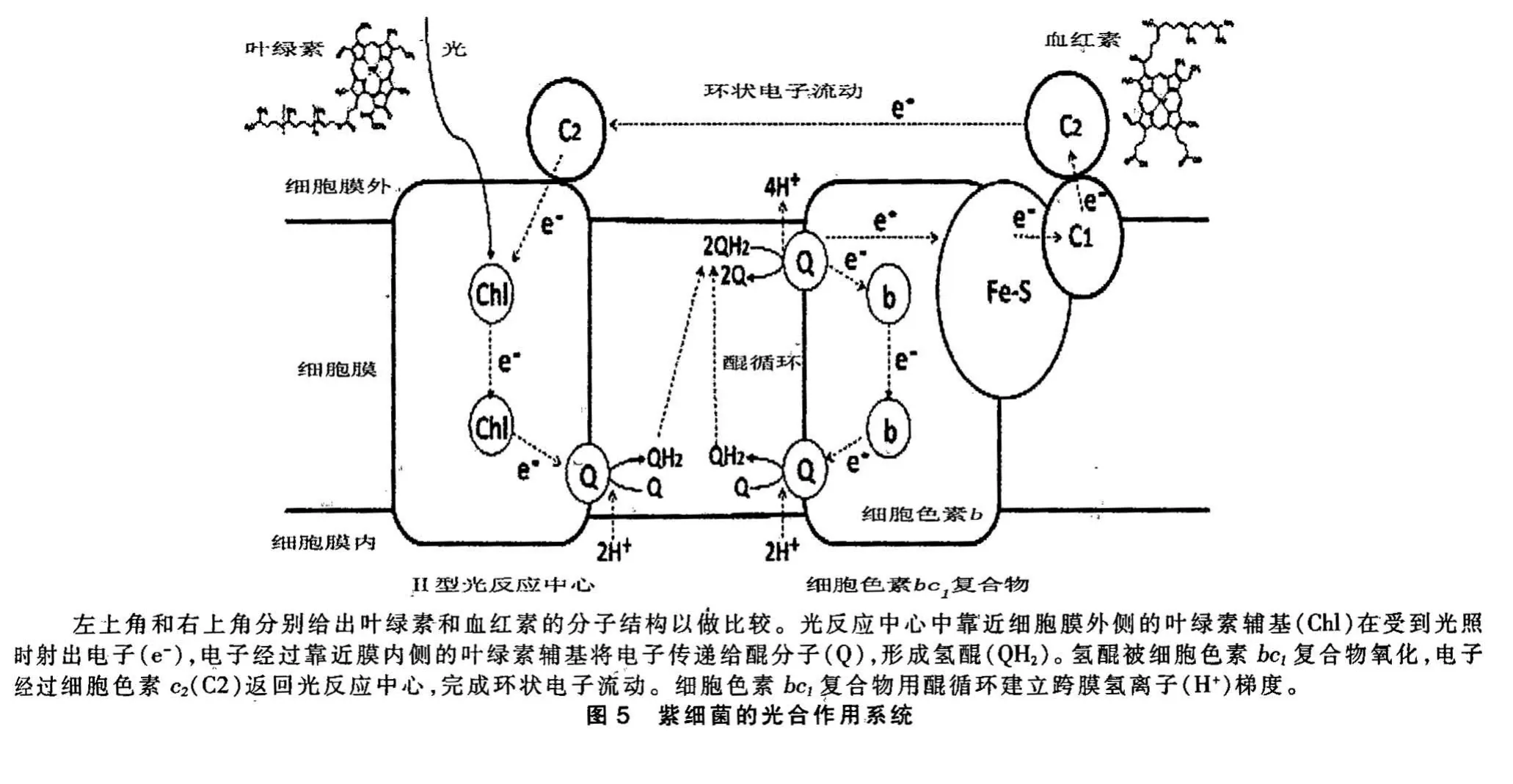
叶绿素(chlorophyll)是生物利用太阳光能量的主要分子,其结构与血红素非常相似(见图5左上和右上),也有一个由卟啉环组成的巨大的共轭系统。但由于卟啉环上所连的化学基团的差异,血红素的中心是1 个铁离子,而叶绿素的中心是1个镁离子,血红素对可见光的吸收主要在550~570 nm,即主要吸收绿光,呈现红色;而叶绿素对可见光的吸收主要在600~700 nm,即主要吸收橙色光和红色光,呈现绿色。
与血红素分子最重要的区别是,叶绿素分子在可见光的激发下还能射出电子,且该电子还可还原醌分子,这样就可以利用氢醌建立跨膜氢离子梯度,这就是基于叶绿素的光合作用的基本原理。由于叶绿素分子的功能与醌分子相联系,效果好于使用视黄醛,所以成为光合作用的主要色素分子,平时说的光合作用,也是基于叶绿素的光合作用。
电子受能量激发,脱离原子或者分子,并非叶绿素分子的专利,而是在非生命世界中广泛地存在。例如金属片在受到紫外光照射时就能射出电子;老式电视机中的阴极射线管,是用加热灯丝的方式射出电子;光电池中的材料在受到光照时也能射出电子;但这些都与生命活动无关。与生命活动有关的电子射出大多是有害的,例如高能射线在生物组织中引起的电子离开分子的情况,称为“电离辐射”,射出的电子常结合在各种分子上,形成有害的“游离基”(free radicals)。叶绿素分子受可见光激发时射出电子,则是生物发明的有益的电子转移过程。
叶绿素分子还原醌分子的反应,是在1 个蛋白复合物称为“光反应中心”(photosynthetic reaction center)的结构中完成的(图5)。反应中心的核心部分是一个由2 个相同或相似的蛋白组成的二聚体,每个蛋白亚基含有2 个与电子传递过程有关的叶绿素分子,分别靠近细胞膜的外侧和内侧,此外,在靠近膜内侧的地方还结合一个醌分子。在图5中,为了简明起见,只绘制光反应中心二聚体中的一个蛋白亚基。靠近细胞膜的外侧的叶绿素分子(Chl)在光照时会射出一个电子,该电子经过靠近细胞膜内侧的叶绿素分子(在这里是去掉镁离子的叶绿素分子,称为“去镁叶绿素”pheophytin),将电子传递给靠近细胞膜内侧的醌分子。这个醌分子是结合在光反应中心的蛋白上的,不能解离,它再将电子传递给另一个亚基上位置与其对应的醌分子。叶绿素分子发射2 次电子,使第2 个醌分子得到2 个电子,再在细胞膜内侧(即细胞质中)获取2 个氢离子,就变为氢醌。这第2 个氢醌分子可以从光反应中心解离进入细胞膜,在那里被细胞色素bc1复合物所氧化,建立跨膜氢离子梯度(见前文及图5右)。
叶绿素分子射出电子后,自己带正电,必须要有电子中和此正电,恢复射电子以前的状态,才能再次射出电子。在紫细菌(Purple bacteria,属变形菌门Proteobacteria)中,该电子是由细胞色素c2提供的。细胞色素c2是一个小蛋白分子,只含有一个血红素辅基。它不是膜蛋白,而是附着在细胞膜的外表面,在细胞膜上滑动并传递电子。它从细胞色素bc1复合物得到电子,再将电子传回光反应中心,实现电子的环状流动。这个环状电子流就可连续不断地还原醌分子,氢醌再被细胞色素bc1复合物氧化,建立跨膜氢离子梯度。由此实现将太阳光的能量转化为生物可利用的能量的过程。
如此巧妙的结构是怎样出现的?要获得这样的光反应中心,需要合成叶绿素这样复杂的分子,还要将2 个叶绿素分子和1 个醌分子结合于蛋白上,且叶绿素分子和醌分子之间的距离和空间方位还必须恰到好处,使得叶绿素分子射出的电子能还原醌分子。这个蛋白还必须是膜蛋白,以便在细胞膜内发挥作用,而不是更常见的可溶性蛋白。
原核生物“凭空”创造出这样复杂的光反应中心,似乎难度过高。但是生物在演化过程中是很少“从头开始”创造新东西的,大多是利用已有的分子和机制加以修改,让其执行新的功能,光反应中心的出现也是如此。
9 光反应中心的叶绿素和核心蛋白可能来自以醌为中心的电子传递链
先说叶绿素。叶绿素分子看上去非常复杂,生物要“从头”制造这样一个分子似乎是非常困难的任务。但实际上,原核生物早就发展了合成叶绿素的关键步骤,即合成血红素的前期步骤。叶绿素的分子结构和血红素非常相似,都是以卟啉环为核心的分子,只是卟啉环上所连的化学基团不同,中心结合的金属离子不同。它们的合成路线在前期阶段也一致,都是以组成蛋白质的氨基酸之一的谷氨酸为原料,经过氨基酮戊二酸(aminolevulinic acid,ALA)这个中间产物合成“初卟啉原”(protoporphyrinogen)。初卟啉原的样子已经非常像血红素和叶绿素了。如果在初卟啉原中插入铁离子,它就会向形成血红素的方向走,但如果在初卟啉原中插入镁离子,它就会向合成叶绿素的方向走。这说明叶绿素和血红素有共同的合成途径,只要将血红素的合成路线在初卟啉原后做一些修改,就可以合成叶绿素。
既然所有的细胞生物都含有细胞色素作为电子传递蛋白,细胞色素分子中血红素辅基出现的时间一定非常早。血红素还分好几类,例如血红素a、b、c、d、o型等,它们在卟啉环上的化学基团也不同,这说明生物修饰卟啉环,给它连上不同的基团并不是一件难事。如果出现一些酶,将初卟啉原变成像叶绿素那样的分子也应该不是特别难。同样,叶绿素分子出现后也分化成好几类,包括a、b、c1、c2、d、f等,它们在卟啉环上的化学基团也彼此不同。这个事实同样说明生物是很有能力修改卟啉环结构的。在血红素合成路线的基础上合成叶绿素,并没有巨大的障碍。
当然只有叶绿素分子还不够,还必须让它以特殊的方式结合到蛋白质分子上,才能使其在光照时射出的电子经由去镁叶绿素还原醌分子,且被还原的醌分子必须靠近细胞膜的内侧。这个要求看似很高,但是类似这样的蛋白也早就由某种氢醌氧化酶基本准备好了。例如氧化氢醌的细胞色素bc1复合物中的细胞色素b,它就有2 个在结构上与叶绿素非常相似的血红素辅基,分别位于接近细胞膜内侧和外侧的位置,且细胞色素b的蛋白上也有醌的结合位点(见图5,比较光反应中心和细胞色素b的结构)。所以在结构上,细胞色素b已经类似光反应中心,但醌结合点的位置不对。在bc1复合物中,醌的反应中心靠近细胞膜的外侧,任务是氧化氢醌,这样氢醌被氧化时释放的氢离子才能进入细胞膜外的溶液中。但是在光反应中心中,醌的反应位点却靠近细胞膜内侧,目的是将醌还原为氢醌,这个问题如何解决?
其实这个问题早就被bc1类型的氢醌氧化酶解决了。氢醌氧化酶是在细胞膜外侧氧化氢醌的,这样释放的氢离子才能进入细胞膜外的溶液中。但是这种机制还不能完全利用氢醌被氧化时释放的能量。为了更有效地利用氢醌氧化时释放的能量,氢醌氧化酶中的细胞色素b在靠近细胞膜内侧的地方也发展出了一个醌结合点,让醌分子也能从这个结合点与血红素辅基反应。但与靠近细胞膜外侧的醌结合点是氧化氢醌的作用不同,在靠近细胞膜内侧的这个醌结合点,醌分子不是被氧化,而是被还原(见图5右)。
在这个修改过的氧化氢醌的机制中,氢醌分子还像以前一样,在细胞膜的外侧被氧化,释放出2个电子和2 个氢离子。在释放出的2 个电子中,一个经由Rieske 铁硫蛋白和细胞色素c1传给位于膜表面的细胞色素c2,另一个电子则传给细胞色素b亚基上的2 个血红素辅基(在图5中标示为b),通过它们将电子传给内侧结合点上的醌分子。2 个氢醌分子在细胞膜外侧被依次氧化时,就会有2 个电子传给位于细胞膜内侧的醌分子,再从细胞膜内侧获得2 个氢离子,在内侧形成一个氢醌分子。这个氢醌分子又可以“游动”到细胞膜的外侧,再次被氧化,形成醌分子的循环,称为“醌循环”(Qcycle)。在这个循环中,2 个氢醌分子在细胞膜的外侧被氧化,释放出4 个氢离子,1 个醌分子在细胞膜内侧被还原为氢醌,从细胞膜内侧拿走2 个氢离子,净结果就是1 个氢醌分子的氧化会在细胞膜外释放出4 个氢离子,在细胞膜内侧拿走2 个氢离子,能量转化的效率就比原先1 个氢醌分子氧化只跨膜转移2 个氢离子的效率提高很多。
醌循环其实是醌在膜的不同侧释放和结合氢离子,但这种机制更好地利用氢醌氧化时释放的能量。出于这个原因,许多其他氧化氢醌的酶也采用这种机制,在它们的细胞色素b上也有2 个醌结合点,用醌循环机制转化能量。在细胞膜内侧还原醌分子的结合点,也因此被这样“创造”出来。
既然来自氢醌的电子经过细胞色素b中的2个血红素辅基又在细胞膜的内侧还原醌分子,如果靠近细胞膜外侧的血红素变成了叶绿素,它射出的电子就会像以前那样通过靠近细胞膜内侧的血红素还原醌分子,只不过电子从原来的来自氢醌分子改为叶绿素分子自己射出,电子传递的路线和原先是一样的。所以只要将细胞色素b中的血红素换成叶绿素,就可实现光驱动的醌分子还原。
血红素和叶绿素都是通过它们中心的金属离子(在血红素是铁离子,在叶绿素是镁离子)与蛋白质分子上组氨酸残基的侧链相互作用的,所以蛋白质分子中结合血红素的组氨酸侧链,也可以在同一位置结合叶绿素。再加上叶绿素和血红素分子的形状高度相似,原来结合血红素的地方,不需要大的改动就可改为结合叶绿素。
当然这不是说,光反应中心的蛋白就一定来自细胞色素bc1复合物中的细胞色素b。如前所述,在各种原核生物中,都有以醌分子为核心枢纽的电子传递链,也有各种氧化氢醌的酶,这些酶中许多都含有细胞色素,且细胞色素的类型不同,但在很多情况下,同一个蛋白亚基上都结合有2 个血红素分子。例如大肠杆菌(Escherichia coli)的氢醌氧化酶含有细胞色素bo3(在同一蛋白亚基上含有细胞色素b和细胞色素o3)、醋酸杆菌(Acetobacter aceti)的氢醌氧化酶含有细胞色素ba3(同一蛋白亚基中含有细胞色素b和细胞色素a3)、嗜酸热硫化叶菌(Sulfolobus acidocaldarius)的氢醌氧化酶含有细胞色素aa3(同一蛋白亚基上含有细胞色素a和细胞色素a3)、脱氮副球菌(Parococcus denitrificans)的氢醌氧化酶含有细胞色素bb3(同一蛋白亚基中含有细胞色素b和细胞色素b3)。在许多细菌的氢醌氧化酶中,特别是在bc1类型的氢醌氧化酶中,还有含2 个细胞色素b的蛋白亚基(即bb型),例如施氏假单胞菌(Pseudomonas stutzeri)和紫细菌(purple bacteria)。从这些例子可以看出,细菌氢醌氧化酶对细胞色素的使用是灵活多变的,但共同点是同一个蛋白亚基上同时含有2 个血红素辅基,而且这样的亚基还有2 个醌结合点,用醌循环的方式直接与氢醌发生反应,即细胞色素中的一个血红素直接从氢醌分子那里得到电子,再通过另一个血红素还原位于细胞膜内侧的醌分子。人们现在看到的,已经是光合作用出现几十亿年以后的氢醌氧化酶的结构,已经无法知道光合作用出现之前这些氢醌氧化酶的情形,但只要有其中一种结合有2 个血红素,且有2 个醌结合点的蛋白亚基能以叶绿素替换血红素,就可转化为原始的光反应中心。换句话说,光合作用的光反应中心很可能是从原核生物的某种醌氧化酶中的细胞色素变化而来的,这些亚基本来就带有在细胞膜内侧还原醌分子的反应位点。
现在所有的光反应中心都是二聚体,即由同样的或是相似的2 个蛋白结合在一起。如果光反应中心是从细胞色素bc1类型的复合物中的细胞色素b变来的,这也很容易得到解释,因为细胞色素b所在的bc1复合物本身就是二聚体,而且是通过位于膜中的细胞色素b形成二聚体的。由此推断,最初形成的光反应中心很可能就是以二聚体的方式出现的。
不仅如此,这个射电子的过程除了可替代还原性分子还原醌分子外,本身也可建立跨膜质子梯度,进一步增加太阳光能量的转化效率。其机制还是醌分子在膜两侧的氧化还原:醌分子的还原是在细胞膜的内侧进行的,醌分子除了要从叶绿素获得电子,还需要从细胞质中获得氢离子,才能形成氢醌分子中的氢原子,所以会消耗细胞质中的氢离子。失去电子的叶绿素分子必须从细胞膜外获得电子,才能恢复射电子以前的状态,可以再次射电子。这些电子可来自细胞色素c2,也可来自其他分子的氢原子。而氢原子在还原失去电子的叶绿素时,还会在细胞膜外释放氢离子。所以光反应中心本身的反应就可以在细胞膜外释放氢离子,在细胞膜内消耗氢离子。
由于以醌为核心枢纽的电子传递链早就为光反应中心的出现准备了各种条件,也出于对可靠能源的需求,光合作用在地球上出现的时间非常早,估计在32 亿年之前。由于在原核生物中,基于叶绿素的光合作用只在某些细菌中存在,在古菌中还没有发现这样的例子,光合作用应该出现在原核生物分化为细菌(bacteria)和古菌(archaea)之后的细菌中。
当然,从细胞色素b类型的蛋白质变成的光反应中心只是一个最简单的原型,现在人们看到的进行光合作用的结构远比这个原型复杂,含有多个蛋白亚基,效率也更高,称为“光系统”(photosystem)。光系统还分化成为两大类:一种是以醌为最终电子受体,用于形成跨膜氢离子梯度,称为光系统Ⅱ(photosystem Ⅱ,简称PSⅡ);另一种是光系统Ⅱ的“衍生物”,以铁氧还蛋白为最终电子受体,为细胞中的有机物合成提供氢原子,叫做光系统Ⅰ,简称PSⅠ。但不管如何变,光合作用的核心反应仍然是叶绿素—叶绿素—醌这条电子传递路线,所有其他电子传递过程和功能都是在这个核心路线的基础上发展的。
10 2 种类型的光合反应中心PSⅡ和PSⅠ
光系统Ⅱ和光系统Ⅰ的排号命名是根据它们被发现的先后顺序:光系统Ⅰ是20世纪50年代发现的,而光系统Ⅱ是20世纪80年代发现的,所以排在后面。但实际上,光系统Ⅱ应该出现得更早,光系统Ⅰ是在光系统Ⅱ的基础上发展出来的(见后文)。在同时有2 个光系统的生物(蓝细菌和植物)中,电子也是从光系统Ⅱ流向光系统Ⅰ,因而位于电子传递链的“上游”,所以光系统Ⅱ应该叫光系统Ⅰ才对,只是这2 个名称叫了这么多年,几乎在所有的有关文献中都如此称呼,也很难再改了。
上文谈及,叶绿素射出的电子以醌为最终电子受体的系统就是光系统Ⅱ。被还原的醌分子被细胞色素bc1复合物氧化,建立跨膜氢离子梯度,电子又经过细胞色素c2回到光系统Ⅱ,完成电子的环状流动。该系统不消耗任何分子,只需太阳光,即可建立跨膜氢离子梯度(图5)。
但此系统也有缺点,只能解决生物的能量来源问题,不能提供生物进行有机合成时所需要的氢原子。异养生物自然可利用现成的有机物中的“零件”,例如葡萄糖、氨基酸、脂肪酸等合成自己的生物大分子,但如果要变为自养生物,即不依靠现成有机物生活的生物,就必须自身从无机物“从头”合成有机物。由于有机物是以碳原子为骨架的,上面再连上氢等其他原子,要自身合成有机物,就必须利用含碳的无机分子,其中最容易使用的就是二氧化碳。但二氧化碳并不含有氢原子,所以氢原子必须从别的分子得到。
你也许要问,光系统Ⅱ不是可以将醌还原成氢醌吗?为什么不用氢醌上的氢原子还原二氧化碳?原因就在于氢醌的氧化还原电位太高,在0V左右,即还原性不够强。细胞还原二氧化碳时使用的分子是NADPH,它在氧化状态下的化学名称为“烟酰胺腺嘌呤二核苷酸磷酸”(nicotinamide adenine dinucleotide phosphate,NADP+),其氧化还原电位为-0.32 V 左右,不是氢醌可以还原的。
要想用叶绿素射出的电子最终能还原NADP+,就要对光系统Ⅱ进行“改造”,使叶绿素射出的电子有更强的还原能力,这就是光系统Ⅱ的变种,光系统I。在这个系统中,蛋白环境的调整使得射电子的叶绿素分子的氧化还原电位降低,从光系统Ⅱ中的+1.1 V 降低到光系统Ⅰ中的+0.5 V,即降低了大约0.6 V。由于起点的电位就比较低,被还原的醌分子的氧化还原电位也降低,从光系统Ⅱ的大约0V降到光系统Ⅰ中的大约-0.5 V,可以还原NADP+了。
光系统Ⅰ核心部分的结构和光系统Ⅱ非常相似,仍然是二聚体,光激发后的电子传递路线也和光系统Ⅱ几乎完全相同:靠近细胞膜表面的叶绿素分子在被光照时也射出一个电子,这个电子首先被另一个叶绿素分子接收(相当于光系统Ⅱ中的去镁叶绿素),再被传递到靠近细胞膜内侧的一个醌分子上。不过在这里,醌分子的结构有些不同。为了使生成的氢醌有更强的还原能力,光系统Ⅰ使用的是氧化还原电位更低的“叶绿醌”(phylloquinone)。它的“头部”不像光系统Ⅱ的醌分子那样只含有一个环(苯环)的结构,而是含有并在一起的2 个环(萘环)。
由于叶绿醌有还原NADP+的能力,光系统Ⅰ的电子传递链就可以向前延伸了。叶绿醌在接收一个电子之后,立即将这个电子传递给一个叫做Fx 的4Fe-4S 铁硫中心,所以叶绿醌没有机会被完全还原成为氢醌,其作用也被“降格”为传递电子的中心之一。Fx 将电子传递到另一个蛋白亚基PsaC 上的2 个4Fe-4S 铁硫蛋白(分别叫做FA和FB)上。由于PsaC 蛋白是一直和PsaA 和PsaB 结合在一起的,所以可以看成是光系统Ⅰ的一部分,铁硫蛋白FB也可以看成是光系统Ⅰ的最终电子受体。
再往下,FB通过FAD(黃素腺嘌呤二核苷酸,见前文)还原NADP+,生成NADPH,这样就可利用太阳光的能量提供有机合成所需要的氢原子了。可以看出,为了用叶绿素射出的电子还原NADP+,光系统Ⅰ使用了比光系统Ⅱ长得多的电子传递链:
叶绿素-叶绿素-叶绿醌-Fx-FA-FB-FADNADP+。
而光系统Ⅱ的电子传递链只到醌分子为止。
虽然光系统Ⅰ可利用太阳光的能量,产生能最终还原NADP+的电子,但这些电子的最初来源仍然是一个问题。叶绿素射出电子之后,必须要有电子补充,才能恢复射电子之前的状态,才能再次射出电子。在紫细菌的光系统Ⅱ中,这些电子是从细胞色素c2获得的。由于这是环状电子流动的一部分,没有分子的输入和输出,所以光系统Ⅱ没有电子来源的问题。而在光系统Ⅰ中,电子是要通过NADPH 输出的,也就是要不断被消耗的。这时环状电子流动就不能胜任这个任务了,而是必须有持续不断的电子供给。在绿色硫细菌中,这是通过一种细胞色素c(例如细胞色素c555)供给的,但是细胞色素c是从电子传递链得到电子的,电子传递链又从硫化氢通过硫化氢-醌氧化还原酶得到的,所以电子的最终来源仍然是外来还原性分子,光系统Ⅰ不过是将这些电子的还原性增强,使它能还原NADP+而已。
同样,在只有光系统Ⅱ的细菌中,光系统只能解决用光能建立跨膜氢离子梯度的问题,有机合成所需要的氢原子仍然必须来自外来分子。即无论是单独的光系统Ⅱ还是单独的光系统Ⅰ,都不能解决氢原子的来源问题,而必须从外部的还原性分子得到。这个问题由于光系统Ⅱ的一个重大发展而解决了,这就是利用水作为氢原子的供体。
(待续)

