静电纺动物蛋白纳米纤维研究进展
吕婷婷, 安 瑛, 李好义, 刘宇健, 焦志伟
(北京化工大学 机电工程学院, 北京 100029)
天然动物蛋白纤维中主要的蛋白质来源包括动物毛、蚕丝、鸡蛋等[1],是最早加以利用的纤维,现在已经是纺织业的原料之一。蛋白纤维虽然性能优异,但每年的产量非常有限,蛋白质资源的再生利用已经成为研究热门[2]。动物蛋白分子链通过氢键与共价键连接在一起,高度有序的结构使得动物蛋白表现出较高的力学强度[3]。此外蛋白质具有优异的生物可降解性、高渗透性以及良好的生物相容性等优势[4]。
静电纺动物蛋白纳米纤维是从天然动物中提炼出来的蛋白质溶液[5],经溶液静电纺丝制成的超细纤维。与其他纳米纤维制造技术(如自组装、模板合成、相分离)相比具有下列优势:1)设备简单;2)可制备连续纳米纤维,可控制纤维尺寸、表面、取向以及孔隙率等;3)制备出来的纤维膜具有相对较高的比表面积与体积比;4)在静电纺丝过程中可同时进行纤维的功能改性等[6]。通过静电纺丝制备的动物蛋白纳米纤维具有比孔隙率高、表面积大、生物相容性高等优点,在生物及基因工程、高效过滤、电池组件等领域有非常广阔的应用前景。利用静电纺丝技术制备蛋白纳米纤维已成为国内外研究者关注的热点问题。
本文对国内外近期静电纺动物蛋白纤维的研究进展进行了综述,总结了4种静电纺动物蛋白的溶剂选择方式及其优劣;讨论了静电纺动物蛋白纤维的改性方法和应用领域,以期对未来动物蛋白纳米纤维的发展提供一定指导。
1 静电纺丝制备动物蛋白纳米纤维
静电纺丝技术是在高压静电场力的牵引作用下,拉伸聚合物形成射流制备纳米级纤维的方法,一般制备的纤维直径在几十纳米到几微米之间。静电纺丝装置主要由高压静电发生器、供料装置、喷射装置、接收装置组成[7],其装置示意图[8]如图1所示。
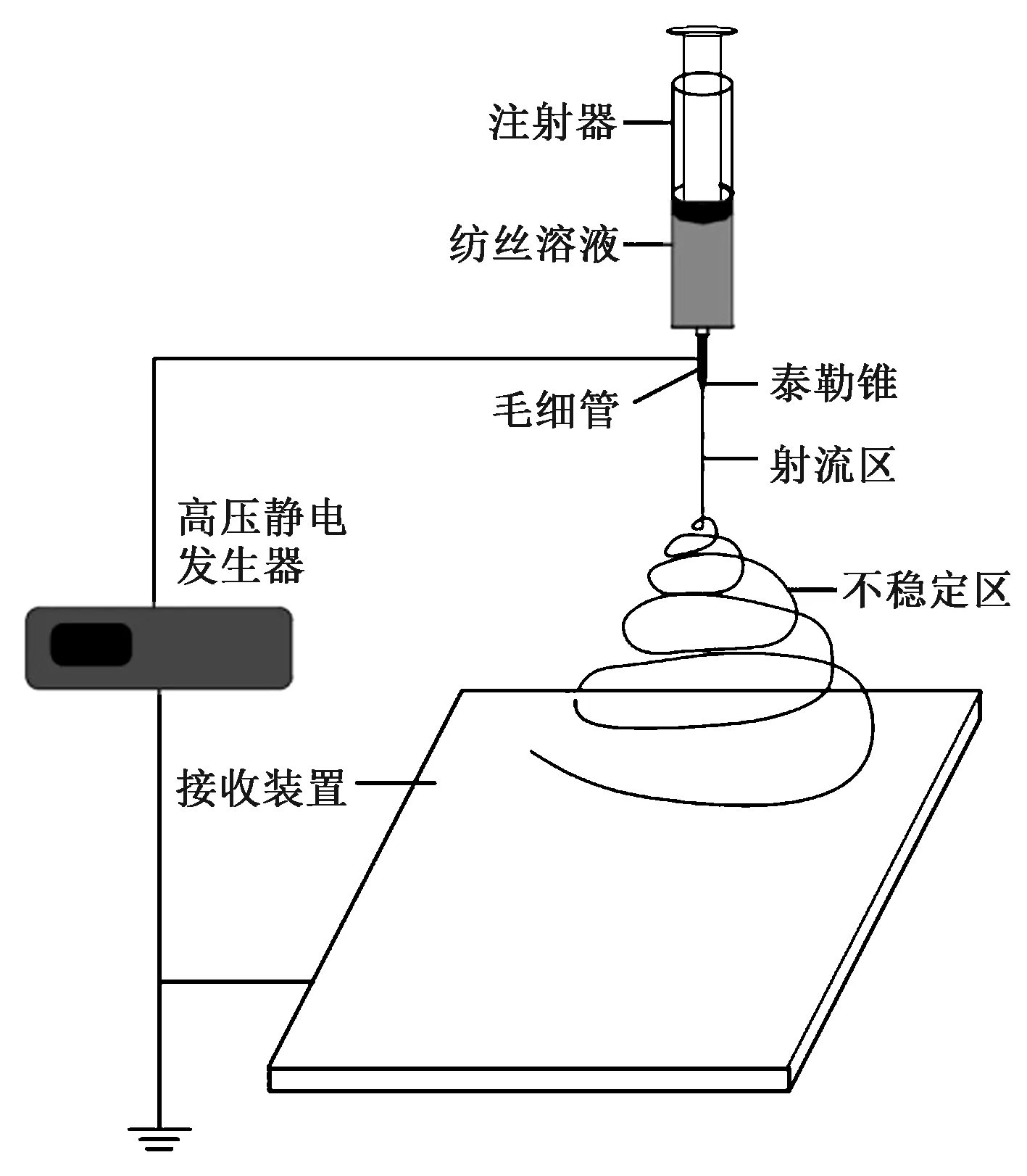
图1 静电纺丝装置示意图Fig.1 Schematic diagram of electrospinning device
动物蛋白质的来源非常广泛,且具有优异的生物相容性,可应用于生物医药领域。通过静电纺丝法制备蛋白纳米纤维膜具有操作简单、纤维直径小、膜比表面积高等优点。但由于进行静电纺的蛋白质溶液的分子量较小,单一的动物蛋白质作为静电纺原料得到的纳米纤维膜力学性能不够优良;另外在静电纺丝过程中会使用大量的有机溶剂,易引起蛋白质的变性,且一般具有毒性。这些缺点极大地限制了蛋白纳米纤维膜的应用领域。
1.1 动物蛋白静电纺丝中溶剂的选择
在溶液静电纺丝过程中,首先要求溶质可在溶剂中溶解;其次,由于溶质需在溶剂挥发后固化成纤,要求所使用的溶剂具有良好的挥发性、低蒸汽压力、合适的沸点等[9]。溶剂种类对纺丝过程有着重要的影响,目前使用较多的有乙醇、氯仿、二氯甲烷等[10]。一般有机溶剂具有毒性,残留的有机溶剂对蛋白纤维膜在生物工程领域的应用有一定负面影响,因此,在蛋白静电纺丝过程中,选取合适的溶剂具有重要的意义。
1.1.1 无毒环境友好型溶剂
胶原蛋白在生物相容性、生物活性、生物可降解性方面表现非常好[11],其生物活性是建立在内部三螺旋结构的基础上[12]。近年来,胶原蛋白静电纺纤维在生物医药领域应用越来越多。在胶原蛋白纤维的制备过程中,通常选取六氟异丙醇(HFIP)作为溶剂[13]。HFIP可溶解大部分聚合物,是一种理想的有机溶剂[14],但HFIP与蛋白质相结合会引起蛋白质的变性[15],且HFIP具有强烈的毒性,会对人体造成伤害。为解决这些问题,Chakrapani等[16]采用无毒性对环境友好的醋酸为溶剂,对胶原蛋白进行静电纺丝,制备出直径为100~200 nm、最佳孔隙率为60%的纳米纤维;Ting等[17]对天然胶原蛋白与以醋酸为溶剂纺制的胶原蛋白纤维进行了光谱测试认为,虽然醋酸无毒性,对环境友好,但醋酸/胶原蛋白溶液体系会造成胶原蛋白中70%的三螺旋结构破坏,极大地影响了蛋白质的生物活性。
1.1.2 离子液
为解决蛋白质活性被破坏的问题,一些研究者尝试使用离子液代替有机溶剂。离子液具有良好的溶解性[18]。Hu等[19]采用离子液体1-乙基-3甲基咪唑乙酸盐([EMIM][Ac])作为溶剂,建立了一种新的蛋白溶液体系。在此溶液体系中,引入了一系列钠盐,使蛋白的溶解度有了显著提高,在45 ℃温度下,体系中蛋白的溶解度可达到11%,且在35 ℃温度下,胶原蛋白95%的三螺旋结构没有被破坏。使用离子液代替有机溶剂虽然可以保护蛋白质的活性,但离子液价格昂贵,生产成本较高。
1.1.3 同轴静电纺隔离有机溶剂
一些研究人员尝试使用核-壳溶液同轴静电纺丝的方法以保护蛋白质不受有机溶剂的影响。同轴静电纺丝技术是将核溶液与壳溶液分别装在不同的注射器中,处于高压电场的牵引拉伸作用下,外层液体流出后与内层液体结合,由于内外层液体结合时间较短,在溶液固化之前,内外层液体不会混合在一起[20],其示意图[21]如图2所示。Sandeep等[22]将蛋白质水溶液作为核溶液,三氯甲烷和二甲基甲酰胺溶液(体积比为4∶1)作为壳溶液,进行同轴静电纺丝,并与将蛋白质直接溶解到三氯甲烷与二甲基甲酰胺溶液中进行静电纺丝相对比。实验结果表明,同轴静电纺丝所得纤维中蛋白活性保留为82%,直接将蛋白质溶解在有机溶剂中所制得的纤维的蛋白活性保留为36%。蛋白可通过同轴静电纺丝的方法进行纺丝,且可保护其免受有机溶剂的不利影响。
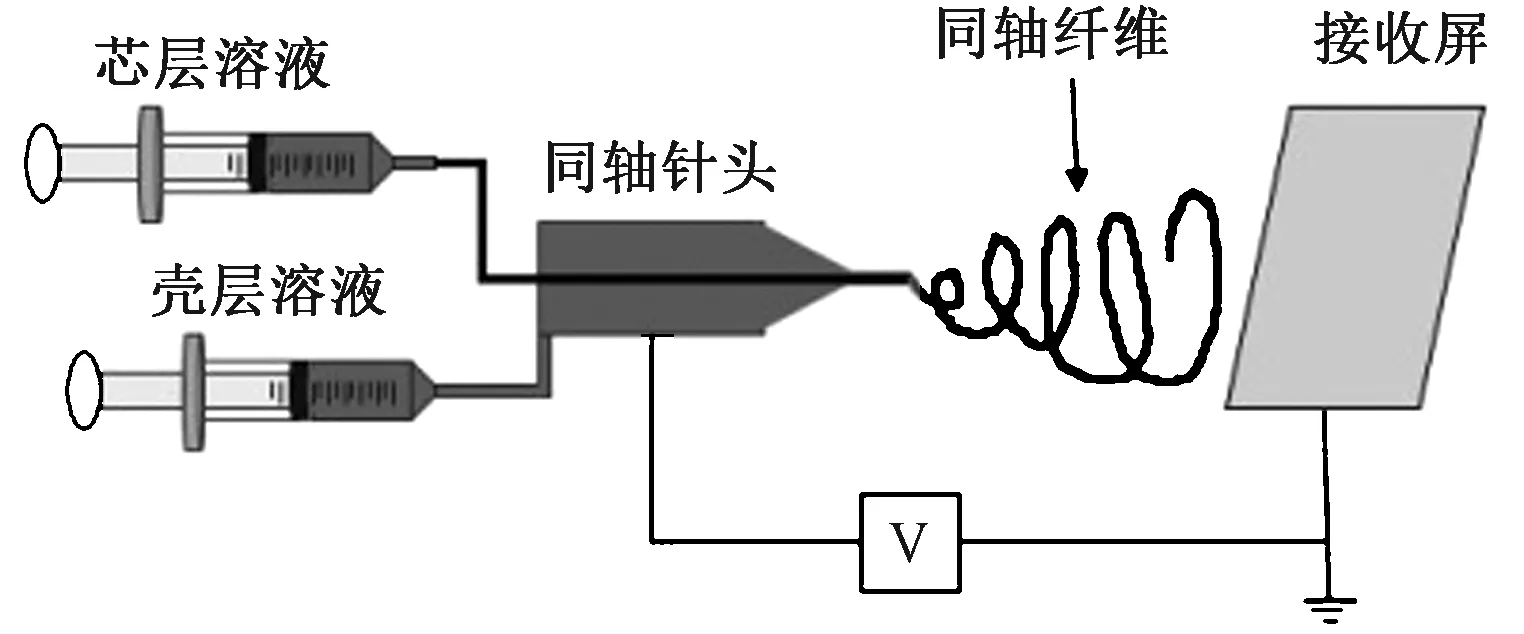
图2 同轴静电纺丝装置示意图Fig.2 Schematic diagram of coaxial electrospinning
1.1.4 水溶性聚合物
近年来,一些水溶性聚合物,例如聚氧化乙烯(PEO)、聚乙烯醇、聚乙烯吡咯烷酮等,以水为溶剂来溶解聚合物。Xi等[23]将可溶性蛋壳膜(SEP) 蛋白与PEO混合进行静电纺丝,由于单独的SEP溶液分子量低,溶液黏度低,难以进行静电纺丝,PEO与SEP混合可提高溶液黏度。Feng等[24]成功制备了SEP/PEO纤维,纤维直径在0.3~20 μm 之间,且纺丝溶液中未使用有毒溶剂。以水溶性聚合物代替有机溶剂进行蛋白静电纺丝,有效阻止了蛋白的变性,无有毒溶剂残留,更加有利于蛋白纳米纤维在生物医药等领域的应用。表1示出几种溶剂选择方法的优缺点。

表1 静电纺丝溶剂选择的优劣对比Tab.1 Comparison of solvent selection in electrospinning
1.2 静电纺动物蛋白交联改性
通过静电纺丝制备纯蛋白纤维,由于蛋白质的溶解度不足,会对材料的可纺性造成很大影响,并且制得的纳米纤维膜力学强度较差。交联是聚合物改性的常用方法,交联改性可显著改善聚合物的力学性能[25],因此,一些研究者对蛋白交联改性后进行静电纺丝,期望提高蛋白纤维的力学性能。
Choi等[26]将质量分数为10%的乙二醛溶液作为交联剂加入到毛发角蛋白/聚乙烯醇(PVA)的共混溶液中,成功制备了蛋白纳米纤维膜,并对交联改性前后纤维膜的力学性能进行对比。结果表明:未经交联改性的纤维膜拉伸强度为10.7 MPa,交联改性处理的纤维膜拉伸强度为19.0 MPa。可以看出,交联改性后制备的蛋白纳米纤维膜的力学性能显著提高。
1.3 静电纺动物蛋白共混改性
单一蛋白质组分溶液静电纺丝制备纳米纤维膜时,由于蛋白溶液相对分子质量较小,其可纺性较低且制备的纤维膜的力学性能较差。将蛋白质与高分子聚合物共混后进行静电纺丝,可显著改善纳米纤维膜的力学性能[27]。Lin等[28]将胶原蛋白与聚乙烯醇(PVA)共混后通过静电纺丝制备纳米纤维膜,研究结果表明,PVA的加入显著提高了纳米纤维的弹性模量、断裂应变、极限拉伸强度。李帅[29]对羊毛角蛋白/PVA共混纳米纤维膜的力学性能进行研究,结果表明,羊毛角蛋白与PVA 的质量比为1∶9时的断裂强度约为4∶6时的7倍,随着PVA含量的增加,共混纤维膜的力学性能随之增加。
2 在生物医疗领域中的应用
2.1 胶原蛋白纳米纤维的应用
胶原是细胞外基质的主要成分[30],胶原蛋白是哺乳动物体内含量最多的蛋白质[31],其具有良好的生物相容性、可降解性以及无免疫原性[32],在生物工程以及医疗方面展现了重要的潜在价值。胶原蛋白类型较多,常见的包括Ⅰ型、Ⅱ型、Ⅲ型、Ⅴ型和Ⅺ型胶原蛋白,其中Ⅰ型、Ⅱ型、Ⅲ型主要见于动物。用于生物医药领域研究的动物胶原蛋白主要来源[33]如表2所示。

表2 动物胶原蛋白主要来源Tab.2 Major sources of animal collagen
胶原蛋白纳米纤维在生物医药领域的应用主要包括伤口愈合[34-36]、组织工程[37-38]、神经再生[39]、药物传递[40]等方面。
2.1.1 促进伤口愈合
胶原蛋白本身来自于细胞基质,因此,被认为是有利于帮助伤口愈合的蛋白质[41]。近年来,一些研究者尝试将胶原蛋白纳米纤维应用于伤口愈合,并取得了一些进展。Venugopal等[35]将胶原蛋白与可生物降解的聚己内酯(PCL)共混后,通过静电纺丝制备纳米纤维膜,具有高度多孔性的胶原蛋白/PCL纳米纤维膜适于细胞的附着、生长、增殖,并形成真皮替代物来帮助伤口愈合。蔡旺[36]利用蓝鲨Ⅱ型胶原蛋白与壳聚糖为主要原料,使用低毒性的乙酸水溶剂体系,在溶液质量浓度为0.07 g/mL时成功纺制了复合纳米纤维,应用于伤口敷料,可促使创面愈合。
2.1.2 组织工程
胶原蛋白广泛存在于人体内,胶原是人体组织再生的重要蛋白聚合物[42],因此,胶原蛋白纳米纤维在组织支架制备领域有着广阔的应用前景[43]。Mukherjee等[38]依据生物心室组织结构特点,以(594±56) nm的纳米纤维为模板,制备了聚乳酸、共聚己内酯/胶原蛋白支架材料,并与纯人工合成的聚乳酸、共聚己内酯支架进行对比。结果表明,聚乳酸、共聚己内酯/胶原蛋白支架更有利于心肌细胞的附着和生长,聚乳酸、共聚己内酯/胶原蛋白支架更加接近天然心脏组织。Yu等[39]采用静电纺丝法制备了胶原/PCL纳米纤维,并探究了其在鼠体内作为神经再生引导底物的应用情况。研究结果表明,胶原/PCL纤维由于具有柔韧、亲水的特性,更有利于促进神经细胞的黏附、生长和增殖。
2.1.3 药物传递
研究人员发现胶原蛋白添加量为26.7%的玉米醇溶蛋白(Zein)/鼠尾I型胶原纳米纤维膜,成功模拟了天然细胞外基质,比表面积是Zein平板膜的9~10倍,为细胞提供了更大的生存空间,将复合纤维膜用于药物传递,随着纤维膜的生物降解可达到非常好的药物缓释效果,避免了药物突释的现象[40]。
2.2 丝素蛋白纳米纤维的应用
丝素蛋白是从蚕丝中提取的天然高分子纤维蛋白,凭借其优良的力学性能与生物相容性,在生物医疗领域有着广泛的应用。
2.2.1 丝素蛋白在面膜制品中的应用
丝素蛋白的成分与人的面部肌肤成分相似,丝素蛋白应用于面膜中可有效补充面部肌肤缺失的营养成分。高宁萧等[44]将丝素蛋白、胶原蛋白肽、聚乙烯吡咯烷酮溶解于甲酸溶液中进行静电纺丝,制得了纤维直径均匀、表面光滑、保湿性能良好的复合纤维膜。但该方法中使用了有毒溶剂甲酸,纤维膜中残留的有毒溶剂会对人体造成伤害。
2.2.2 丝素蛋白在组织工程中的应用
为克服有毒溶剂对丝素纤维在生物医药领域应用的影响,一些研究人员尝试以水作为溶剂进行丝素蛋白静电纺丝,这种方法具有价格便宜、无污染等优点,在组织工程领域有着广泛的应用前景。 Rajabi等[45]以水作为溶剂,制备了丝素蛋白/聚氧化乙烯(PEO) 纳米纤维支架,实验结果表明丝素蛋白/聚氧化乙烯支架具有良好的亲水性,且可有效地促进细胞增殖。
3 总结与展望
近年来,静电纺丝制备蛋白纳米纤维取得了一定的进展,然而仍存在一些问题亟待解决。
1)静电纺丝过程中溶剂的选择。研究者已通过一些方法在静电纺丝过程中使蛋白质不受有毒溶剂的影响,但这些方法存在静电纺过程复杂等缺陷,因此,寻找操作简便、绿色友好的方法是进一步研究的重点。
2)静电纺蛋白纳米纤维膜的力学性能。通过与高分子质量聚合物共混等方法可提高蛋白纤维膜的力学性能,但仍不能满足实际应用需要。静电纺丝制备蛋白纳米纤维膜的力学性能是制约其应用的一大问题,探究提高蛋白纳米纤维力学性能的方法对于拓展蛋白纤维的应用领域具有重要的意义。
3)通过静电纺丝制备蛋白纳米纤维膜主要是应用于生物工程领域。蛋白纤维作为组织支架具有明显的优势,但目前仍存在一些挑战,例如支架的生物相容性、力学性能以及尺寸结构等。这些挑战仍需要生物工程研究人员进行突破,另外,蛋白纤维在过滤、传感器件等领域应用的研究还有待加强。

