亮氨酸脱氢酶与甲酸脱氢酶共表达菌株发酵产酶条件优化 及其在L-2-氨基丁酸合成中的应用
徐建妙,陈策,张博,柳志强
(浙江工业大学 生物工程学院,浙江 杭州,310014)
L-2-氨基丁酸(L-2-aminobutyric acid,L-ABA)在化工、医药等领域具有广泛的用途,作为手性医药中间体可用于合成抗癫痫药物左乙拉西坦和抗结核药物盐酸乙胺丁醇[1-2]。目前,L-2-氨基丁酸的生产主要有化学法和生物法两大类。化学法主要有化学拆分法[3-4]和化学合成法[5-6]。但是该种方法所需试剂价格昂贵,成本较高,不宜应用于工业化大规模生产,同时使用到的大量有机溶剂,会增加环境压力。生物法又包括酶催化法和微生物发酵法,酶催化制备方法专一性强,效率高,反应条件温和,是一种较为理想的药物中间体制备方法。目前主要有两种酶催化法制备L-2-氨基丁酸,一种是通过转氨酶[7-13]或者脱氢酶[14-16]催化2-酮丁酸(2-oxobutyric acid, 2-OBA)来制备,但是由于2-酮丁酸价格昂贵,不适合以其作为原料制备L-2-氨基丁酸;另一种是对消旋2-氨基丁酸进行酶法拆分制备[17]。目前常用的方法是先用苏氨酸脱氨酶(threonine deaminase, TD)催化价格相对低廉的底物L-苏氨酸(L-Threonine,L-Thr)转化为中间产物2-酮丁酸,然后在辅酶NADH的参与下利用亮氨酸脱氢酶将其转化为最终产物L-2-氨基丁酸(图1)[18]。

图1 苏氨酸脱氨酶、亮氨酸脱氢酶和甲酸脱氢酶偶联催化合成L-2-氨基丁酸工艺路线Fig.1 Synthesis of L-2-ABA by coupling TD, LeuDH and FDH
然而NADH价格昂贵,因此需要提供一套低成本、高效率的辅酶再生系统。辅酶的再生方法包括酶法、光化学法、电化学法[19],其中酶法再生系统具有选择性高、反应速度快、过程易于监控、再生体系与合成体系兼容性好等优点,因此应用比较广泛[20]。甲酸铵/甲酸脱氢酶NADH再生系统具有诸多优势,如辅底物甲酸铵价格低廉且对酶无抑制作用,反应不可逆,副产物CO2易从体系中扩散出来,不会增加产物提取压力[21]。
本实验室已成功构建了能够共表达亮氨酸脱氢酶和甲酸脱氢酶的基因工程菌E.coli-BL21(DE3) (LeuDH/FDH),构成了基于细胞自身代谢的胞内辅酶NADH循环再生体系,以该工程菌全细胞作为催化剂应用于L-2-氨基丁酸的制备,实现了反应过程中辅酶的零添加。双酶偶联体系催化效率的高低除了取决于两个酶的酶活,更重要的是两个酶的匹配程度。本文主要是通过对共表达菌株发酵产酶条件进行优化,以期共表达的两个酶的活力达到最优的匹配程度,以降低工业化生产L-2-氨基丁酸的成本,并提高生产效率。
1 材料与方法
1.1 材料与试剂
重组大肠杆菌E.coli-BL21(DE3) (LeuDH/FDH) (LeuDH的基因片段来自Thermoactinomycesintermedius,FDH的基因片段来自Fusariumgraminearum):由实验室构建并保藏;甲酸铵、L-苏氨酸:阿拉丁公司;L-2-氨基丁酸标准品:东京化成工业株式会社。其他试剂均为国产分析纯试剂。
1.2 仪器与设备
E2695高效液相色谱仪,美国Waters公司;LYNX-4000冷冻高速离心机,美国Thermo公司;DK-S32电热恒温水浴锅,上海森信实验仪器有限公司;HZQ-X300C恒温振荡器,上海一恒科学仪器有限公司;MS-15SU磁力搅拌器,美国Silentshake公司;BIOTECH-5JG 5 L发酵罐,上海保兴生物设备工程有限公司;MLS-3780高压蒸汽灭菌锅,上海驰通仪器有限公司;AUTOPOL IV全自动旋光仪,美国Rudolph公司;Spectra Max MS多功能酶标仪,美国Molecular Devices公司;907恒态pH电位滴定仪,瑞士Metrohm公司。
1.3 实验方法
1.3.1 培养基与发酵条件
LB培养基(g/L):NaCl 10,酵母粉5,蛋白胨10,蒸馏水溶解;发酵培养基(g/L):NaCl 10,酵母粉12,蛋白胨15,MgSO4·7H2O 0.375,甘油12,K2HPO4·3H2O 2.28,KH2PO41.36,(NH4)2SO45,蒸馏水溶解。以上培养基均在121 ℃灭菌20 min。
种子液培养:将甘油管中保存的菌种按0.1%接种量接入装有50 mL LB液体培养基的摇瓶,在恒温振荡器中以150 r/min,37 ℃培养12 h。
摇瓶培养及诱导:在500 mL规格的摇瓶中装入100 mL LB培养基,按1%的接种量将种子液转接至LB培养基中,在恒温振荡器中以180 r/min,37 ℃培养至OD600达到0.6~0.8,降低温度,并加入诱导剂IPTG,继续培养。发酵结束后8 000 r/min, 4 ℃,10 min 离心收集菌体,4 ℃保存备用。
发酵罐培养及诱导:在5 L发酵罐中装入3 L发酵培养基,并添加3 mL消泡剂,按5%的接种量将种子液转接至发酵培养基中,将pH控制在7.0(用体积分数为50%的磷酸水溶液和氨水水溶液调节),通气量4.8 L/min,37 ℃,450 r/min培养至OD600达到8~10,降低温度,并加入诱导剂乳糖,继续培养。发酵结束后8 000 r/min,4 ℃,10 min离心收集菌体,4 ℃保存备用。
1.3.2 反应条件
反应体系为180 g/L底物L-苏氨酸,95.3 g/L辅底物甲酸铵,10 g/L含有苏氨酸脱氨酶的湿菌体,40 g/L 共表达湿菌体,于去离子水中构成100 mL反应体系,在35 ℃、600 r/min条件下进行酶催化反应,反应过程中定时取样,用浓盐酸终止反应,样品用于液相色谱分析。
1.3.3 分析方法
HPLC检测条件:色谱柱Eclipse XD8-C18(5 μm×4.6 mm×250 mm),流动相:V(乙腈)∶V(0.02 mol/L Na2HPO4缓冲液(pH 7.2))=30∶70,紫外检测波长:360 nm,柱温:30 ℃,流速:1.0 mL/min。样品衍生化条件:取稀释一定倍数后的待测样品100 μL,与100 μL 0.5 mol/L的NaHCO3溶液和50 μL体积分数1%的2,4-二硝基氟苯乙腈溶液混合,60 ℃避光保温1 h,反应结束后冷却至室温,再加入750 μL NaH2PO4/ Na2HPO4缓冲液(0.2 mol/L,pH 7.0)。
菌体密度测定:以OD600表示菌体密度,用紫外分光光度计测定稀释一定倍数后的发酵液在600 nm处的吸光值。
LeuDH酶活测定:NADH在340 nm处有最大吸光值,可通过检测反应过程中NADH在340 nm处吸光值的变化测定LeuDH活力。反应体系包括:50 mmol/L 2-酮丁酸,200 mmol/L磷酸钠缓冲液(pH 8.0),200 mmol/L NH3/ NH4Cl缓冲液(pH 7.5),0.25 mmol/L NADH,10 μL经冰浴超声破碎的酶液,总体积为200 μL,35 ℃下每隔30 s记录NADH吸光值的变化。在测定条件下,每分钟消耗1 μmol NADH所需的酶量定义为1个酶活单位(U)。
FDH酶活测定:原理与LeuDH酶活测定相同。反应体系包括:167 mmol/L甲酸铵,200 mmol/L磷酸钠缓冲液(pH 8.0),1.67 mmol/L NAD+,10 μL经冰浴超声破碎的酶液,总体积为200 μL,35 ℃下每隔30 s记录NADH吸光值的变化。在测定条件下,每分钟生成1 μmol NADH所需的酶量定义为1个酶活单位(U)。
对映体过量值(e.e.)的计算方法,如公式(1):

(1)
式中,R、S分别表示样品中(R)-和(S)-2种构型产物的浓度,mol/L。
时空产率(space time yield,STY)的计算方法,如公式(2):

(2)
式中,c为反应液中产物的摩尔浓度,mol/L;M为L-2-氨 基丁酸的摩尔质量,g/mol;t为反应所用时间,h。
2 结果与分析
2.1 摇瓶水平对亮氨酸脱氢酶和甲酸脱氢酶共表达菌株发酵条件的优化
2.1.1 诱导温度的选择
诱导温度对酶蛋白合成和质粒稳定性有重要影响,过低的诱导温度会导致酶蛋白合成缓慢,从而影响酶活,但过高的诱导温度可能会导致酶蛋白积累过快,使酶蛋白因错误折叠形成大量没有活性的包涵体[22]。诱导时加入0.10 mmol/L的IPTG,分别在18、20、22、24、26、28 ℃条件下诱导16 h,结果见图2。

A-F分别是在诱导温度18、20、22、24、26和28 ℃下诱导培养的菌体破碎上清物;a-f是相对应的沉淀物图2 不同诱导温度下LeuDH和FDH的SDS-PAGE分析Fig.2 SDS-PAGE analysis of LeuDH and FDH at different induced temperature
由图2可知,甲酸脱氢酶蛋白的表达量多于亮氨酸脱氢酶蛋白表达量,且甲酸脱氢酶蛋白条带的变化程度大于亮氨酸脱氢酶蛋白条带,当诱导温度从18 ℃逐渐升高到26 ℃时,菌体破碎后的上清物中的可溶性蛋白和沉淀物中的包涵体都随之增加,当诱导温度达到28 ℃时,可溶性蛋白减少,包涵体继续增加,说明过低或过高的诱导温度都不利于可溶性蛋白的合成。
取等量的6组菌体的全细胞与含有苏氨酸脱氨酶的菌体进行配比,加入底物L-苏氨酸和辅底物甲酸铵,催化合成L-2-氨基丁酸,图3显示,当诱导温度为22 ℃时,转化率达到最高,虽然亮氨酸脱氢酶和甲酸脱氢酶蛋白的表达量都没有达到最大,但共表达菌株达到最佳催化效果,诱导温度低于或高于22 ℃,都不利于催化反应的进行。综合实验结果,确定22 ℃为最佳的诱导温度。

图3 不同诱导温度对共表达菌株催化活力的影响Fig.3 Effect of temperature on coexpression strains catalysis activity
2.1.2 诱导剂浓度的选择
诱导时分别添加0.06、0.08、0.10、0.12、0.14、0.16 mmol/L诱导剂IPTG,22 ℃条件下诱导16 h,考察IPTG浓度对产酶的影响,结果见图4。由图4可知,添加0.06 mmol/L的IPTG后目的蛋白的表达量比其他几组的蛋白表达量少。随着诱导剂浓度的提高,可溶性蛋白表达量没有明显变化,包涵体略有增加。由图5可知,当诱导剂浓度为0.06和0.08 mmol/L时,底物没有达到完全转化,当IPTG浓度由0.10 mmol/L升高到0.16 mmol/L时,最终都达到了完全转化,但2 h的转化率逐渐降低,可能因为过高浓度的IPTG对酶活有影响,降低了反应速度。综合实验结果,确定最适的IPTG浓度为0.10 mmol/L。

A-F分别是在诱导剂浓度0.06、0.08、0.10、0.12、0.14和0.16 mmol/L下诱导培养的菌体破碎上清物;a-f是相对应的沉淀物图4 不同诱导剂浓度下LeuDH和FDH的SDS-PAGE分析Fig.4 SDS-PAGE analysis of LeuDH and FDH at different inducer concentration

图5 不同诱导剂浓度对共表达菌株催化活力的影响Fig.5 Effect of inducer concentration on coexpression strains catalysis activity
2.1.3 诱导时间的选择
诱导时加入0.10 mmol/L的IPTG,22 ℃条件下分别诱导8、10、12、14、16、18、20 h,考察诱导时间对产酶的影响。由图6可知,延长诱导时间有利于可溶性蛋白的积累,但包涵体也随之增加。图7表明,随着诱导时间的增加,一定程度上有利于催化反应的进行,诱导14 h后,共表达菌株的催化反应能力基本达到稳定,之后不会随着诱导时间的增加而发生明显变化。最终确定最佳诱导时间为14 h。

A-G分别是在诱导时间8、10、12、14、16、18和20 h下诱导培养的菌体破碎上清物;a-g是相对应的沉淀物图6 不同诱导时间下LeuDH和FDH的SDS-PAGE分析Fig.6 SDS-PAGE analysis of LeuDH and FDH at different induction time

图7 不同诱导时间对共表达菌株催化活力的影响Fig.7 Effect of induction time on coexpression strains catalysis activity
由实验结果可以看出,温度对酶蛋白的可溶性表达和催化活力影响最大,诱导时间次之,诱导剂浓度的影响最小。当诱导温度22 ℃,诱导剂IPTG浓度0.10 mmol/L,诱导时间14 h,共表达菌株达到最佳催化效果,亮氨酸脱氢酶和甲酸脱氢酶的酶活分别达到83.4 U/g(以湿重计)和267.6 U/g(以湿重计)。甲酸脱氢酶蛋白的表达量和酶活都远大于亮氨酸脱氢酶,说明酶催化反应对NADH的需求量较大,需要大量的甲酸脱氢酶快速将NAD+转化为NADH,使细胞中的NADH保持较高水平。
2.2 5 L发酵罐水平对亮氨酸脱氢酶和甲酸脱氢酶共表达菌株发酵条件的优化
2.2.1 诱导剂乳糖浓度对催化反应进程的影响
在摇瓶实验的基础上,扩大发酵培养规模,在5 L发酵罐水平对重组菌进行发酵条件的优化。由于IPTG的成本较高,工业生产中常使用乳糖作为代替品,且经过实验验证,在5 L发酵罐水平诱导时分别加入0.10 mmol/L的IPTG和8.0 g/L的乳糖,菌体的催化效果相当,但是用IPTG诱导的菌体产量为26 g/L,用乳糖诱导的菌体产量为35 g/L,故本实验中选择乳糖为诱导剂。诱导时分别添加质量浓度为4.0、6.0、8.0、10.0、12.5 g/L的乳糖,22 ℃条件下诱导17 h。由图8可知,过低的乳糖添加量不利于反应的进行,使底物完全转化的最低乳糖质量浓度为8.0 g/L,继续提高乳糖浓度对反应的进程没有明显影响,确定最适的乳糖质量浓度为8.0 g/L。

图8 不同诱导剂乳糖浓度对催化反应进程的影响Fig.8 Time course of production of L-ABA used different inducer lactose concentration
2.2.2 诱导时间对催化反应进程的影响
随着诱导时间的延长,酶蛋白的表达量会有一定程度的增加,为了确定最适诱导时间,分别在降温诱导11、13、15、17、19 h后取样检测。由图9可知,随着诱导时间的延长,目的蛋白酶的催化能力逐渐升高,诱导17 h后,催化能力基本达到稳定,其后增长不明显。最终确定诱导时间为17 h。

图9 不同诱导时间对催化反应进程的影响Fig.9 Time course of production of L-ABA used different induction time
在5 L发酵罐水平上对共表达菌株发酵条件进行优化,实验结果表明,当诱导温度22 ℃,诱导剂乳糖质量浓度8.0 g/L,诱导时间17 h,共表达菌株达到最佳催化效果,亮氨酸脱氢酶和甲酸脱氢酶的酶活分别达到79.2 U/g(以湿重计)和216.1 U/g(以湿重计)。
2.3 催化制备L-2-氨基丁酸反应条件的优化
2.3.1 底物L-苏氨酸浓度的选择
在生物催化的过程中,过低浓度的底物添加量会浪费资源,增加生产成本,而过高浓度的底物添加量会造成底物抑制现象,都不利于工业化生产,故寻求最适浓度的底物添加量是十分必要的。反应体系中L-苏氨酸的初始质量浓度分别为120、150、180、210、240 g/L,甲酸铵的摩尔量与L-苏氨酸的摩尔量相同,在上述优化的反应条件下进行酶催化反应,结果见图10。低浓度的底物添加量,催化反应进行的较快,当L-苏氨酸的质量浓度为120、150、180 g/L时,可实现底物的完全转化,当底物浓度继续提高,会出现底物抑制现象。因此,选定L-苏氨酸的质量浓度180 g/L。

图10 不同L-苏氨酸质量浓度对催化反应进程的影响Fig.10 Time course of production of L-ABA used different L-Thr concentration
2.3.2 辅底物甲酸铵浓度的选择
辅底物甲酸铵可用于辅酶NADH的再生,甲酸铵的添加量决定了NADH循环再生的效率,进而影响催化反应的进行。一般在NADH再生体系中,添加的辅底物的摩尔当量要大于底物的摩尔当量,以实现底物的完全转化。由图1的反应式可知,甲酸铵与L-苏氨酸的理论摩尔比为1∶1,故当反应体系中L-苏氨酸的质量浓度为180 g/L时,分别添加与L-苏氨酸的摩尔比1.00∶1、1.05∶1、1.10∶1、1.15∶1、1.20∶1、1.25∶1 的甲酸铵,在上述优化的反应条件下,实验结果见图11。所有反应中底物都实现了完全转化,且甲酸铵浓度较高时,反应进程并没有明显加快,为了方便提纯和节约成本,选择添加与L-苏氨酸的摩尔量相同的甲酸铵,即为95.3 g/L甲酸铵。
图11 不同甲酸铵浓度对催化反应进程的影响Fig.11 Time course of production of L-ABA used different ammonium formate concentration
2.3.3 反应温度和反应体系pH的选择
继而考察反应温度对制备L-2-氨基丁酸的影响,反应体系为180 g/L底物L-苏氨酸,95.3 g/L辅底物甲酸铵,10 g/L含有苏氨酸脱氨酶的湿菌体,40 g/L共表达湿菌体,于去离子水中构成100 mL反应体系,不控制反应液pH,分别在25、30、35、40、45、50 ℃,600 r/min条件下进行酶催化反应8 h,结果见图12-A。
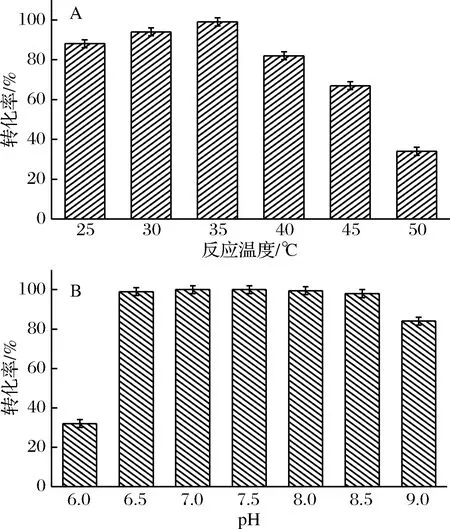
A-反应温度;B-pH图12 不同反应温度和反应体系的pH对共表达菌株催化活力的影响Fig.12 Effect of reaction temperature and reaction pH on co-expression strains catalysis activity
在35 ℃之前,随着反应温度的提高,转化率也提高,当反应温度为35 ℃时,转化率达到最高,继续升高反应温度,转化率急剧下降,可能是因为过高的反应温度使酶失活,温度对于酶活的影响符合一般的酶活规律,综合实验结果,确定35 ℃为最佳反应温度。
进一步考察反应体系pH对制备L-2-氨基丁酸的影响,实验组于0.2 mmol/L磷酸钠缓冲液中构成100 mL反应体系,使用恒态pH电位滴定仪通过添加体积分数为50%的磷酸水溶液和氨水水溶液分别控制反应液的pH为6.0、6.5、7.0、7.5、8.0、8.5、9.0,结果见图12-B。过高或过低的pH都会影响酶活,当pH为6.5~8.0时,转化率达99%以上,当pH为8.5时,转化率达98.0%,且控制反应体系pH时,反应进程并没有明显提高,故为了节约成本和方便提纯,以去离子水为反应介质构成反应体系,不控制反应体系的pH。
2.4 催化反应进程
为了探究共表达菌株工业化生产L-ABA的潜力,利用在5 L发酵罐水平优化后获得的菌体全细胞作为催化剂,耦合苏氨酸脱氨酶,在上述优化的反应条件下,反应体系扩大到1L,反应结果见图13。L-ABA在反应2 h内生成的速度较快,之后反应速度放缓,可能是因为随着反应的进行酶活性不断降低,并且产物的积累对酶活性也有一定的抑制作用。反应至8 h基本结束,此时底物转化率99%以上,e.e.值99.5%以上,时空产率19.3 g/(L·h)。

图13 苏氨酸脱氨酶偶联共表达细胞催化合成L-2-氨基丁酸进程Fig.13 Time course of production of L-ABA by TD coupling with LeuDH and FDH co-expression cells
3 结论
本实验室构建的亮氨酸脱氢酶和甲酸脱氢酶双酶共表达基因工程菌E.coli-BL21(DE3) (LeuDH/FDH),其全细胞可作为催化剂应用于L-2-氨基丁酸的制备,在反应过程中实现了胞内辅酶NADH的循环再生,无需额外添加辅酶。在摇瓶水平优化了产酶条件,实验结果表明,当诱导温度22 ℃,IPTG浓度为0.10 mmol/L,诱导时间14 h时,共表达菌株达到最佳催化效果,亮氨酸脱氢酶和甲酸脱氢酶的酶活分别达到83.4 U/g(以湿重计)和267.6 U/g(以湿重计)。在此基础上,培养规模扩大到5 L发酵罐,实验结果表明,当诱导温度22 ℃,诱导剂乳糖质量浓度8.0 g/L,诱导时间17 h,共表达菌株达到最佳催化效果,亮氨酸脱氢酶和甲酸脱氢酶的酶活分别达到79.2 U/g (以湿重计)和216.1 U/g(以湿重计)。目前以L-苏氨酸为底物,利用苏氨酸脱氨酶和亮氨酸脱氢酶,并偶联NADH再生系统催化制备L-2-氨基丁酸的相关报道中,苏金环等[14]的实验中L-苏氨酸质量浓度为100 g/L,反应至16.5 h基本结束,可以达到99%以上的转化率,e.e.值99.9%以上;刘珊等[28]的实验中L-苏氨酸质量浓度50 g/L,反应20 h,可实现L-2-氨基丁酸的摩尔产率为99%,产量为43 g/L;郭红颜等[29]的实验中L-苏氨酸质量浓度为7 g/100 mL 时,反应20 h,产率达95%;徐建妙等[18]的实验中L-苏氨酸质量浓度为180 g/L,反应9 h后,底物转化率达99%以上,时空产率17.2 g/(L·h),e.e.值99.5%以上;TAO等[15]的实验中,L-苏氨酸质量浓度为119 g/L,转化率可达97.3%,时空产率6.37 g/(L·h)。并且以上报道的实验中都需要额外投加辅酶,这大大增加了生产成本。利用共表达菌体耦合苏氨酸脱氨酶制备L-2-氨基丁酸,在1L反应体系中当底物L-苏氨酸达到180 g时,无需额外添加辅酶,8 h后底物转化率达99%以上,e.e.值99.5%以上,时空产率达19.3 g/(L·h),显著高于目前报道水平。本论文所采用的双酶偶联体系为建立高效、低成本的L-2-氨基丁酸工业化生产方法提供了一定的数据基础。

