炎症、骨重建和类风湿关节炎全身骨量丢失的相关性研究
孙怡宁 冯秀媛 曾令霞 罗静 王亚文 李娜 何岚*
1.西安交通大学第一附属医院风湿免疫科,陕西 西安 710061 2.西安交通大学公共卫生学院流行病学和生物统计学教研室,陕西 西安 710061 3.西安交通大学第一附属医院检验科,陕西 西安 710061
类风湿关节炎(rheumatoid arthritis,RA)是以慢性进行性多关节炎为特征的系统性自身免疫病,全身骨质疏松是RA病程发展过程中重要的关节外表现,最常见的发病部位是腰椎、股骨和前臂[1]。早期或初发RA患者即可发生骨质疏松和骨量减低[2]。长病程RA患者与对照组相比,其骨质疏松发生率将增加2倍,椎体骨质疏松的发生率为19%~32%,髋部骨质疏松的发生率为7%~26%[3]。全身骨量丢失造成RA患者脆性骨折的风险显著增高,通过对绝经后女性RA患者的随访观察研究[4]表明,5年内有19%的患者出现新发椎体骨折,16 %的患者出现新发非椎体骨折。RA患者髋部骨折的风险最高,腕关节、肱部、髋部和骨盆骨折的发生率比非RA人群高1.5倍[5]。
骨量的维持取决于破骨细胞的骨吸收和成骨细胞的骨形成处于动态平衡,破骨细胞的骨吸收增加是RA患者全身骨量丢失的主要原因[6]。破骨细胞起源于骨髓单核/巨噬细胞系(bone marrow derived monocyte/macrophage lineage cells,BMMs),核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)与破骨细胞前体细胞表面核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK)的结合在诱导破骨细胞前体细胞向成熟破骨细胞分化过程中起关键作用[7]。骨转换指标(bone turnover markers,BTMs)是骨吸收和骨形成过程中产生、释放的蛋白质和基质降解产物,血清I型胶原羧基端交联肽(C-terminal telopeptide of type I collagen,I-CTX)和I型胶原氨基端前肽(aminoterminal propeptide of type I collagen,PINP)目前被认为是分别代表破骨细胞骨吸收和成骨细胞骨形成最好的BTMs[8]。Fardellone等[9]发现血清RANKL、I-CTX能较好地反映RA患者全身骨吸收水平,PINP则能更好地反映接受TNF-α抑制剂(TNF-α inhibitors,TNFi)治疗的RA患者的治疗反应。
免疫炎症是引起RA患者全身骨量丢失的重要原因之一,肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介素-6(interleukin,IL-6)不仅是引起RA关节炎的主要炎性细胞因子,同时参与RA患者全身的骨重建。TNF-α促进破骨细胞前体细胞表达RANK,刺激成骨细胞、骨细胞、T、B淋巴细胞产生和表达RANKL,是破骨细胞分化的刺激因子[10]。TNF-α与RANKL可以协同作用诱导BMMs分化为成熟破骨细胞[11]。通过对IL-6转基因小鼠的研究[12]发现,IL-6促进了破骨细胞分化、降低成骨细胞活性导致小鼠骨吸收增加、全身骨量丢失。临床研究[13-14]证实,抗TNF-α和抗IL-6生物制剂可以阻止RA患者全身骨丢失,使骨形成指标升高、骨吸收指标下降,进一步证实炎性细胞因子在引起RA患者全身骨量丢失中发挥了作用。本研究拟纳入符合2010年美国风湿病学会/欧洲抗风湿联盟(American College of Rheumatology/European League Against Rheumatism,ACR/EULAR)RA分类标准的患者,通过检测患者血清TNF-α、IL-6、RANKL、I-CTX、PINP水平以及腰椎和髋部骨密度,分析炎性细胞因子、BTMs与腰椎和髋部骨密度的相关性,探讨免疫炎症、骨重建在RA患者全身骨量丢失中的作用。
1 材料与方法
1.1 研究对象
纳入2017年1月至2018年1月就诊于我院风湿免疫科、符合2010年 ACR/EULAR RA分类标准、年龄 ≥ 18岁的RA患者117例,其中男性38例,女性79例,平均年龄(54.24±13.39)岁。将RA患者分为初治组即未使用任何药物或仅间断使用非甾体抗炎药的初发未治疗患者[41例,平均病程(25.15±46.29)个月]和复治组即曾使用糖皮质激素和(或)传统缓解病情抗风湿药和(或)生物制剂和(或)双膦酸盐的患者[76例,平均病程(130.06±124.06)个月]。对照组选择同时期在我院体检中心查体的健康人群51名,其中男性18名,女性33名,平均年龄(40.53±7.26)岁。
1.2 血清TNF-α、IL-6和RANKL检测
收集RA患者和健康对照人群的清晨空腹静脉血,分离血清,-80 ℃冰箱保存。按人TNF-α、IL-6和RANKL ELISA试剂盒(欣博盛生物公司)说明书操作,在抗体包被的酶标板(96孔)上依次每孔加入血清100 μL、生物素化的抗体100 μL、辣根过氧化物酶标记的亲和素100 μL、显色底物100 μL,经洗涤、孵育后在酶标仪(BioTek,ELX800)450 nm处进行测定。
1.3 血清I-CTX和PINP检测
收集RA患者清晨空腹静脉血,分离血清,按人I-CTX和抗PINP电化学发光检测试剂盒(罗氏公司)说明书操作。首先将50 μL血清与生物素化抗I-CTX和抗PINP单克隆抗体混匀,然后加入链霉亲和素包被的微粒和钌标记的抗I-CTX与抗PINP单克隆抗体,将反应混合液吸入到测量池,采用全自动电化学发光免疫分析仪(cobase e 602)进行检测。
1.4 骨密度检测
采用双能X线骨密度仪(LEXXOS-LX381, 法国DMS)测量患者腰椎(L1~4)和髋部骨密度。操作由一名专业人员完成,腰椎骨密度重复测量准确性为0.16 %,髋部骨密度重复测量准确性为0.15 %。骨密度以数值(g/cm2)和标准差(T值)的形式表示,根据WHO骨密度测量诊断标准即T<-1.0为骨量减低,T≤-2.5为骨质疏松。
1.5 统计学分析
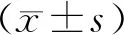
2 结果
2.1 RA患者骨密度比较
初治组RA患者中腰椎和(或)髋部骨量减低者占46.3%、骨质疏松者为24.4%,腰椎骨质疏松者为24.4%,髋部骨质疏松者为5.2%。复治组RA患者腰椎和(或)髋部骨量减低者占28.9%、骨质疏松者为44.7%,腰椎骨质疏松者为45.5%,髋部骨质疏松者为10.7%,见表1。

表1 RA患者腰椎和髋骨密度比较Table 1 Bone mineral density of the lumbar spine and total hip in the patients with rheumatoid arthritis
2.2 RA患者与正常对照人群血清TNF-α、IL-6和RANKL比较
初治组RA患者血清TNF-α和IL-6水平与对照组比较,差异无统计学意义[(26.07±46.76)pg/mL,(11.45±4.18)pg/mL,Z=-0.876,P=0.381;(7.50±5.17)pg/mL,(9.43±7.99)pg/mL,Z=-1.799,P=0.072];复治组RA患者血清TNF-α和IL-6水平较对照组显著增高[(22.63±33.55)pg/mL,(11.45±4.18)pg/mL,Z=-2.038,P=0.042;(10.38±17.69)pg/mL,(9.43±7.99)pg/mL,Z=-3.086,P=0.002]。意料之外的是,初治组RA患者和复治组RA患者血清RANKL均明显低于对照组[(16.11±8.06)pg/mL,(15.10±6.30)pg/mL,(20.81±22.22)pg/mL;Z=-2.058,P=0.040;Z=-3.028,P=0.002]。见图1。

图1 RA患者和健康对照血清TNF-α、IL-6和RANKL比较Fig.1 Serum levels of TNF-α, IL-6, and RANKL in RA patients and the controls
2.3 RA患者血清TNF-α、IL-6与骨转换指标的相关性
初治组RA患者血清TNF-α和IL-6与骨转换指标RANKL、I-CTX、PINP均无显著相关性(P>0.05);复治组RA患者血清TNF-α与血清RANKL水平呈显著正相关(r=0.451,P=0.000),而与血清I-CTX和PINP无显著相关(P>0.05);复治组RA患者血清IL-6与血清RANKL、I-CTX、PINP均无显著相关性(P>0.05)。
2.4 RA患者血清TNF-α和IL-6与骨密度的相关性
初治组RA患者血清TNF-α和IL-6与患者腰椎和髋部骨密度无显著相关性(P>0.05);复治组RA患者血清TNF-α与患者腰椎和髋部骨密度无显著相关(P>0.05);复治组RA患者血清IL-6与患者腰椎骨密度呈显著负相关(r=-0.236,P=0.040),而与患者髋部骨密度无显著相关性(P>0.05)。
2.5 RA患者血清BTMs与骨密度的相关性
初治组RA患者血清RANKL与患者腰椎和髋部骨密度无显著相关性(P>0.05),血清I-CTX、PINP与患者髋部骨密度呈显著负相关(r=-0.332,P=0.042;r=-0.482,P=0.003),与腰椎骨密度无显著相关性(P>0.05);复治组RA患者血清RANKL、I-CTX、PINP与患者腰椎和髋部骨密度均无显著相关性(P>0.05)。
3 讨论
RA是以关节滑膜炎为主要病理特征的系统性自身免疫病,RA引起的骨损害表现在3个方面:受累关节骨侵蚀、受累关节骨质疏松和全身骨量丢失[15]。“骨免疫学”研究[16]发现,RA发病与病程中的免疫炎症和异常的自身免疫干扰了正常的骨转换,导致RA患者全身骨量丢失。此次研究中发现,初治组RA患者中骨量减低的患者比例较复治组增多(46.3%; 28.9%),而复治组RA患者中骨质疏松的患者比例较初治组增多(44.7%; 24.4%),两组患者腰椎骨质疏松的比例较髋部骨质疏松的比例更高,这些结果与笔者前期关于初发结缔组织病患者低骨量的研究结果基本一致[17]。复治组RA患者并发骨质疏松比例较初治组患者增高可能与病程长、疾病控制不佳、既往使用糖皮质激素等药物有关。
在此次研究中首先对比了初治组RA患者、复治组RA患者和正常对照人群血清TNF-α、IL-6与RANKL水平,结果发现虽然初治组RA患者血清TNF-α和IL-6水平与对照组无明显差异,但复治组RA患者血清TNF-α和IL-6水平较对照组均显著增高,说明RA患者具有以T细胞免疫异常为特征的慢性炎症的持续存在。动物实验和细胞实验[18]均发现,TNF-α可以促进RANKL/RANK表达和相互作用,与RANKL协同作用诱导破骨细胞分化成熟。对RA小鼠模型的研究[19]表明,IL-6增加了小鼠胫骨骨髓中破骨细胞前体细胞的数量,抗IL-6受体抗体显著抑制了小鼠全身骨丢失。在糖皮质激素诱导的骨质疏松小鼠模型IL-6抑制椎体骨髓间充质细胞向成骨细胞分化,抑制成骨细胞形成[20]。对RA患者十年的随访研究[21]证实了有效地抗炎治疗可以减少患者股骨颈、髋和腰椎骨密度的下降。相关性分析显示患者体质量指数、吸烟和女性患者的绝经状态在初治和复治RA患者中与BTMs和骨密度均无显著相关性。笔者进一步对血清TNF-α、IL-6与BTMs和骨密度进行相关性分析,发现复治组RA患者血清TNF-α与骨吸收指标RANKL水平呈显著正相关(r=0.451,P=0.000),血清IL-6与患者腰椎骨密度呈显著负相关(r=-0.236,P=0.040)。可见长病程复治RA患者的TNF-α和IL-6可能与破骨细胞骨吸收增加有关,并且在引起全身骨量丢失中发挥作用。
RANKL是诱导破骨细胞前体细胞向成熟破骨细胞分化最主要的成分,但此次研究中无论是初治组还是复治组,RA患者的血清RANKL均明显低于对照组,这一结果与其他文献报道不同。Johansson等[22]发现,在RA患者症状发生前数年即可有RANKL水平的增高。ACPA阳性的早期未治疗RA患者血清RANKL水平明显高于ACPA阴性患者,并且血清RANKL水平与关节骨侵蚀相关[23]。RANKL分为膜结合型和可溶性,可溶性RANKL调节破骨细胞前体细胞分化的作用相对弱[24],成骨细胞、骨细胞和T淋巴细胞等表达的膜结合型RANKL激活破骨细胞前体细胞RANK信号是调节破骨细胞分化的主要途径[7]。除此以外,骨髓间充质细胞表达的骨保护素(osteoprotegerin,OPG)可以做为RANKL的诱饵受体抑制破骨细胞前体细胞分化[25]。因此,在早期初发RA患者全身骨量丢失中血清可溶性RANKL发挥怎样的作用仍有待进一步研究。BTMs与骨密度的相关分析表明,初治RA患者血清骨吸收指标I-CTX和骨形成指标PINP与患者髋部骨密度呈显著负相关,由于骨重建过程中破骨细胞骨吸收和成骨细胞骨形成的时空偶联[26],进一步说明骨转换增高在引起初发未治疗RA患者髋部骨量丢失中发挥了作用。
此次研究结果表明,骨转换增高可能是引起初治RA患者髋部骨量丢失的原因。复治RA患者持续存在的慢性炎症可能通过增加破骨细胞骨吸收引起腰椎骨量丢失。此次研究的不足之处在于,初治组RA患者例数相对较少,难以对RA患者进行抗环瓜氨酸肽抗体阳性或阴性、类风湿因子阳性或阴性,性别、绝经前或绝经后等进一步的分层分析。另外,对照组仅纳入了健康人群,如能纳入年龄和性别分布与RA患者相匹配的骨关节炎患者做为对照会更佳。因此,进一步扩大入组RA患者样本量,增加不同的人群作为对照,对患者进行更加详细的分层分析将是下一步研究的方向。

