重大检疫性害虫玉米根萤叶甲的种特异性SSCOⅠ快速检测技术研究
张桂芬 王玉生 郭建洋 冼晓青


摘要玉米根萤叶甲在欧洲和美国是一种严重为害玉米的入侵性害虫,传播速度快,侵入我国的可能性极高。本文针对其难以快速准确进行形态鉴别的问题,以玉米根萤叶甲为研究对象,以其他9种/生物型叶甲总科常见害虫为参照,采用基于COⅠ基因的种特异性PCR方法(speciesspecific COⅠ, SSCOⅠ),研究其快速分子检测鉴定技术。通过提取10种/生物型叶甲DNA和通用型引物扩增测序,获得其基因片段的碱基序列,并比对分析设计1对玉米根萤叶甲特异性引物(DvvZCE1/DvvZCF1),其扩增片段为462 bp。种特异性检验结果显示,该对引物只对玉米根萤叶甲的COⅠ基因具有扩增能力,对其他常见叶甲类害虫,包括玉米双斑长跗萤叶甲、榆黄毛萤叶甲、黄曲条跳甲、油菜蚤跳甲、黄点直缘跳甲、莲草直胸跳甲、枸杞负泥虫以及褐足角胸叶甲的棕黄型和蓝绿型没有扩增能力,该对引物不仅对成虫有很好的扩增效果,对单粒卵、2龄幼虫以及成虫残体(包括触角、头部、胸部、腹部、前足、后足)也具有同样的扩增效果,其最低检出阈值为102.73 pg/μL(相当于1/122 880头雌性成虫)。玉米根萤叶甲特异性SSCOⅠ检测技术在其口岸检疫,以及有效阻截中具有重要意义。
关键词玉米根萤叶甲;SSCOⅠ标记;种特异性引物;快速鉴定;分子检测
中图分类号:S 435.132
文献标识码:A
DOI:10.16688/j.zwbh.2018031
玉米根萤叶甲Diabrotica virgifera virgifera LeConte,又名玉米切根叶甲,属于鞘翅目,叶甲总科,叶甲科,萤叶甲亚科,根萤叶甲属;原产于北美洲的南部和中美洲的北部,是为害玉米的一种世界性毁灭性检疫害虫[12],2007年农业部将根萤叶甲属列入《中华人民共和国进境植物检疫性有害生物名录》[3]。玉米根萤叶甲的成虫和幼虫均可造成为害,且幼虫较成虫为害更为严重;寄主植物包括禾本科、菊科、豆科及葫芦科等,而玉米受害最为严重[4]。其中,成虫主要以玉米植株的雌穗花丝,雄穗花穗、花粉,叶片以及玉米的幼嫩籽粒等为食,亦可取食其他植物的花粉和叶片;为害叶片时成虫主要取食叶片的上表皮,形成玻璃窗样不规则的半透明条形斑;授粉期为害雌穗花丝使花穗呈齐头剪断状,影响玉米的授粉和受精,导致结实不良[56]。幼虫主要以玉米的须根和主根或其他寄主植物如小麦、大豆、南瓜、向日葵等的根为食[4, 79];初孵幼虫取食须根,大龄幼虫钻入根部组织内蛀食为害,不仅影响水分和养分的输送,形成瘪粒造成减产,甚或使植株干枯死亡;此外,幼虫钻蛀所形成的伤口还可诱发病菌侵染,导致植株根部腐烂,引发植株倒伏,甚至死亡[56, 1011]。倘若防治不及时,可造成玉米减产10%~40%,甚至高达90%的产量损失[1213]。如在欧洲,据测算玉米根萤叶甲每年可造成大约4.72亿欧元的损失[14];在美国,则每年可造成大约8亿美元的玉米产量损失和2亿美元的防治费用,并因此被冠以“十亿美元害虫”的名号[5]。此外,玉米根萤叶甲还可以传播玉米褪绿斑驳病毒(MCMV),使玉米病毒病流行[15],造成绝产绝收。
1955年之前,玉米根萤叶甲主要在美国的中西部地区发生与为害,是该地区玉米的一种重要害虫[5]。然而,在此后的50年间却以每年44~125 km的速度迅速向东扩张,1985-2005年扩散至大西洋沿岸并在北美和中美地区广泛分布,发生区域主要包括加拿大、美国、墨西哥、哥斯達黎加、危地马拉和尼加拉瓜等国家[16]。1992年,玉米根萤叶甲首次在位于欧洲东南部的塞尔维亚(前南斯拉夫)首都贝尔格莱德国际机场附近的玉米田被发现[17],之后在欧洲迅速扩散蔓延[1819],目前已在阿尔巴尼亚、奥地利、白俄罗斯、比利时、波黑(波斯尼亚黑塞哥维那)、保加利亚、克罗地亚、捷克共和国、法国、德国、希腊、匈牙利、意大利、黑山共和国、荷兰(已根除)、波兰、罗马尼亚、俄罗斯联邦、塞尔维亚(前南斯拉夫)、斯洛伐克、斯洛文尼亚、瑞士、乌克兰、英国等24个国家发生与为害,使玉米产业遭受了严重打击[9, 1819];已经成为欧美乃至世界玉米产业的一种毁灭性害虫[1819]。尽管目前我国尚未有玉米根萤叶甲的发生,然而由于我国每年从疫情发生国如美国、匈牙利等大量进口玉米(海关信息网 http:∥www.haiguan.info/),其侵入我国的可能性极大[20];进一步的定性与定量风险分析表明,该种根萤叶甲属于高度危险性有害生物(综合风险值为2.08)[21],并且我国玉米的主要种植区域(如东北平原和华北平原)与其适生区域高度吻合[22]。因此加强对玉米根萤叶甲的检疫检验和检测监测,是保障我国玉米,以及小麦、向日葵等产业健康发展的首要前提。
以往,叶甲类害虫的识别与鉴定主要是依据成虫的外部形态特征。玉米根萤叶甲为小型甲虫类昆虫,成虫体长约4.4~6.8 mm,与其他近缘种叶甲的形态极为相似[23],未经专业训练的普通植保植检人员很难对其进行准确识别;至于它的卵(长0.65 mm、宽0.45 mm,初产为白色,近孵化时为淡黄色)、幼虫(初孵半透明,几近无色或白色)和蛹[1, 23],即使是经过专业培训亦难以将其与近缘种快速区分开来。故而,本研究拟以线粒体DNA细胞色素C氧化酶亚基I(mitochondrial DNA cytochrome c oxidase submit I, mtDNA COⅠ)基因为靶标,研究建立靶定玉米根萤叶甲的种特异性(speciesspecific COⅠ, SSCOⅠ) PCR检测技术体系,以期为玉米根萤叶甲快速检测鉴定,有效防范其侵入我国提供技术支撑。
1材料与方法
1.1供试虫源
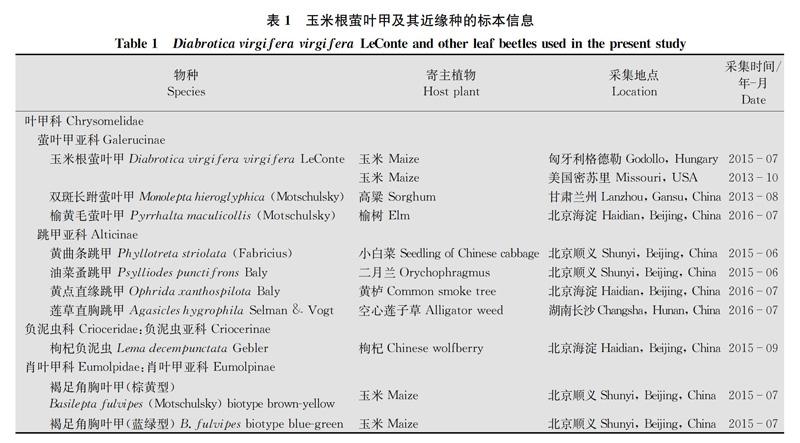
玉米根萤叶甲分别来自匈牙利和美国,寄主植物均为玉米;本文涉及的其他叶甲总科昆虫共计9种,相关具体信息详见表1。
1.2DNA提取
以玉米根萤叶甲以及其他9种/生物型叶甲(包括双斑长跗萤叶甲、榆黄毛萤叶甲、黄曲条跳甲、油菜蚤跳甲、黄点直缘跳甲、莲草直胸跳甲,枸杞负泥虫、褐足角胸叶甲(棕黄型)和褐足角胸叶甲(蓝绿型))为对象,以盐渍法[24]略加改进,提取单头叶甲总DNA。将单头叶甲成虫的部分组织(其中,黄曲条跳甲和油菜蚤跳甲为单头整个虫体,其余种类均为腹部1/4)置于1.5 mL的离心管中,加入液氮后以玻璃研磨棒充分研磨,然后以150 μL缓冲液(50 mmol/L TrisHCl, 1 mmol/L EDTA, 1% SDS, 20 mmol/L NaCl; pH 8.0)分2次清洗研磨棒,混匀,加入5 μL蛋白酶K(20 mg/mL),充分混匀后于60℃水浴1 h(中途混匀1次);然后沸水浴8 min,加入220 μL 氯仿/异戊醇(V∶V=24∶1)抽提液,轻柔混匀数十次后,冰上放置30 min;4℃、14 000 r/min 离心10 min,取上清液约350 μL移入另一离心管,加入800 μL预冷的无水乙醇,轻轻混匀,待出现少量絮状沉淀后于-20℃放置30 min;4℃、14 000 r/min离心10 min,小心弃去上清液。加入300 μL预冷的75%乙醇洗涤,4℃、14 000 r/min离心10 min,小心弃去上清液;然后将离心管倒扣于洁净滤纸上,自然干燥30 min后每管加入30 μL超纯水,充分溶解,以超微量分光光度计(NanoPhotometerTM P330, Implen, Munich, Germany)测定提取的DNA浓度,-40℃保存备用。
1.3叶甲类昆虫COⅠ基因序列的PCR扩增
以玉米根萤叶甲以及其他9种/生物型常见叶甲总科害虫的DNA为模板,以mtDNA COⅠ基因的通用型引物对LCO1490/HCO2198(上游引物和下游引物的碱基序列分别为LCO1490:5′GGT CAA CAA ATC ATA AAG ATA TTG G3′和HCO2198: 5′TAA ACT TCA GGG TGA CCA AAA AAT CA3′)进行PCR扩增,扩增片段的长度约为680 bp[25]。PCR反应体系为25 μL,其中,10× Buffer(含Mg2+)2.5 μL,dNTPs(10 mmol/L)0.5 μL,上游引物和下游引物(5 pmol/L)各为0.5 μL,Taq DNA聚合酶(2.5 U/μL,北京全式金生物技术有限公司产品)0.3 μL,模板DNA 2.0 μL,以18.7 μL超纯水补齐。扩增程序为95℃预变性5 min;94℃ 30 s, 51℃ 30 s, 72℃ 50 s,35个循环;最后72℃延伸7 min。PCR扩增反应在基因扩增仪(ABI9700)上运行。取5 μL PCR产物在含有GoldView的1.0%(W∶V)琼脂糖凝胶上以90 V电泳(BioRad PowerPac Basic)分离45 min后,以GelDocUniversal HoodII型凝胶成像系统(BIORAD Laboratories)检测电泳结果。经电泳检测验证合格的PCR产物,送生工生物工程(上海)股份有限公司进行双向测序。依据标本采集情况,分别检测3~8头。
1.4玉米根萤叶甲SSPCR引物的设计
根据本研究中测序获得的玉米根萤叶甲和其他9种/生物型叶甲以及数据库中已公开的玉米根萤叶甲的碱基序列,以软件MEGA6、Oligo7进行比对分析,设计玉米根萤叶甲特异性SSCOⅠ引物1对(DvvZCE1/DvvZCF1),上游引物DvvZCE1的碱基序列为5′ GTA CGA GCA GAA TTA GGA AGG3′,下游引物DvvZCF1的碱基序列为5′ AAT TAC GAC AGC TCA AAC AAA TAG G 3′(生工生物工程(上海)股份有限公司协助合成),可扩增出462 bp的片段。
1.5SSCOⅠ引物的种特异性和灵敏性检验
分别以田间常见9种/生物型叶甲的成虫mtDNA为模板,以玉米根萤叶甲为阳性对照,检验玉米根萤叶甲SSCOⅠ引物 DvvZCE1/DvvZCF1的种特异性。PCR反应体系为25 μL,其中10× Buffer 2.5 μL(含Mg2+),dNTPs 0.5 μL(0.2 mmol/L),上游引物和下游引物各0.5 μL(5 pmol/L),Taq DNA聚合酶(5 U/μL)0.3 μL,模板DNA 2 μL,超纯水18.7 μL。反应条件为:95℃预变性5 min;94℃ 30 s,53℃ 30 s,72℃ 40 s,35个循环;最后72℃ 延伸7 min。每种叶甲分别检测8头成虫。同时,以卵(单粒)、2龄幼虫(腹部1/3)以及成虫残体[包括触角(1对)、头部、胸部(1/2)、腹部(1/4)、前足(1对)、后足(1对)] DNA为模板,进行灵敏性检验;以梯度稀释的单头雌性成虫(腹部1/4)DNA为模板,进行最低检测阈值测定,每种虫态/成虫残体或浓度梯度分别检测8头。
2结果与分析
2.1叶甲类昆虫COⅠ基因5′端序列扩增及SSCOⅠ标记分析
以玉米根萤叶甲以及其他9种/生物型叶甲即双斑长跗萤叶甲、榆黄毛萤叶甲、黄曲条跳甲、油菜蚤跳甲、黄点直缘跳甲、莲草直胸跳甲、枸杞负泥虫、褐足角胸叶甲(棕黄型)和褐足角胸叶甲(蓝绿型)成虫的mtDNA为模板,以通用型引物LCO1490/HCO2198进行PCR扩增。电泳检测结果显示,10种叶甲均能扩增出一条清晰的目的片段(图1);对经电泳检测合格的PCR產物进行双向测序,结果表明,该片段约680 bp,为线粒体DNA COⅠ基因5′端的克隆片段。根据10种叶甲的测序结果设计玉米根萤叶甲特异性SSCOⅠ引物1对(DvvZCE1/DvvZCF1),其扩增片段的大小为462 bp。
2.2玉米根螢叶甲SSCOⅠ引物种特异性检验
以玉米根萤叶甲和其他9种/生物型常见叶甲的成虫DNA为模板,以上述所设计的特异性SSCOⅠ引物对DvvZCE1/DvvZCF1进行PCR扩增,电泳检测结果显示,该引物只对玉米根萤叶甲具有扩增效果,对其他9种近缘种/生物型叶甲不具有扩增能力,表明该对引物为玉米根萤叶甲的特异性引物(图2)。
2.3玉米根萤叶甲SSCOⅠ引物灵敏性检验
以玉米根萤叶甲的卵、2龄幼虫、雄性成虫以及雌性成虫及其残体DNA为模板,以SSCOⅠ引物DvvZCE1/DvvZCF1进行PCR扩增,电泳检测结果显示,不同虫态、不同性别以及雌性成虫的不同残体均能稳定地扩增出462 bp的特异性靶标片段(图3)。
2.4玉米根萤叶甲SSCOⅠ引物的检测阈值
将玉米根萤叶甲雌性成虫DNA模板以2倍递减梯度进行稀释,检测结果显示,当DNA浓度稀释为102.73 pg/μL(相当于1/122 880头雌性成虫)时,所有个体均可扩增出462 bp的靶标片段,而且条带清晰明亮(图4)。
3讨论
玉米根萤叶甲是玉米的毁灭性害虫,也是我国禁止进境的植物检疫性有害生物,极易随进口玉米(如青储玉米)(海关信息网 http:∥www.haiguan.info/)等的国际贸易活动侵入我国[9]。玉米根萤叶甲主要以幼虫取食玉米须根、蛀食玉米主根,使植株倒伏乃至死亡[56],同时还可传播玉米褪绿斑驳病毒,使病毒病大流行[15],造成玉米绝产绝收,一旦传入将严重影响我国玉米产业以及小麦等其他禾本科粮食作物的健康发展,严重威胁我国粮食安全和生态安全。
玉米根萤叶甲可以藏匿在植物生长介质中的卵,钻蛀在根或根茎中的幼虫,以及隐藏在嫩芽、叶片、茎秆、花序中的成虫等,借助贸易活动进行远距离传播[9]。目前,玉米根萤叶甲尚未入侵我国,但该种叶甲已在20多个国家包括我国的邻邦俄罗斯发生,并且进一步传播扩散趋势明显,其潜在适生区与我国玉米的主要种植区极度吻合[22],因此研发快速准确的检测鉴定技术是防止玉米根萤叶甲入侵我国,保障我国粮食安全和生态安全的紧要前提,而以往基于外部形态特征的比较形态学鉴定法不能满足快速通关和有效阻截的基本需求。本研究研发的玉米根萤叶甲特异性SSCOⅠ检测技术专一性强,只对玉米根萤叶甲具有扩增作用,对其他常见的近缘种叶甲没有扩增效果。而且,该检测技术的灵敏度高,不仅可以检测玉米根萤叶甲的单粒卵,还可检测成虫的残体,包括头部、胸部、腹部以及触角、前足、后足等;以成虫DNA为模板进行梯度稀释,其最低检测阈值为102.73 pg/μL,相当于1/122 880头雌性成虫。将特异性引物DvvZCE1/DvvZCF1扩增片段的测序结果与GenBank进行比对,结果显示,该片段与玉米根萤叶甲的同源性为99%~100%,而与其他种类昆虫的同源性为87%~90%,包括同属近缘种十一星根萤叶甲Diabrotica undecimpunctata (L.)(同源性88%)和巴氏根萤叶甲Diabrotica barberi Smith & Lawrence(同源性90%)(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi#743172760)。显示该检测技术完全可以用于口岸进境植物检疫中玉米根萤叶甲的检测。
目前,基于分子生物学的叶甲类昆虫识别鉴定技术研究时有报道,如RFLP(restriction fragment length polymorphism)技术[2627]、基于mtDNA COⅠ单基因[28]和mtDNA COⅠ/rDNA ITS2联合基因[29]的条形码技术、实时荧光PCR技术[30]等。然而,这些技术各具优缺点,比如RFLP技术操作较为繁琐且需要酶切,对DNA的需求量也比较大;DNA条形码技术需要对PCR产物进行回收纯化、序列测定及比对分析;实时荧光PCR技术所需要的仪器设备较为昂贵、应用受限。种特异性SSCOⅠ技术由基于多拷贝的mtDNA COⅠ基因标记技术发展而来,具有特异性强、操作简便、检测灵敏度高,与实时荧光PCR技术的检测灵敏度相当[30],以及谱带单一、结果直观、重复性能好等诸多优点,完全可以用于大规模快速检测分析[31]。
参考文献
[1]KRYSAN J L, SMITH R F. Systematics of the Virgifera species group of Diabrotica (Coleoptera: Chrysomelidae: Galerucinae)[J]. Entomography, 1987, 5: 375484.
[2]MEINKE L J, SAPPINGTON T W, ONSTAD D W, et al. Western corn rootworm (Diabrotica virgifera virgifera LeConte) population dynamics [J]. Agricultural and Forest Entomology, 2009, 11: 2946.
[3]中华人民共和国农业部和国家质量监督检验检疫总局. 中华人民共和国进境植物检疫性有害生物名录(共435种),农业部公告第862号[EB/OL]. 20070528.http:∥www.moa.gov.cn/govpublic/ZZYQLS/201006/t201.
[4]CHIANG H C. Bionomics of the northern and western corn rootworms [J].Annual Review of Entomology,1973,18:4772.
[5]KRYSAN J L, MILLAR T A. Methods for the study of pest Diabrotica [M]. SpringerVerlag New York Inc, 1986: 260.
[6]LEVINE E, OLOUMISADEGHI H. Management of Diabroticite rootworms in corn [J].Annual Review of Entomology, 1991, 36: 229255.
[7]BRANSON T F, ORTMAN E E. Host range of larvae of western corn rootworm [J]. Journal of Economic Entomology, 1967, 60: 201203.
[8]BREITENBACH S, HEIMBACH U, GLOYNA K, et al. Possible host plants for larvae of western corn rootworm (Diabrotica virgifera virgifera)[J]. BCPC Symposium Proceedings, 2005, 81: 217218.
[9]CABI. Diabrotica virgifera virgifera (western corn rootworm)[EB/OL]. (20170622)[20180118]. http:∥www.cabi.org/isc/datasheet/18637.
[10]GRAY M E, SAPPINGTON T W, MILLER N J, et al. Adaptation and invasiveness of western corn rootworm: Intensifying research on a worsening pest [J]. Annual Review of Entomology, 2009, 54: 303321.
[11]SPENCER J L, HIBBARD B E, MOESER J, et al. Behaviour and ecology of the western corn rootworm (Diabrotica virgifera virgifera LeConte) (Coleoptera: Chrysomelidae)[J]. Agricultural and Forest Entomology, 2009, 11: 927.
[12]MCBRIDE D K. Corn rootworm control trials1971 [J]. North Dakota Farm Research, 1972, 29: 913.
[13]SPIKE B P, TOLLEFSON J J. Yield response of corn subjected to western corn rootworm (Coleoptera: Chrysomelidae) infestation and lodging [J].Journal of Entomology,1991,84(5):15851590.
[14]WESSELER J, FALL E H. Potential damage costs of Diabrotica virgifera virgifera infestation in Europethe ‘no control scenario [J]. Journal of Applied Entomology, 2010, 134(5): 385394.
[15]JENSEN S G. Laboratory transmission of maize chlorotic mottle virus by three species of corn rootworms [J].Plant Disease, 1985, 69(10): 864868.
[16]ONSTAD D W, CRWODER D W, ISARD S A, et al. Does landscape diversity slow the spread of rotationresistant western corn rootworm (Coleoptera: Chrysomelidae)?[J]. Environmental Entomology, 2003, 32(5): 9921001.
[17]BACA F. New member of the harmful entomofauna of Yugoslavia Diabrotica virgifera virgifera LeConte (Coleoptera, Chrysomelidae)[J]. Zastita Bilja, 1994, 45(2): 125131.
[18]GERGINOV L, TOMOV N. The western corn rootwormDiabrotica virgifera virgifera LeConte (Coleoptera: Chrysomelidae)a new quarantine pest of maize [J].Rastenievdni Nauki, 1995, 32(9/10): 159160.
[19]KISS J, EDWARDS C R, BERGER H K, et al. Monitoring of western corn rootworm (Diabrotica virgifera virgifera LeConte) in Europe 19922003 [M]∥VIDAL S, KUHLMANN U, EDWARDS C R. Western Corn Rootworm: Ecology and Management, 2005: 2939.
[20]BAUFELD P, ENZIAN S.Maize growing, maize highrisk areas and potential yield losses due to western corn rootworm (Diabrotica virgifera virgifera) damage in selected European countries [M]∥VIDAL S, KUHLMANN U, EDWARDS C R. Western Corn Rootworm: Ecology and Management. Wallingford, UK: CAB International, 2005: 285302.
[21]江幸福,罗礼智.玉米切根叶甲入侵我国的定性与定量风险分析[C]∥成卓敏.植物保护与现代农业——中国植物保护学会2007年学术年会论文集.北京:中国农业科学技术出版社,2007: 4147.
[22]张俊华, 马菲, 曹逸霞, 等. 玉米根萤叶甲在中国的潜在适生区域与检疫措施研究[J]. 植物检疫, 2009, 23(6): 912.
[23]KRYSAN J L, SMITH R F, BRANSON T F,et al. A new subspecies of Diabrotica virgifera (Coleoptera: Chrysomelidae): description, distribution, and sexual compatibility [J]. Annals of the Entomological Society of America, 1980, 73(2): 123130.
[24]SUNNUCKS P, HALES D F. Numerous transposed sequences of mitochondrial cytochrome oxidase III in Aphids of the genus Sitobion (Hemiptera: Aphididae)[J]. Molecular Biology and Evolution, 1996, 13(3): 510524.
[25]FOLMER O, BLACK M, HOEH W, et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates [J]. Molecular Marine Biology and Biotechnology, 1994, 3(5): 294299.
[26]SZALANSKI A L, POWERS T O. Molecular diagnostics of three Diabrotica (Coleoptera: Chrysomelidae) pest species [J].Journal of the Kansas Entomological Society,1996,69(3):260266.
[27]CLARK T L, MEINKE L J, FOSTER J E. PCRRFLP of the mitochondrial cytochrome oxidase (subunit I) gene provides diagnostic markers for selected Diabrotica species (Coleoptera: Chrysomelidae)[J]. Bulletin of Entomological Research, 2001, 91(6): 419427.
[28]席欧彦, 李晓, 郑飞,等. 楊树萤叶甲DNA条形码研究[J]. 新疆农业科学, 2016, 53(2): 309316.
[29]CLARK T L, MEINKE L J, FOSTER J E. Molecular phylogeny of Diabrotica beetles (Coleoptera: Chrysomelidae) inferred from analysis of combined mitochondrial and nuclear DNA sequences [J].Insect Molecular Biology,2001,10(4):303314.
[30]雍容婧,李志红,陈宏,等.3种根萤叶甲实时荧光PCR检测技术研究[J].植物检疫,2017,31(5):3843.
[31]张桂芬,刘万学,郭建英,等.美洲斑潜蝇SSPCR检测技术研究[J].生物安全学报,2012,21(1):7478.
(责任编辑:田喆)

