DCLK1敲除对食管鳞癌细胞迁移和侵袭能力的影响
范晓娜 姚健楠 葛 洋 安广宇 李 鹰*
(1.首都医科大学附属北京朝阳医院医学研究中心,北京 100020; 2.首都医科大学附属北京朝阳医院肿瘤科,北京 100020 )
食管癌(esophageal cancer,EC)是世界上最常见的恶性肿瘤之一,其病死率位居全球消化道肿瘤相关病死率的第6位[1]。根据病理分型,食管癌可以分为食管腺癌(esophageal adenocarcinoma,EAC)和食管鳞癌(esophageal squamous cell carcinoma,ESCC)[2]。在亚洲地区,食管鳞癌为主要的病理类型,约占食管癌诊断的90%以上[3-4]。目前虽然在内窥镜检查/手术,化学药物治疗和放射治疗中已经取得了显著的进展,但食管鳞癌的5年存活率仍然很低,仅为15%~25%[5]。因此,寻找食管鳞癌侵袭和转移的分子标志物,对于食管鳞癌的治疗尤为重要。
双皮质素样激酶1(doublecortin-like kinase 1,DCLK1)是一种微管相关蛋白激酶,属于蛋白激酶超家族和双皮质素家族的成员[6]。目前被认为是结肠癌和胰腺癌中特异性的肿瘤干细胞标志物[7-9]。在许多研究[10-11]中已经报道了DCLK1的高表达,如结肠癌,胰腺癌[12-13]和食管腺癌[14]。近年来,DCLK1作为肿瘤治疗的潜在靶点引起了广泛的关注。靶向DCLK1的小分子激酶抑制剂已被证明可有效对抗体内胃肠肿瘤[15]。重要的是,DCLK1也被证明是某些肿瘤的潜在诊断和预后因素[16-18]。然而,作为一个重要的肿瘤干细胞标志物及潜在的临床治疗靶点,DCLK1在人类食管鳞癌中的潜在作用知之甚少。本研究初步证明了DCLK1在人食管鳞癌中的潜在生物学作用,这可为人类食管鳞癌中分子靶向治疗的开发和应用提供新思路。
1 材料与方法
1.1 实验材料
RPMI 1640培养基、高糖DMEM培养基、胰蛋白酶、胎牛血清和嘌呤霉素购自美国Gibco公司;载体lentiCRISPR v2来自于中国医科学院肿瘤医院;大肠杆菌感受态细菌stbl3为本实验室保存;质粒pMD2.G和psPAX2购自美国Addgene公司;BsmBI限制酶购买自New England Biolabs公司;Matrigel胶购自美国BD公司;RNA抽提试剂Trizol和LipofectamineTM3000 试剂盒购自美国Invitrogen公司,、PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒、SYBR©Premix Ex TaqTMⅡ荧光定量 RT-PCR试剂盒购自日本Takara公司,引物合成和测序均由上海生工公司完成;RIPA蛋白裂解液、蛋白抑制剂、PMSF和5×蛋白上样缓冲液均购自上海碧云天生物技术有限公司,PVDF膜和辣根过氧化物酶化学发光底物购自美国Millipore公司;DCLK1抗体购自美国Abcam公司,其余一抗均购自美国CST公司,辣根过氧化物酶标记的山羊抗兔或抗鼠IgG二抗均购自北京中杉金桥生物技术有限公司。
1.2 细胞培养
人食管鳞癌细胞系(Kyse410、Kyse450、Kyse510和Kyse70)和HEK293T细胞均来自中国医学科学院肿瘤医院。所有食管鳞癌细胞用含10%(体积分数)胎牛血清和1%(体积分数)青-链霉素双抗的RPMI 1640培养基培养,HEK293T细胞用含10%(体积分数)胎牛血清和1%(体积分数)青-链霉素双抗的高糖DMEM培养基培养,于37 ℃ 和5%(体积分数)CO2的培养箱中培养,常规换液传代。
1.3 构建DCLK1-sgRNA表达载体
特异性靶向DCLK1的sgRNA序列如下:Oligo1:5′-CACCGGAGTAGAGAGCTGACTACCA-3′,Oligo2:5′-AAACTGGTAGTCAGCTCTCTACTCC-3′。使用BsmBI限制酶消化lentiCRISPR v2载体,并与含有双链sgRNA的黏性末端连接。将连接产物转化stbl3感受态细菌,并在含有氨苄青霉素的平板培养基上筛选,挑取单克隆测序验证。
1.4 构建稳定敲除DCLK1的食管鳞癌细胞系
使用Lipofectamine 3000将上述构建的DCLK1-sgRNA表达质粒和lentiCRISPR v2空载质粒分别与包装质粒pMD2.G、psPAX2共转染到HEK293T细胞中。在转染后48 h和72 h收取上清液,并用0.45 μm过滤器过滤病毒。用病毒感染食管鳞癌细胞,并用2 μg/mL嘌呤霉素筛选以获得稳定的细胞系。扩增细胞用于后续实验。
1.5 总RNA提取和qRT-PCR检测
Trizol法提取食管鳞癌细胞总RNA,根据PrimeScript反转录试剂盒说明书取1 μg RNA反转录成cDNA。反转录体系为20 μL,反应条件为37 ℃ 15 min,85 ℃ 5s,-20 ℃保存。使用GAPDH作为内参进行qRT-PCR,体系为20 μL,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。实验重复3次,通过2-ΔΔCT方法计算基因相对表达量。所需引物序列如下:DCLK1-F: 5′-CGGTCCACATGCAATAAAAA-3′,DCLK1-R: 5′-GATATCACCGATGCCATCAAG-3′;GAPDH-F: 5′-AATCCCATCACCATCTTCCA-3′,GAPDH-R: 5′-TGGACTCCACGACGTACTCA-3′。
1.6 蛋白提取和Western blotting法检测
待细胞生长状态良好且密度达到80%~90%左右时,弃去原有培养基,用4 ℃预冷磷酸盐缓冲液(phosphate buffered solution,PBS)缓冲液清洗2次,并吸尽培养瓶中残留的PBS。吸干后加入新配制的细胞裂解液(1 mL RIPA+10 μL PMSF+10 μL蛋白酶抑制剂)提取细胞总蛋白,并通过BCA法测定总蛋白浓度。取40 μg蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,经半干转转至PVDF膜上,5%(质量分数)脱脂奶粉中封闭1 h后,孵育一抗并4 ℃过夜。用TBST洗膜3次,每次5 min,室温孵育二抗1 h,TBST洗膜3次,最后凝胶成像系统曝光并分析结果。
1.7 划痕愈合实验
将DCLK1敲除组(DCLK1-KO)和对照(Control)细胞悬液分别接种在6孔板中。当细胞汇合达到约80%~90%时,使用200 μL移液枪头垂直底面划线,PBS洗去划下细胞,然后将细胞在不含胎牛血清的1640培养基中培养。分别在0、6、24、48 h以4倍放大率拍摄图像。使用Image J软件测量相同位置处的划痕的空白区域。
1.8 Transwell实验
Matrigel以1∶8稀释并铺于Transwell小室底部的上室面,置于37 ℃培养箱2 h,随后,将不含血清的DCLK1-KO和Control组的细胞悬液分别接种到上室中(105/孔),将含有10%(体积分数)胎牛血清的细胞培养基加入到每个孔的底部。培养24 h后,取出小室,弃去孔中培养基,甲醇固定20 min,0.1%(质量分数)结晶紫染色20 min,干燥后,于10×放大倍数下各选5个视野计数。
1.9 TCGA食管鳞状细胞癌数据
通过UCSC癌症基因组浏览器(http://xena.ucsc.edu)下载癌症基因组图谱(The Cancer Genome Atla,TCGA)数据集中的196名食管癌患者(2017-10-13版)的临床和基因表达信息。Corrplot函数(R package corrplot)用于证实DCLK1和其他基因的表达水平之间的相关性。
1.10 统计学方法
2 结果
2.1 构建稳定敲除DCLK1的食管鳞癌细胞系
利用qRT-PCR和Western blotting分别检测4种食管鳞癌细胞系(Kyse450、Kyse70、Kyse410、Kyse510)中DCLK1的基础表达水平。两项结果显示,Kyse450和Kyse70细胞系中DCLK1的mRNA和蛋白水平均高于Kyse510和Kyse410(图1)。因此,Kyse450和Kyse70两株细胞用于进行DCLK1敲除实验的研究。质粒测序结果证实sgRNA成功插入DCLK1-sgRNA表达载体中(图1C),可用于后续实验。Western blotting验证DCLK1敲除效果,结果显示,与对照组(Control)相比,Kyse450-KO和Kyse70-KO细胞中DCLK1蛋白明显减少(图1D)。

图1 构建DCLK1敲除的食管鳞癌细胞系Fig.1 Construction of DCLK1 knockout esophageal squamous cell carcinoma (ESCC) cell lines
A: DCLK1 mRNA expression in four ESCC cell lines (Kyse410, Kyse450, Kyse510, Kyse70);B: DCLK1 protein expression in four ESCC cell lines;C: Sequencing results of DCLK1-sgRNA expression vector;D: Western blotting analysis ofDCLK1 knockout effect in Kyse450 and Kyse70 cells.***P<0.001.DCLK1:doublecortin-like kinase 1;DCLK1-KO:DCLK1 knockout.
2.2 划痕实验检测DCLK1敲除对食管鳞癌细胞迁移能力的影响
在Kyse450细胞中,DCLK1-KO组细胞在6、24 h和48 h的划痕愈合速率分别为15.20%、38.30%和54.60%,对照组的愈合率为46.60%、77.70%和100.00%。Kyse70细胞的DCLK1-KO组在6 h,24 h和48 h的划痕愈合速率分别为2.90%、5.50%和9.30%,相应的对照组愈合率为10.50%、17.00%和28.60%。两种细胞的统计学分析显示,与对照组相比,DCLK1-KO组细胞划痕愈合率均明显降低(t=22.742,P<0.01;t=22.901,P<0.01;t=30.267,P<0.01)(t=14.113,P<0.01;t=14.880,P<0.01;t=21.875,P<0.01)(图2)。
2.3 Transwell实验检测DCLK1敲除对食管鳞癌细胞迁移、侵袭能力的影响
在无Matrigel胶的小室中,Kyse450和Kyse70细胞的DCLK1-KO组穿出的细胞数分别为180.00±16.97和205.50±10.61,均明显少于相应的对照组穿出细胞数515.50±27.58和437.50±17.68,DCLK1敲除可显著抑制食管鳞癌细胞的迁移能力(t=14.653,P<0.01;t=15.915,P<0.01)(图3A),这与划痕实验结果一致。侵袭实验结果显示,Kyse450和Kyse70细胞的DCLK1-KO组细胞侵袭数分别为158.50±12.02和121.00±12.73,显著低于相应的对照组细胞侵袭数345.00±15.56和416.00±9.89,差异有统计学意义(t=13.416,P<0.01;t=25.873,P<0.01)(图3B)。

图2 DCLK1敲除对食管鳞癌细胞迁移能力的影响Fig.2 Effect of DCLK1 knockout on migration ability of esophageal squamous carcinoma (ESCC) cells

图3 DCLK1敲除对食管鳞癌细胞迁移和侵袭能力的影响Fig.3 Effect of DCLK1 knockout on migration and invasion ability of esophageal squamous carcinoma (ESCC) cells
A: effect ofDCLK1 knockout on migration ability of esophageal squamous carcinoma cells;B: effect ofDCLK1 knockout on invasion ability of esophageal squamous carcinoma cells.**P<0.01.DCLK1:doublecortin-like kinase 1;DCLK1-KO:DCLK1 knockout.
2.4 Western blotting法检测DCLK1敲除对食管鳞癌细胞EMT的影响
两种食管鳞癌细胞的DCLK1敲除均显著上调了上皮指标E-cadherin蛋白的表达(t=6.559,P<0.05;t=4.860,P<0.05),而降低了间质指标如ZEB1、Snail和Slug的表达水平(t=9.204,P<0.05;t=23.781,P<0.01;t=13.892,P<0.01),另外在Kyse450细胞中Vimentin蛋白降低(t=7.938,P<0.05)(图4)。
2.5 TCGA数据库分析食管鳞癌患者中DCLK1与EMT相关转录因子的相关性
进一步分析了TCGA数据库并检查了食管鳞癌患者中DCLK1表达与EMT相关转录因子之间的相关性,DCLK1表达与间质标志物ZEB1、ZEB2、Vimentin、FN1、CDH2、Snail、Slug和Twist1和Twist2呈正相关(红色),但与CDH1、CLDN4、CLDN7、MUC1和TJP3等上皮标志物呈负相关(图5)。

图4 DCLK1敲除对食管鳞癌细胞上皮-间质转化的影响Fig.4 Effect of DCLK1 knockout on epithelial-mesenchymal transition of esophageal squamous carcinoma cells
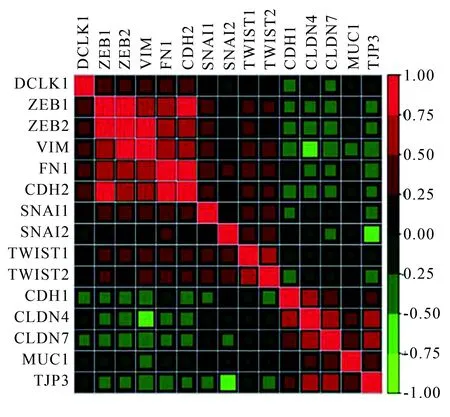
图5 DCLK1与上皮-间质转化相关转录因子的数据库分析Fig.5 Relationship between DCLK1 and epithelial-mesenchymal transition associated transcription factors
Red: positive correlation;Green: negative correlation;DCLK1:doublecortin-like kinase 1.
3 讨论
在我国,食管鳞癌占比高达97%以上[4]。作为一种我国的高发肿瘤,食管鳞癌发生、发展机制的研究具有很大的临床价值。近年来,靶向治疗以其对癌细胞的特异性在肿瘤治疗中的地位变得越来越重要。肿瘤干细胞标志物DCLK1已被证实在多种肿瘤中表达上调,并且直接参与肿瘤的转移调控。本研究初步探索了DCLK1对食管鳞癌细胞生物学行为的影响,通过CRISPR/Cas9基因编辑技术靶向敲除DCLK1后,观察到食管鳞癌细胞的迁移和侵袭能力明显降低,提示DCLK1可能是参与食管鳞癌细胞侵袭转移的一个重要因子。
Chandrakesan等[19]的研究显示,敲减DCLK1可减少结肠息肉、腺瘤和腺癌的数量和体积,提示DCLK1与结肠癌发生、发展密切相关。此外,大量的研究[12-13]表明,敲除DCLK1不仅能够抑制体外和体内细胞的生长,而且显著抑制胰腺癌细胞和肾癌细胞[20]的迁移和侵袭。这些结果证明了DCLK1在多种肿瘤的转移过程中发挥重要作用。研究[18]显示,上皮-间质转化(epithelial-mesenchymal transition,EMT)在促进食管鳞癌的侵袭和转移中起重要作用。因此,笔者推测DCLK1可能通过调节EMT进程影响食管鳞状细胞癌的侵袭和转移。之后,对EMT相关转录因子的蛋白质印迹分析验证了这一假设,本研究结果显示随着DCLK1的敲除,间质标志物如Vimentin、ZEB1、Slug和Snail的表达减少,而上皮标志物E-cadherin的表达增加。此外,TCGA数据库分析结果显示,DCLK1表达与间质标志物ZEB1、ZEB2、Vimentin、FN1、CDH2、Snail、Slug和Twist1和Twist2呈正相关,但与CDH1、CLDN4、CLDN7、MUC1和TJP3等上皮标志物呈负相关,这与本研究结果一致。这些发现表明DCLK1可通过诱导EMT促进食管鳞癌肿瘤发生。
CRISPR/Cas9系统是一项新兴的基因编辑技术,以其简单、高效和多功能性在体外和体内都获得了广泛的认可,并成功应用于编辑人类基因组[21-22]。本实验基于CRISPR/Cas9基因编辑技术获得了稳定敲除DCLK1的食管鳞癌细胞系,为进一步探索DCLK1在食管鳞癌进展中分子机制提供了坚实的基础。
尽管目前对DCLK1的研究逐步深入,但本研究结果初步证明了DCLK1在食管鳞癌中的生物学作用,这是第一次证明DCLK1可能作为食管鳞癌中EMT信号传导的调节因子,为临床食管鳞癌治疗提供了一个新的思路。另外,仍需进一步深入探讨DCLK1影响EMT进程的分子机制。

