杨梅黄酮对环磷酰胺诱导雄性小鼠生精障碍的试验
(吉林医药学院,吉林吉林 132013)
环磷酰胺(Cyclophosphamide,CTX)是周期非特异性抗肿瘤药,对多发性骨髓瘤、急性淋巴细胞白血病、淋巴瘤[1]、卵巢癌、乳腺癌等有效。在临床应用中发现其对男性生殖系统有损伤作用并对后代存在潜在致畸风险,常作为少精症和弱精症模型的诱导剂,它在杀伤肿瘤细胞的同时,会导致机体生精障碍,是制备生精障碍动物模型的理想药物[2-3]。杨梅黄酮(Myricetin,M)别名杨梅素,是杨梅科杨梅属植物杨梅的主要成分。研究显示,杨梅黄酮具有降糖、抗炎[4]、抗肿瘤[5-6]、抗帕金森病[7]、抗疲劳等多种作用。但杨梅黄酮对环磷酰胺诱导小鼠生殖功能障碍拮抗作用的研究并不多,研究杨梅黄酮改善环磷酰胺化疗引起的生殖功能障碍具有重要的理论与实际意义。本试验通过对环磷酰胺所致生精障碍的雄性小鼠给予不同剂量的杨梅黄酮灌胃30 d,探讨杨梅黄酮对雄性小鼠生殖功能的作用及作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康ICR 小鼠,SPF 级,雄性,18~22 g,由长春市亿斯实验动物技术有限公司提供,动物许可证号SCXK(吉)2016 -0003。
1.1.2 药品试剂 杨梅黄酮(质量分数98%),批号:WZ16025,西安万滋生物科技有限公司;环磷酰胺(质量分数≥98%),北京华迈科生物技术有限公司,批号:CO79504;甲睾酮,天津力生制药股份有限公司,批号:1 602003;乳酸脱氢酶(LDH)、核因子κb(NF-κb)、肿瘤坏死因子α(TNF -α)ELISA 试剂盒,上海恒远生物科技有限公司,批号:H18Y11;MDA、微量还原型谷胱甘肽(GSH)试剂盒,南京建成生物工程公司,批号:20 180412;Bradford 蛋白浓度测定试剂盒,上海碧云天试剂公司。
1.3 仪器 SC -3612 低速离心机,安徽中科中佳科学仪器有限公司;T10 分散机(basic ULTRA -TURRAX),德国IKA 公司;HPX -9272MBE 电热恒温培养箱,上海博讯实业有限公司医疗设备厂;722可见分光光度计,上海欣茂仪器有限公司产品;BioTek ELX800 酶标仪,美国博腾仪器有限公司;DP80 型激光共聚焦显微镜,日本Olympus 公司。
1.2 方法
1.2.1 试验分组和给药 小鼠72 只,体重18~22 g,随机分为6 组:对照组、模型组、杨梅黄酮低、中、高剂量组(ML 组、MM 组、MH 组)、甲睾酮组(T组,10 mg/kg·d),每组12 只。除对照组,各组均腹腔注射环磷酰胺(Cyclophosphamide,CTX)50 mg/kg·d,连续7 d,对照组同时给予等体积生理盐水腹腔注射,杨梅黄酮组及甲睾酮组自造模2 d开始灌胃给药,杨梅黄酮组给药剂量为100、200、400 mg/kg·d,每天1 次,连续30 d,对照组和模型组每日灌胃等体积的0.25%羧甲基纤维素钠溶液。
末次给药后禁食不禁水24 h,小鼠称体重(BW)后10%水合氯醛(0.3 mL/kg·bw)麻醉,快速取双侧睾丸和附睾,剥除粘连的血管、韧带及脂肪等组织,迅速用分析天平称质量、记录睾丸湿质量,称重后留做组织均浆。腹主动脉取血,留血清备用。每组随机挑取小鼠2 只,颈椎脱臼处死之后取出睾丸,4%多聚甲醛固定24 h,常规石蜡包埋,切片备用,用于H.E.染色。
1.2.2 精子密度检查(血细胞计数板法) 取双侧附睾迅速置于37.0 ℃2 mL 生理盐水中,探针充分剥离附睾后,于37.0 ℃恒温箱中孵育15 min,使精子游出。4 层擦镜镜纸过滤,得稀释的精液。取上述精液100 μL 加3%NaCl 100 μL,混匀后取1 滴滴在盖玻片的边缘(血细胞计数板上),精液自行渗入,静置1~2 min 后,于400 倍光学显微镜下按红细胞计数法计精子数。对于压线精子的计数是数头不数尾,数上不数下,数左不数右。
1.2.3 精子畸变试验 取精液1 滴于载玻片上涂片。自然干燥后,再甲醇固定5 min 以上至干燥。用1%伊红染色1 h,用水轻冲多余染剂,干燥。置于镜下统计精子畸变数目,每张片子计数1 000 个精子。为了减少误差,对同一个样品应进行2 次精子数量检查,求其平均数。
1.2.4 血清GSH 含量的检测 取血清,严格按试剂盒说明用酶标仪检测血清中GSH 含量。
1.2.5 睾丸组织MDA、TNF -α、NF -kb 含量及LDH 活性的测定 取睾丸组织,用生理盐水在冰浴下制成10% 组织匀浆,4 ℃,4 000 r/min 离心15 min,取上清液严格按试剂盒说明书(采用硫代巴比妥酸法)测定MDA 含量,检测组织蛋白含量采用考马斯亮蓝法测定。取10%小鼠睾丸组织匀浆,严格按照试剂盒说明用酶标仪测定TNF -α 及NF -κb 含量。取10%睾丸组织匀浆上清液稀释为1%,严格按照试剂盒说明书测定LDH 水平。
1.2.6 睾丸H.E.染色 将睾丸于4%多聚甲醛固定24 h,常规石蜡包埋,切片备用,用于H.E.染色,光学显微镜下观察,并拍照。
2 结果
2.1 杨梅黄酮对CTX 诱导生精障碍小鼠的精子密度及精子畸变率的影响 结果显示,与对照组比较,模型组小鼠精子密度明显下降、精子畸形率显著增加(P<0.01),说明CTX 影响小鼠的精子生成过程,精子的形成和成熟受到干扰。各剂量杨梅黄酮、甲睾酮处理后,精子密度增加,且精子畸形率降低,杨梅黄酮中、高剂量组及甲睾酮组与模型组比较具有统计学差异(P<0.05 或P<0.01)。可见杨梅黄酮对CTX 所致雄性小鼠生殖毒性有改善作用,见图1、图2。

图1 杨梅黄酮小鼠精子密度的影响
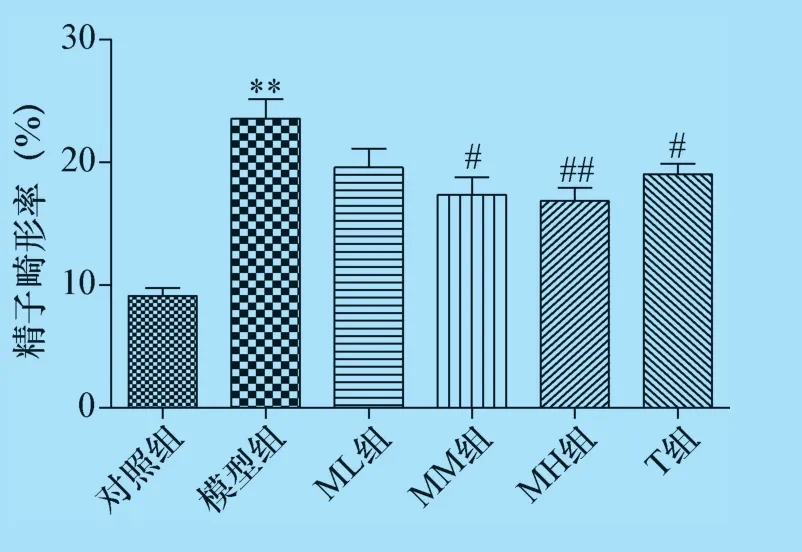
图2 杨梅黄酮对小鼠精子畸形率的影响
2.2 杨梅黄酮对CTX 诱导生精障碍的小鼠血清中GSH 及睾丸组织中MDA、LDH 水平的影响 结果显示,与对照组比较,模型组小鼠血清中GSH 含量降低、睾丸组织中MDA 含量显著性增高,睾丸组织中LDH 活性降低(P<0.05 或P<0.01),说明CTX 对小鼠生殖系统引起氧化应激损伤,从而影响了精子生成功能酶的活性,同时可见中、高剂量的杨梅黄酮治疗后血清中GSH 含量增高,各剂量的杨梅黄酮治疗后睾丸组织MDA 含量降低、LDH 活性增高,与模型组比较有统计学差异(P<0.05 或P<0.01),说明杨梅黄酮有一定的清除氧自由基、抗氧化作用,见图3、图4、图5。
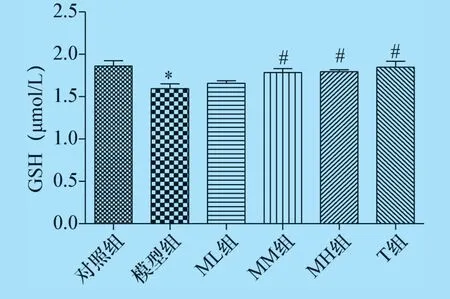
图3 杨梅黄酮对小鼠血清GSH 含量的影响

图4 杨梅黄酮对小鼠睾丸组织MDA 含量的影响
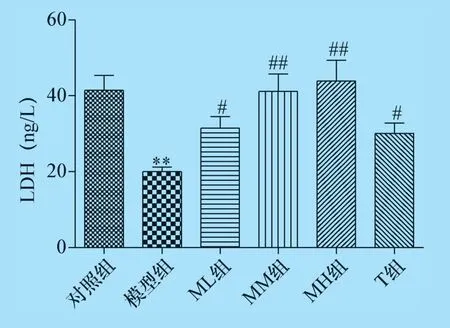
图5 杨梅黄酮对小鼠睾丸组织MDA 含量的影响
2.3 杨梅黄酮对CTX 诱导生精障碍的小鼠睾丸组织中TNF -α 及NF -κB 含量的影响 结果表明,模型组小鼠睾丸组织中TNF -α 及NF -κB 含量高于对照组(P<0.05 或P<0.01);与模型组比较,杨梅黄酮中、高剂量组及甲睾酮组睾丸组织中TNF-α及NF-κB 含量减少,杨梅黄酮中、高剂量组及甲睾酮组与模型组比较具有统计学差异(P<0.05 或P<0.01),见图6、图7。
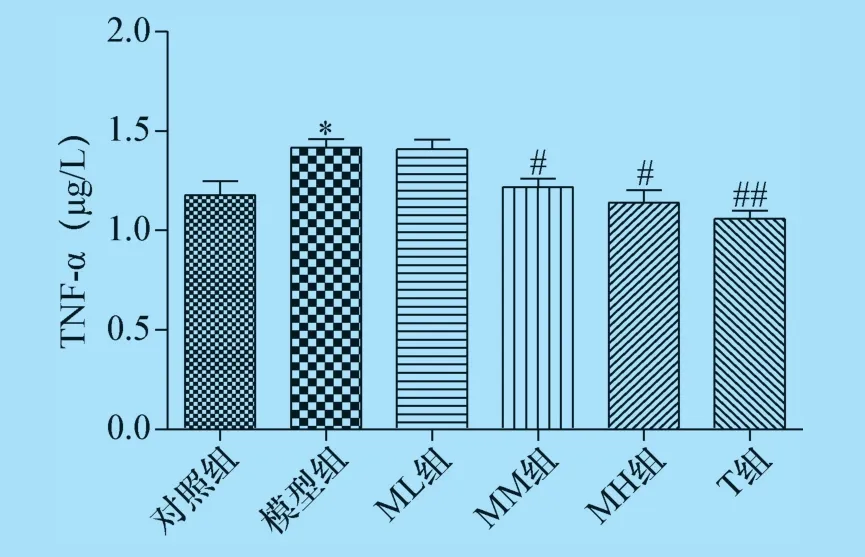
图6 杨梅黄酮对小鼠睾丸组织TNF-α 含量的影响
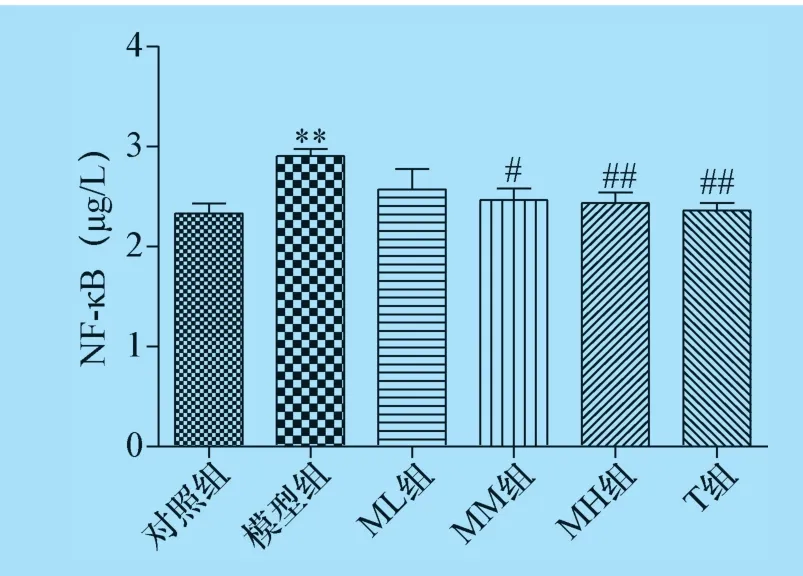
图7 杨梅黄酮对小鼠睾丸组织NF-κB 含量的影响
2.4 杨梅黄酮对CTX 诱导生精障碍的小鼠睾丸组织病理改变的影响 H.E.染色睾丸组织切片:对照组睾丸生精小管排列密集,生精上皮厚,生精细胞层次和数量多,生精小管腔均见精子形成;与对照组比较,模型组睾丸多数生精小管直径明显变细,间距较宽,生精上皮明显变薄,生精细胞层次和数量减少,多数生精小管腔未见精子形成,管腔内可见脱落的生精细胞;与模型组比较,杨梅黄酮给药组、甲睾酮组生精上皮增厚,生精细胞层次和数量明显增多,以杨梅黄酮高剂量组尤为明显(见中插彩版图8)。
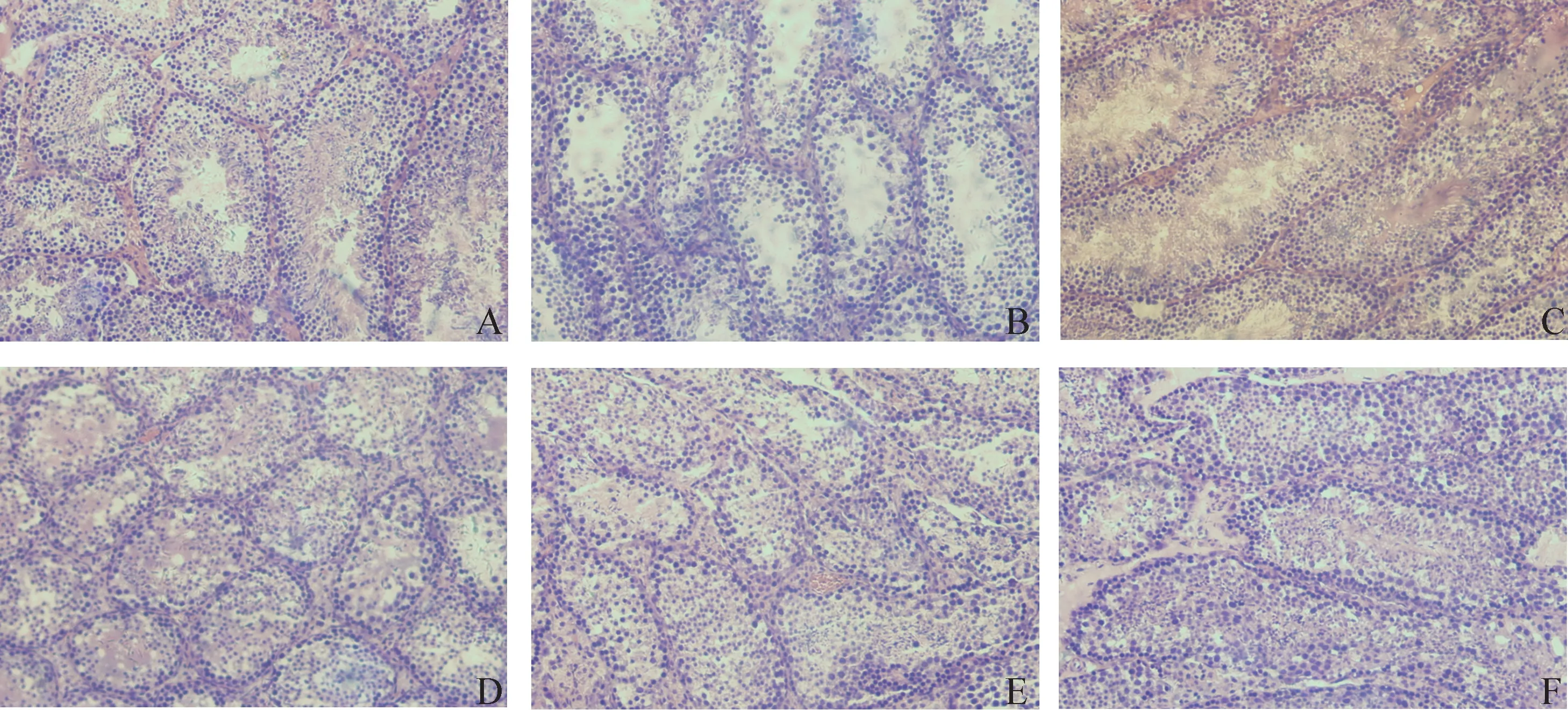
图8 睾丸组织结构变化 (H.E.染色,100 ×)
3 讨论
环磷酰胺(Cyclophosphamide,CTX) 属于烷化剂,可以与DNA 形成交联,抑制DNA 合成,从而抑制细胞增殖而发挥抗肿瘤作用。目前研究认为,环磷酰胺致生精功能损害的机制可能是环磷酰胺经肝微粒体P450 酶系代谢生成有毒的亲电子物质如丙烯醛、4 -羟化物和氯乙醛,这些产物导致自由基清除酶活性下降,造成自由基蓄积,影响类固醇激素合成酶的活性,并引起脂质过氧化反应,使细胞膜结构破坏,造成生殖细胞损伤,使精子微环境发生改变。因此寻找与开发可有效地防治氧化应激造成的生殖细胞损伤的天然化合物,延缓生精功能损伤成为共识。杨梅黄酮(Myricetin)是从杨梅科属植物的叶、皮及根中提取出来的一种黄酮类化合物,临床上可用于消炎、抗氧化、止痛、降低血糖和保护肝脏等多种治疗。由于其丰富的资源优势和巨大的潜在药用价值,目前已有多种杨梅黄酮保健品上市。杨梅黄酮属于多酚类天然化合物,研究表明其具有抗肿瘤、抗炎、抗氧化、延缓衰老和保护心血管系统等多种药理作用。因杨梅黄酮结构中具有多个酚羟基而具有天然抗氧化活性之功效。本课题组研究发现药物杨梅黄酮在保护生精功能方面也有明显的效果[8]。目前有关杨梅黄酮在环磷酰胺诱导的小鼠生精障碍的保护作用及机制还未见报道。本试验采用腹腔注射50 mg/kg·bw 环磷酰胺连续7 d 建立生精障碍动物模型,然后给予杨梅黄酮进行干预和研究。
乳酸脱氢酶(LDH)是生精细胞糖代谢功能的主要酶,LDH 的活性与生精上皮成熟及精子活动、获能及受精密切相关,是评价生精能力的重要指标[9]。还原型谷胱甘肽(GSH)可以非酶促反应的形式直接与氧自由基结合,达到清除氧自由基的目的,是抗氧化系统中的关键成分。脂质过氧化产物丙二醛(MDA)是反映机体内活性氧水平的较好指标,活性氧对生殖细胞引起的氧化应激损伤,破坏精子质膜的流动性,引起睾丸间质细胞受损伤和精子生成异常,从而使生精功能减弱及精子质量下降[10]。研究结果发现给予杨梅黄酮预防治疗后,精子密度升高,且精子畸形率降低,睾丸组织中LDH、GSH 水平增高、MDA 含量降低,杨梅黄酮组睾丸组织病理与模型组比较,生精上皮增厚,生精细胞层次和数量明显增多,由此可见,杨梅黄酮可通过抗氧化作用改善生精功能,对环磷酰胺所致的生精障碍具有防治作用。
氧化应激和炎性反应密切相关,氧化应激可触发多种调控细胞内炎性因子的信号通路,诱发炎症反应。肿瘤坏死因子-α(TNF -α)主要由巨噬细胞分泌,作为活性氧(ROS)和活性氮(RNS)生成调节因子,在炎症反应、免疫反应、平衡细胞存活与细胞凋亡中起着重要作用[11]。核因子(NF -κB)是一种参与免疫反应、炎症、胚胎发育、组织损伤修复相关的基因表达重要的基因调控因子,正常情况下,NF-κB 以无活性的三聚体形式(p50、p65 及抑制因子IκB)存在细胞质中,当细胞受到TNF -α、IL -1β及内毒素等刺激时,IκB 被降解后NF-κB 与IκB 发生解离而激活,活化的NF -κB 进入细胞核中发挥生物学作用,其会导致多种自身免疫性疾病如类风湿性关节炎[12]、动脉硬化、炎性肠病等。本试验模型组小鼠睾丸组织中TNF -α 及NF -κb 含量高于对照组,同时杨梅黄酮中、高剂量组睾丸组织中TNF-α及NF -κb 含量减少,与模型组比较具有统计学差异。说明杨梅黄酮具有抗炎作用,杨梅黄酮可能通过抗氧化作用阻止生殖细胞的脂质过氧化,进而发挥抗炎作用,保护活性氧引起的生殖细胞氧化损伤。
综上所述,杨梅黄酮通过抗氧化及抗炎作用而对环磷酰胺所致的小鼠生精损伤发挥保护作用,其在临床开发对CTX 化疗引起生精障碍具有防治作用的药物具有一定的理论依据,但有关杨梅黄酮保护生殖功能的具体细胞信号转导机理还需进一步探讨。

