丙硫氧嘧啶引起肺部病变明显的ANCA相关性血管炎5例*
罗夏黎,宗秋,齐雪霏,牟永,王琪,熊维宁,赵建平,肖宏,周敏
(1.江汉大学医学院,武汉 430056;2.华中科技大学同济医学院附属同济医院呼吸与危重症医学科,武汉 430030;3.武汉大学人民医院,武汉 430060)
抗甲状腺药物是治疗甲状腺功能亢进症的基础治疗。我国常用的抗甲状腺药物包括丙硫氧嘧啶(propylthiouracil,PTU)和甲巯咪唑(methimazole)。丙硫氧嘧啶属于硫脲类,其作用机制是抑制甲状腺内过氧化物酶,从而阻止甲状腺内酪氨酸碘化及碘化酪氨酸的缩合,抑制甲状腺素的合成。同时,在外周组织中抑制甲状腺素(T4)变为三碘甲腺原氨酸(T3),使血清中活性较强T3含量较快降低。
丙硫氧嘧啶常见不良反应包括头痛、眩晕、关节痛、唾液腺和淋巴结肿大、胃肠道反应,也有皮疹、药物变态反应等,最严重为粒细胞缺乏症。此外,丙硫氧嘧啶肝毒性较甲巯咪唑明显,个别患者出现黄疸和中毒性肝炎[1]。对于丙硫氧嘧啶的少见不良反应,如诱发抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic autoanti-body,ANCA)相关性血管炎(ANCA-associated vasculitis,AAV)尚未被临床医师广泛熟知。随着丙硫氧嘧啶用药时间延长,诱导AAV发生率也随之增加,可引起肺部和肾脏病变,严重时危及患者生命。因此,需要引起临床医生尤其是呼吸内科和肾脏内科医生的重视。
本研究回顾性分析2014年1月—2018年12月在华中科技大学同济医学院附属同济医院呼吸与危重症医学科确诊的5例由丙硫氧嘧啶引起,以明显肺部病变就诊AAV患者的临床资料,归纳其临床特征,结合复习相关文献,帮助临床医师提高对该病的认识。
1 资料与方法
1.1资料来源 回顾性分析2014年1月—2018年12月华中科技大学同济医学院附属同济医院呼吸与危重症医学科临床确诊的口服丙硫氧嘧啶引起,以明显肺部病变就诊AAV患者临床资料、实验室结果及肺部CT资料,治疗及转归情况。共收集病例5例,均为Graves病患者。所有患者使用丙硫氧嘧啶前无血管炎的临床证据。
1.2方法 采用免疫荧光法(IFT)和酶联免疫吸附测定(ELISA)检测ANCA,采用德国欧蒙公司生产ANCA检测试剂盒,以及抗PR3和抗MPO的检测试剂。酶联免疫检测仪为EUROIMMUN Analyzer I全自动酶分析仪,荧光分析采用EUROIMMUN IF Sprinter XL全自动荧光操作仪、Nikon ECLIPSE 80i荧光显微镜[2]。操作流程按照说明书进行。
2 结果
2.1基本资料 共采集到患者5例,男2例,女3例,男:女=1:1.5,年龄45~60岁,平均年龄(52.7±5.4)岁。5例患者均为Graves病,病程3~16年。口服丙硫氧嘧啶时间3~10年。5例患者临床资料见表1。
2.2临床症状 5例患者的症状包括,①全身症状:反复发热、乏力、体质量降低;②呼吸道症状:不同程度的咳嗽、咯痰、咯血等;③其中1例伴有周围神经病症状(双下肢及足底烧灼感)。所有患者均有不同程度的血尿和(或)蛋白尿,血肌酐(Scr)为41~217 μmol·L-1(正常范围59~104 μmol·L-1)。患者在入院前于当地医院均误诊为肺部感染,反复给予抗感染治疗无好转。其中2例患者呼吸困难症状逐渐加重,进展为I型呼吸衰竭(表1)。
2.3ANCA检测结果 所有患者进行ANCA免疫荧光法和ELISA法检测,其中4例为p-ANCA阳性,MPO抗体为150.9 RU·mL-1到≥200 RU·mL-1(正常范围0~20 RU·mL-1),1例患者为p-ANCA阳性、c-ANCA弱阳性,MPO抗体124.7 RU·mL-1,PR3抗体41.8 RU·mL-1(正常范围0~20 RU·mL-1)。
2.4肺部CT结果 5例患者均进行肺部CT扫描,表现为不同密度的斑片影或软组织影,范围从单侧肺散在病变至双肺广泛弥漫性病变,其中有3例伴有单侧或双侧少量胸腔积液。见图1。
2.5治疗及转归 5例患者诊断丙硫氧嘧啶诱导AAV(PTU-AAV)后均立即停药。患者均存在不同程度的肺肾器官受累,临床都使用糖皮质激素(换算成泼尼松剂量为20~40 mg·d-1,后缓慢减量维持至停用)。病例1和病例5患者肺部间质性损害、肾脏功能损害明显,还联用环磷酰胺治疗。5例患者预后均良好,复诊半年期间无复发。
3 讨论
ANCA是以人中性粒细胞胞浆中嗜天青颗粒和单核细胞中溶酶体为靶抗原的一类自身抗体。嗜天青颗粒中含有丝氨酸蛋白酶3(PR3)和髓过氧化物酶(MPO)。临床上使用血清学ANCA检查判断AAV。AAV是以坏死性炎症为特点的血管炎,主要影响小血管(即毛细血管、小静脉、小动脉),最常受累器官是肺和肾脏,主要包括坏死性肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)、显微镜下多血管炎(microscopicpolyangiitis,MPA)、嗜酸粒细胞性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)。
传统的ANCA检测方法是在固定的中性粒细胞上用IFT法检测,包括胞浆型(c-ANCA)和核周型(p-ANCA)两种。现代还应用ELISA定量检测PR3-ANCA或MPO-ANCA水平。1994第1次Chapel Hill会议(CHCC)推荐结合IFT法和ELISA法作为检测ANCA的理想方法,在2017年共识中对于ANCA的检测明确指出:怀疑GPA或MPA的患者,推荐使用高质量的检测系统直接检测抗PR3或抗MPO抗体,如果结果阴性,则使用IFT法检测ANCA作为补充[3]。IFT检测核周型(p-ANCA)对应于ELISA法中MPO-ANCA,与MPA、EGPA相关;胞浆型(c-ANCA)对应于ELISA法中PR3-ANCA,与GPA相关。
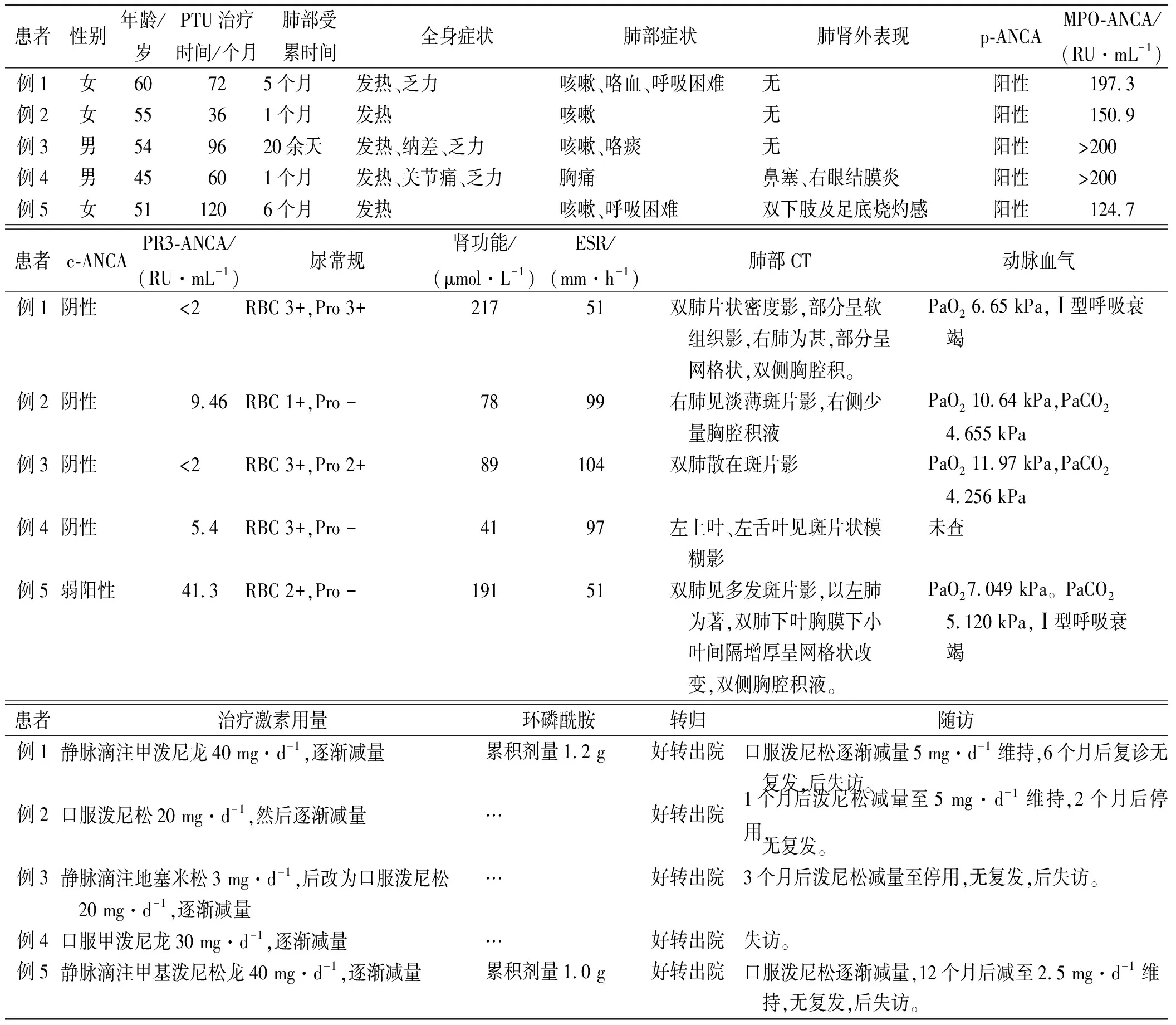
表1 丙硫氧嘧啶诱导肺部病变明显的ANCA相关性血管炎患者临床资料

图1 病例1肺部CT的典型影像
Fig.1TypicalCTimageoflungofcaseone
目前,还缺乏中国人AAV患病率的确切数据,已知MPO-ANCA阳性和MPA优势是中国AAV患者的流行病学特征[4]。有研究认为二氧化硅暴露是引起MPA的重要原因。肺巨噬细胞吞噬二氧化硅后,产生炎症因子吸引中性粒细胞,之后二氧化硅颗粒转运到淋巴结区域,导致T淋巴细胞的慢性活化,对易感患者触发自身免疫反应[5]。
深入研究发现,某些药物可以引起血ANCA阳性,甚至诱发血管炎,其中一个重要药物就是丙硫氧嘧啶[6]。PTU-AAV最早在1993年由DOLMAN等[7]报道,报道6例服用丙硫氧嘧啶治疗甲亢患者血清中检测到ANCA,并且患者有全身症状及肺肾损害等血管炎表现。停用丙硫氧嘧啶后ANCA浓度下降,临床症状完全消失。此后,越来越多的研究揭示PTU-AAV,这种血管炎不同于原发性血管炎,其机制可能是由于丙硫氧嘧啶在外周血中性粒细胞内积聚后,改变中性粒细胞内的MPO的构象,使细胞内酶成为靶抗原,被自身T细胞识别,活化B细胞产生自身抗体。除MPO外,丙硫氧嘧啶还引起人体免疫系统识别自身抗蛋白酶3(PR3)、人中性粒细胞弹性蛋白酶(human neutrophil elastase)等,形成多种靶抗原,诱导人体的多克隆免疫反应,而原发性血管炎多为单克隆免疫反应,两者在免疫反应机制方面明显不同[7-8]。此外,同原发性AAV中MPO-ANCA相比,丙硫氧嘧啶诱导产生MPO-ANCA缺乏IgG3亚型,亲和力较低,并且只识别MPO分子某些限制性表位片段[9]。
BALAVOINE等[10]研究统计260例与抗甲状腺药物相关的AAV患者,其中75%与丙硫氧嘧啶相关,25%与甲巯咪唑相关。服用丙硫氧嘧啶的Graves病患者中20%可出现ANCA阳性,其中约15%可以出现血管炎相关临床表现,而临床表现又各有不同。根据日本的一项研究表明,92例PTU-AAV患者肾脏受累率38.2%,肺受累率为19%,皮肤和关节受累率分别为13.8%和13.1%[11]。本研究中虽然所有患者均存在不同程度肾脏受累,但患者多是以肺部病变或呼吸系统症状就诊,都伴发热全身症状,初诊均在当地医院误诊为肺部感染。因此,提示临床医师对正在使用抗甲状腺药物的患者以肺部病变就诊,伴有多器官受累表现时,应注意行ANCA检查,排查药物相关性AAV可能。
本研究中5例患者有3例为女性,年龄51~60岁。发病时间从服用丙硫氧嘧啶数年到十年,所有患者使用丙硫氧嘧啶时间超过24个月;推测丙硫氧嘧啶治疗时间较长可能是出现AAV的高危因素。
虽然丙硫氧嘧啶诱导血管炎临床表现与特发性血管炎相似,但器官受累程度相对较轻[12]。从本研究采集PTU-AAV病例中来看,患者可出现全身症状包括发烧、关节痛、外周神经病变,可有肺脏、肾脏等器官受累的器官,不过临床表现相对较轻,与文献报道一致。目前如何区分药物诱导的血管炎与其他血管炎,尚缺乏特异性病理或实验室检查方法[13]。
目前PTU-AAV无统一的治疗方案。对所有患者来说,首先必须停用丙硫氧嘧啶。虽然部分研究认为PTU-AAV具有自限性,停用丙硫氧嘧啶后患者症状可以缓解,但仍有患者停用5个月后出现血管炎进展表现[14]。因而,对于已有重要器官受累PTU-AAV,主张进行适当免疫抑制治疗,包括糖皮质激素和免疫抑制药治疗[15]。本研究中5例患者停用丙硫氧嘧啶后均给予糖皮质激素治疗,3例病情缓解迅速。另2例患者由于肺部病变严重,进展为呼吸衰竭,伴有肾功能损害严重,使用糖皮质激素联合环磷酰胺治疗后病情控制。5例患者均好转出院。本研究结果支持对于有严重器官受损PTU-AAV患者,停用丙硫氧嘧啶后需给予免疫抑制药治疗。迄今为止,对于丙硫氧嘧啶诱导AAV患者免疫抑制治疗的最佳周期,是否需要长期维持没有定论。不过,多数研究认为PTU-AAV患者需要免疫抑制治疗的时间比原发性AAV患者短[13],本研究也发现,患者在停止免疫抑制药治疗6个月没有出现血管炎复发。长期的免疫抑制药维持治疗对停用丙硫氧嘧啶的AAV患者并不必要,这与原发性AAV患者的治疗有很大不同。
由于丙硫氧嘧啶、甲巯咪唑等结构相似,存在交叉反应,甲巯咪唑也可以诱导ANCA阳性血管炎,所以不主张替换治疗。对于PTU-AAV患者建议后续治疗考虑外科手术或者I131治疗。
另外,需要注意的是,ANCA的滴度并不能充分反映PTU-AAV的疾病活动情况。大多数患者停用丙硫氧嘧啶后5年内,血清MPO-ANCA仍然呈阳性,但无血管炎活动表现[8]。
综上所述,对需要口服丙硫氧嘧啶的甲状腺疾病患者,建议临床医生提高警惕,密切随访,定期监测ANCA、尿常规、肾功能、胸部CT等,及早发现PTU-AAV患者,及早停药,及时治疗,避免进展到呼吸衰竭、肾衰竭等危及生命情况。

