泼尼松龙通过抑制TAK1诱导成骨细胞凋亡的实验研究
左斌,邹凯,车彪,喻忠斌
骨质疏松症是临床上常见骨代谢疾病,调查显示其发病率逐渐上升,患者若不及时治疗可发展为骨折,影响日常生活质量[1]。泼尼松龙属于糖皮质激素药物,临床上主要治疗过敏性与自身免疫性炎性疾病,但也存在较大不良反应,长期服用会导致骨量丢失、增加骨的脆性,导致骨折[2]。有研究显示转化生长因子β激活激酶1(transforming growth factor beta activated kinase 1,TAK1)在骨、关节的发育以及骨形态信号转导中发挥着重要作用,与骨关节炎的发生也存在一定的相关性[3-4]。本研究选取M3T3-E1成骨细胞作为研究对象,通过用RNA干扰技术沉默M3T3-E1细胞TAK1基因的表达,以观察TAK1沉默后对泼尼松龙诱导成骨细胞凋亡的影响,为临床泼尼松龙用药提供一定的参考价值,报道如下。
1 材料与方法
1.1 材料 (1)实验细胞:小鼠M3T3-E1成骨细胞系购自中国科学院细胞库。(2)试剂与药物试药:泼尼松龙购自浙江仙琚制药股份有限公司;胎牛血清(FBS)、RPMI-1640培养基、青霉素链霉素双抗溶液购自美国Gibco公司;胰蛋白酶购自武汉纯度生物科技有限公司;BCA蛋白浓度测定试剂盒、碱性磷酸酶(ALP)染色剂购自北京博奥森生物技术有限公司;MTT、茜素红购自美国sigma 公司;2×SYBR Premix Ex Taq II 购自宝生物工程(大连)有限公司;兔抗鼠p-TAK1、TAK1、p-JNK、JNK 抗体均购自美国Gibco公司;辣根过氧化物酶标记山羊抗兔二体购自上海钰博生物科技有限公司;RNA提取和反转录试剂盒均购自上海闪晶分子生物科技有限公司;Annexin V/PI双染试剂盒购自美国Coulter公司;LipofectamineTM2000转染试剂购自Invitrogen公司;Annexin V FITC/PI 凋亡检测试剂盒购自赛默飞世尔科技(中国)有限公司。(3)仪器设备:CO2培养箱购自于Forma Scientific公司;低温离心机、蛋白凝胶成像仪购自美国Bio-Red公司;BX31光学显微镜购自日本奥林巴斯公司。
1.2 实验方法 2017年2月—2017年7月于长江航运总医院实验室进行实验。
1.2.1 M3T3-E1细胞培养:M3T3-E1细胞于室温解冻,随后采用5 ml PBS缓冲液5 ml进行洗涤,添加10%FBS、100 U/ml的RPMI-1640培养液,置于37℃ 5%CO2培养箱内培养,细胞融合后添加0.2%胰蛋白酶溶液进行消化,RPMI-1640培养液清洗2次后,1500 r/min离心5 min,保留细胞沉淀,再置于添加10%FBS、100 U/ml的RPMI-1640培养液中,制备单细胞悬浮液,细胞密度调整为106个/ml,当细胞贴壁生长至瓶底的80%时,加入胰蛋白酶消化,用RPMI-1640培养基洗涤3次,800 r/min离心3 min,收集细胞。按照1∶3比例进行传代培养,第3代细胞用于后续研究。
1.2.2 TAK1siRNA转染M3T3-E1细胞:取第3代培养细胞,培养2 d后更换新鲜培养基,细胞密度调整为4×105/ml,接种细胞培养板中,参照LipofectamineTM2000转染试剂盒进行操作(TAK1siRNA序列:F 5’-GCUCAUGCCAUGAGCUGGUGUUUAC-3’;R 5’-GUAAACACCGCUCAUGGCAUGAGC-3’);转染后继续培养48 h,进行相关指标检测。
1.2.3 实验分组:将细胞接种96孔细胞培养板,分为3组,每组均设置6个重复孔,正常组(A组):正常培养基进行培养;空白转染泼尼松龙处理组(B组):M3T3-E1细胞转染阴性siRNA后添加2 mmol/L泼尼松龙继续培养,TAK1 siRNA+泼尼松龙从处理组(C组):MC3T3-E1细胞转染TAK1 siRNA后添加2 mmol/L泼尼松龙继续培养,荧光显微镜下观察。
1.2.4 钙结节染色、碱性磷酸酶(alkaline phosphatase,ALP)染色:(1)钙结节染色。培养后的细胞用PBS溶液清洗后置于70%乙醇中固定1 h,PBS溶液清洗3次后加入茜红素染色剂染色30 min,PBS清洗后于显微镜下进行观察。(2)ALP染色。细胞培养后用PBS溶液清洗,消化离心后保留细胞沉淀,加入培养基重悬细胞,接种于载玻片,PBS溶液冲洗玻片后进入冷丙醇中10 min,流水冲洗3次,每次3 min,加入ALP孵育液,37℃下孵育4 h,蒸馏水冲洗2 min,加入2%硝酸钴溶液37℃孵育5 min,蒸馏水冲洗5 min,加入1% 硫化铵中2 min。中性树脂封片后于100倍显微镜下进行细胞计数。
1.2.5 Western blot 检测p-TAK1、TAK1、p-JNK、JNK 蛋白表达:收集处理后的细胞液加入细胞裂解液后提取细胞总蛋白,采用BCA试剂盒测定提取细胞总蛋白浓度,配制8%、12%分离胶与浓缩胶,取25 μg样品进行上样,蛋白Marker 6 μl,浓缩胶电压为80 V,分离胶电压为120 V,反应结束将蛋白凝胶转移至PVDF膜上,加入脱脂牛奶封闭4 h,加入一抗(兔抗鼠p-TAK1、TAK1、p-JNK、JNK 单抗)4℃震荡过夜,PBS溶液清洗后加入辣根过氧酶标记山羊抗兔二抗,室温反应2 h后PBS溶液清洗3次。将蛋白凝胶用EXL发光后,在暗室中曝光,利用凝胶成像仪对Western blot产生的条带进行定量分析。
1.2.6 MTT法检测M3T3-E1细胞增殖情况:收集培养后的细胞制备单细胞悬浮液,调整细胞密度为5×104/L接种,置于37℃、5%CO2培养箱中分别培养12 h、24 h、48 h、72 h,培养结束后加入MTT 10 μl孵育4 h,加入DMSO溶液100 μl,在570 nm处测定OD值。细胞抑制率=(实验组OD-空白OD)/空白OD×100%。
1.2.7 流式细胞仪检测细胞周期以及细胞凋亡变化:收集培养后的细胞制备单细胞悬浮液,调整细胞密度为5×104/L接种,置于37℃、5%CO2培养箱中培养,当细胞数量至80%时,加入0.25%胰蛋白酶消化细胞,收集细胞后加入预冷PBS溶液进行洗涤,70%乙醇溶液中进行固定1 h,PBS溶液清洗细胞后加入PI进行染色重悬后置于流式细胞仪中检测细胞周期变化。在细胞悬浮液中加入Annexin V-APC室温下黑暗中孵育15 min,采用细胞流式仪检测细胞凋亡情况。

2 结 果
2.1 ALP染色、钙结节染色比较 ALP染色显示A组细胞胞体较大,细胞核染色呈蓝紫色,细胞质呈淡紫色;B组细胞少于A组,且细胞发生破裂;C组细胞破裂程度高于B组,染色细胞数量也少于B组。将钙化结节所占面积比例量化显示,与A组比较,B组钙结节数量明显减少,C组结节数量少于B组。免疫荧光检测,B组细胞出现破碎,形态发生改变,C组破碎细胞明显增加,图1见封3。
2.2 M3T3-E1细胞中p-TAK1、TAK1、p-JNK、JNK 蛋白的表达 Western Blot 显示,A、B、C 3组间TAK1、JNK蛋白表达量并无明显变化,差异无统计学意义(F=2.188、0.056,P=0.147、0.946);p-TAK1、p-JNK蛋白表达量A组>B组>C组(q=7.071、14.369,7.299、5.869,P均<0.01),见图2、表1。

注:与A组比较,aP<0.01;与B组比较,bP<0.01
2.3 沉默TAK1后泼尼松龙对M3T3-E1细胞增殖的影响 MTT检测显示,A、B、C 3组间各时间点细胞抑制率比较差异均有统计学意义(F=10.059、74.880、117.081、116.049,P均<0.01),随着时间的延长,细胞增殖抑制率呈现逐渐上升的趋势,其中48 h受抑制更显著。在12 h时,A组细胞抑制率明显高于B组和C组(q=5.093、5.821,P均<0.01),而B组和C组之间细胞抑制率比较差异无统计学意义(q=0.728,P>0.05)。在24 h、48 h、72 h时,细胞抑制率比较,A组>B组>C组,差异均有统计学意义(q=12.000、15.782、15.902,4.800、4.932、4.638,P均<0.01),见图3、表2。
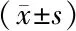
表1 3组细胞p-TAK1、TAK1、p-JNK、JNK蛋白表达比较

图3 3组M3T3-E1细胞增殖抑制情况
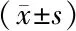
表2 3组M3T3-E1细胞抑制率比较
注:与A组同时点比较,aP<0.01;与B组同时点比较,bP<0.01
2.4 沉默TAK1后泼尼松龙对M3T3-E1细胞周期的影响 流式细胞仪检测结果显示,处于G2期细胞比例C组为(15.34±3.66)%,B组为(8.23±2.64)%,A组为(4.23±2.54)%,3组比较C组>B组>A组,差异有统计学意义(F=21.254,P=0.000),C组高于B组和A组(q=5.825、3.277,P均<0.05);处于S期细胞比例,C组为(2.18±1.05)%,B组 为(3.56±1.03)%,A组为(4.73±0.87)%,3组比较C组
2.5 TAK1沉默后泼尼松龙对M3T3-E1细胞凋亡的影响 流式细胞仪检测显示左下象限为正常细胞,右下象限代表晚期凋亡细胞,右上象限代表早期凋亡细胞。A组中细胞极少量出现凋亡(3.83±1.56)%,B组细胞少量出现凋亡(13.16±1.87)%,C组凋亡细胞数量明显增多(33.64±2.37)%,3组细胞凋亡率比较差异有统计学意义(F=362.449,P=0.000),细胞凋亡率C组高于B组和A组(q=25.571、11.649,P均<0.05),见图5。
3 讨 论
泼尼松龙属于临床常用糖皮质激素,具有消炎、抑菌、抑制免疫应答反应等作用,但长期服用也会导致肥胖症、类固醇糖尿病等,这些不良反应的产生限制着糖皮质激素的临床应用[5]。骨质疏松以及骨折是较严重的不良反应,大部分患者骨重建功能、骨修复能力降低,骨量流失,同时骨脆性增加,使发生骨折的风险增加[6]。有研究显示糖皮质激素量越高,发生骨折的风险越大。长期服用糖皮质激素导致骨折原因主要包括以下几方面:糖皮质激素能够簇集成骨细胞的聚集,增强其活性;降低骨保护素水平,提高氧化应激反应,促进成骨细胞凋亡[7-8],因此探究泼尼松龙诱导成骨细胞凋亡的机制对于降低其不良反应的发生十分有必要。
骨质疏松症的重要原因之一为成骨细胞增殖受抑制及分化程度降低[9]。已有研究发现,泼尼松龙能够促进成骨细胞凋亡,降低骨量、破坏骨微结构,增加骨质疏松发生的风险[10-11]。ALP是成骨细胞在分化早期形成的酶蛋白,是骨形成的标志性蛋白,一般用来鉴定成骨细胞的生化能力[12]。Zhou等[13]发现,ALP活性的降低直接影响成骨细胞矿化形成过程。本研究ALP染色显示空白转染联合泼尼松龙处理后,细胞出现破裂,且数量有所降低,而转染TAK1 siRNA联合泼尼松龙处理后,细胞破裂程度加重,细胞数量明显降低,说明泼尼松龙处理后能够使M3T3-E1细胞受损,沉默TAK1后细胞受损程度加重,钙结节染色也显示沉默TAK1基因表达后,钙结节数量明显降低,提示TAK1与M3T3-E1细胞成骨能力相关。

图43组沉默TAK1后泼尼松龙对M3T3-E1细胞周期的影响

图5 3组沉默TAK1后泼尼松龙对M3T3-E1细胞凋亡的影响
TAK1属于丝裂原蛋白激酶家族成员,较多研究已证实TAK1介导信号通路在调控细胞增殖、分化、凋亡中发挥重要作用[14-15]。TAK1是MAPK和NF-κB信号转导通路中的关键因子,其单独状态下并不能发挥重要作用,在MAPK通路中激活后的TAK1与MEKK3/6 共同激活JNK、P38发生磷酸化,进而激活AP-1细胞核转录蛋白,对相应基因蛋白进行调控;在NF-κB信号通路中,TAK1与膜受体蛋白结合后激活NIK,使IκB发生磷酸化介导NF-κB进入细胞核中调控通路下游靶基因表达[15-16]。有研究已证实在软骨细胞中MAPK和NF-κB信号通路在软骨细胞外基质的降解中发挥重要作用[17]。体外研究显示沉默TAK1表达,能够促进软骨细胞外基质降解,因此推测TAK1作为MAPK和NF-κB两个信号通路共同的上游信号转导分子,在骨病的发生中起着重要的调控作用[18]。国内学者研究发现敲除小鼠TAK1基因能够导致小鼠造血干细胞出现大量凋亡,且能够使JNK蛋白失活[19]。国外学者研究发现小鼠角质化细胞中沉默TAK1,能够促进表皮细胞的凋亡[20]。本研究通过检测转染后TAK1信号通路结果显示TAK1、JNK蛋白表达量并无明显变化,p-TAK1、p-JNK 蛋白表达量逐渐降低,表明沉默TAK1表达后能够抑制TAK1、JNK蛋白磷酸化,进而抑制JNK信号通路的表达促进泼尼松龙诱导成骨细胞凋亡。
本研究MTT检测显示,转染联合泼尼松龙处理后一定时间内M3T3-E1细胞增殖受到抑制,且抑制程度明显高于阴性转染组,且在48h抑制程度最明显,由此可见,M3T3-E1细胞转染TAK1 siRNA后,能够明显抑制M3T3-E1细胞生长,且随着培养时间延长,抑制作用升高,提示TAK1具有抑制M3T3-E1细胞增殖的作用。细胞周期阻滞能够为细胞修复提供额外时间,当损伤无法完全进行修复时,就会启动凋亡程序。国外学者研究显示二氧化硅纳米粒子能够诱导人脐静脉表皮细胞凋亡,并使细胞处于G2/M期,细胞凋亡率也明显升高[20]。国外研究显示将白血病细胞分别同步至G1、S 及 G2/M 期并进行紫杉醇处理,结果显示处于G2/M期细胞凋亡率高于G1、S期,凋亡数量也高于G1、S期[21]。本研究结果显示TAK1沉默后可导致M3T3-E1细胞周期阻滞于G2期,影响细胞增殖,MTT结果与以上研究中阻滞于G2期的细胞加速细胞凋亡这一结论相符,上述结果提示抑制TAK1表达后能够增强泼尼松龙诱导成骨细胞凋亡,进而在骨质疏松发展中发挥重要调控作用。
细胞凋亡是细胞生理性的死亡现象,是维持机体细胞数量平衡、对抗细胞异常增殖以及清除有害细胞的一种重要生理机制,研究肿瘤细胞凋亡机制对于阐明疾病发生发展具有重要意义[22]。较多研究均证实泼尼松龙类糖皮质激素能够抑制成骨细胞增殖、分化诱导其凋亡[23]。体外研究也证实糖皮质激素能够促进成骨细胞凋亡,但关于诱导凋亡机制目前还不清楚[24]。本研究显示沉默TAK1基因表达后细胞凋亡率明显增加,表明沉默TAK1后能够进一步加强泼尼松龙诱导成骨细胞凋亡的作用,推测TAK1参与成骨细胞凋亡途径,同时也说明泼尼松龙具有诱导成骨作用,可提高骨生长能力,促进骨愈合。
本研究也存在一定的局限性,未进行药物处理浓度研究,后期需要设置不同浓度梯度组来进一步验证,此外并未对下游凋亡通路进行深入研究,以便探究沉默TAK1基因与成骨细胞凋亡机制的联系。总之,沉默TAK1表达后能够增强泼尼松龙诱导成骨细胞凋亡的作用,可能与JNK信号通路相关。
利益冲突:无
作者贡献声明
左斌、喻忠斌:设计研究方案,实施研究过程,论文撰写,进行统计学分析;邹凯:提出研究思路,分析试验数据,论文审核;车彪:实施研究过程,资料搜集整理,论文修改

