水热法提取桑叶中异槲皮苷工艺参数优化
王星敏,王 露,李 鑫,詹 力,唐付杰
(1. 重庆工商大学环境与资源学院,重庆 400067;2. 重庆市特色农产品加工储运工程技术研究中心,重庆 400067)
0 引 言
中国桑资源丰富,其叶约占桑树地上部分产量的64%[1]。桑叶富含异槲皮苷、紫云英苷、叶黄素、谷甾醇等[2]多种天然活性物质及其衍生物,具有降血糖[3]、降血脂[4]、抗炎[5]、抗氧化[6]、抗肿瘤、抗菌[7]等药理作用,是中国卫生部确定的药食同源物。其中,异槲皮苷又称为槲皮素-3-O-β-D-葡萄糖苷,属黄酮类化合物,常作为天然着色剂、抗氧化剂等功能性原料[8],广泛应用于食品和医药行业。Jung等[9]发现异槲皮苷能有效降低由 NO引发的老鼠脑浆脂质的过氧化作用;Liu等[10]发现10 μmol/L的异槲皮苷通过抑制TNF-α,NO和iNOS的产生起到对多糖诱导 RAW264.7细胞产生炎症因子的调控作用。目前对于异槲皮苷药理性作用报道较多,对其提取的报道尚少。现有植物提取异槲皮苷的方法主要有超声提取法、回流浸提法、酶法提取、超临界流体萃取等。柯仲成等[11]采用回流法,100 g红旱莲经1 L/次乙醇回流2 h可提取异槲皮苷达2.83 mg/g;贾冬冬等[12]采用超声提取桑叶中异槲皮苷和芦丁,可提取异槲皮苷 6.47 μg/g。植物提提技术中,酶法[13]提取一般耗时至少3 h;超临界流体提取技术[14]虽已应用于实际生产中,但对设备要求高,投资大。现有提取技术或多或少存在提取率不高、投资成本大、时间长等不足。随着“健康中国 2030”、“国民营养计划(2017-2030)”和“乡村振兴”国家战略的实施,如何高值利用桑等生物质资源,提高天然活性成分的提取效率,满足人们日益增长的健康保健需求实现,越来越引起人们的关注。
桑叶致密的植物组织结构形成天然屏障,阻碍异槲皮苷等天然活性成分的溶出。水热反应是热化学转化过程,在较低温度(亚临界区),生物质主要发生水解反应,生成水溶性物质(大分子物质)。将水热反应引入天然产物提取技术中,主要利用一定的水热高温(压)条件对植物组织的裂解或转化水解[15],破坏植物组织致密结构,加速溶剂渗透、扩散,减少天然产物浸出的传质阻力,有利于天然活性成分的高效提取。基于此,为提高异槲皮苷提取率,本文提出水热反应辅助醇提法提取桑叶中异槲皮苷,利用响应面分析法优化获得适宜的异槲皮苷提取参数,探明影响异槲皮苷提取的因素间交互作用,探究异槲皮苷传质扩散规律,为桑叶资源高值利用提供理论依据。
1 材料与方法
1.1 仪器与试剂
原料:桑叶由重庆市北碚区蚕桑研究院提供。试剂:无水乙醇(分析纯),磷酸(分析纯),乙腈(色谱纯),重庆川东化工集团有限公司,异槲皮苷标准品(≥98%),成都普菲德生物技术有限公司。仪器:1260高效液相色谱仪(美国贝克曼库尔特有限公司);CJF-0.05小型高压反应釜(北京巩义予华仪器有限公司);台式电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);循环水式多用真空泵(郑州长城科工贸有限公司);高速粉碎机(北京开创同和科技发展有限公司);傅里叶变换红外光谱仪(美国 Nicolet 公司)。
1.2 试验方法
1.2.1 水热辅助乙醇提取桑叶中异槲皮苷
采摘新鲜桑叶经干燥、粉粹、过筛 0.18 mm后,分别称取干燥桑叶粉末5.0 g于水热反应釜中,按桑叶质量与乙醇溶液体积之比(料液比)为 1:3~1:7加入体积分数为30%~70%的乙醇,于120~160 ℃的烘箱中水热反应40~80 min后(通过预试验确定范围),过滤,分别收集滤渣和滤液。滤液即含有异槲皮苷醇提液;滤渣集中收集后待二次利用。区别于水热辅助乙醇提取法,乙醇浸提法按乙醇体积与桑叶质量比为 10:1加入体积分数为50%的乙醇,于45 ℃水浴摇床浸提5.0 g桑叶粉末120 min。
1.2.2 异槲皮苷的分析测定
1)标准曲线绘制。准确称取10 mg异槲皮苷标品用乙醇定容至25 mL得浓度为0.4 mg/mL异槲皮苷标准溶液,准确移取0.5、1、2、4、6、10 mL定容至10 mL,得到质量浓度梯度为 0.02、0.04、0.08、0.16、0.24、0.4 mg/mL的标准使用液以待检测。以浓度c对峰面积作图,绘制异槲皮苷标准曲线回归方程为Y=12 615X-31.658,R2=0.999 8,表明在浓度范围0.02~0.4 mg/mL内线性关系较好,可用于试验计算。根据标准曲线计算异槲皮苷质量浓度,进而计算桑叶中异槲皮苷溶浸量y,计算公式见公式(1)。

式中 c异槲皮苷浓度,mg/mL;v提取液体积,mL;m桑叶质量,g。
2)高效液相色谱分析。采用高效液相色谱法测定醇提液中异槲皮苷质量浓度,色谱条件为:色谱柱为Hypersil ODS柱(250 mm×4.6 mm,5 μm);流动相是体积比为 20:80的乙腈和 0.5%磷酸水溶液;流速为1 mL/min;检测波长为350 nm;柱温为25 ℃;进样量为10 μL;洗脱时间 30 min。
1.2.3 桑叶底物FTIR分析
采用衰减全反射模式测定桑叶的傅里叶变换红外光谱,分析水热反应后底物表面化学物质的官能团种类及其变化,测定波数为4 500~500 cm-1。
1.2.4 响应面分析法
在单因素试验基础上,采用 Box-Behnken设计,选取水热时间、料液比、水热温度和乙醇体积分数为自变量,以异槲皮苷得率为响应值,设计4因素3水平的响应面分析试验,响应曲面因素水平编码(表1)。

表1 响应曲面因素水平与编码Table 1 Response surface factor level and coding
2 结果与分析
2.1 影响异槲皮苷溶浸的水热-醇提单因素试验
2.1.1 水热时间对异槲皮苷溶浸的影响
水热反应有利于植物组织的转化分解,水热反应时间影响着植物组织官能团裂解及分解效果,影响异槲皮苷传质溶浸。由图1a可知,5.000 0 g桑叶当料液比为1:4、乙醇体积分数为50%、水热温度为160℃时,在水热反应40~80 min范围内,桑叶中异槲皮苷溶浸量先上升后下降,在60 min时达到最大值,为2.626 1 mg/g,对比乙醇浸提法反应2 h的溶浸量(0.071 0 mg/g),水热辅助醇提法大大提高异槲皮苷的提取能效。分析原因在于,木质素主要由苯基丙烷结构单元通过C-O-C和C=C联接而成,在水热转化过程中,以β-O-4型连接的木素结构单元更易断裂,同时C-C也相对易断裂,易发生脱水反应[16],加大木质素水热转化生成较低分子的酚类单体或多聚体[17],纤维素及半纤维素的长链分子转化成可溶性的低聚糖和单糖等小分子[18],从而破坏植物组织致密结构,有利于异槲皮苷溶出充分,提高异槲皮苷溶浸率,但过度延长水热反应时间会增加能耗[19]。
2.1.2 料液比对异槲皮苷溶浸的影响
提取溶剂乙醇为亲水性有机溶剂,能诱导非极性物质产生一定的极性,因电性作用可溶解含有 8个羟基的异槲皮苷。由图1b可知,当水热温度为160℃、乙醇体积分数为50%、水热时间60 min时,在料液比为1:3~1:7范围内,异槲皮苷溶浸量随着料液比的增加先增加后减少,在料液比为 1:6时异槲皮苷得率达到最大值为2.689 1 mg/g。分析原因在于,增大提取液用量,可适度增大水热高温(压)条件的渗透压力,有利于异槲皮苷在渗透压和溶剂静电的双重作用充分溶浸并提取;但继续增大提取剂用量,同时也增大乙醇与桑叶中其他活性成分的接触、溶浸作用,导致异槲皮苷在溶浸过程中与其他活性成分产生竞争关系,不仅影响异槲皮苷的溶浸,还造成不必要的溶剂浪费[20]。
2.1.3 水热温度对异槲皮苷溶浸的影响
温度升高可促使分子运动加速,增加溶剂分子和溶质分子的动能[21]。由图1c可知,当水热时间60 min、料液比为1:6、乙醇体积分数为50%时,在120~160 ℃范围内,异槲皮苷溶浸量先增大后减小,在 140 ℃时达到最大值,此时异槲皮苷溶浸量为2.497 mg/g。分析原因在于,水热反应体系中较高温度可适度软化表面细胞壁,而纤维素和半纤维素是糖类碳水化合物,热稳定性相对低[22],在升温过程中发生表面水解[23];此外,水热反应体系中较高温度可加速乙醇分子和天然活性分子异槲皮苷的动能,更利于异槲皮苷的扩散和溶出[24];温度继续升高,同时也加快其他物质的溶出,影响异槲皮苷溶出扩散效率,且过高温度还会影响天然成分的生物活性,破坏天然活性成分分子结构。
2.1.4 不同体积分数的乙醇对异槲皮苷溶浸的影响
在水热反应中,物质的扩散还与溶液黏度相关[25]。由图1d可知,当料液比为1:6、水热温度140 ℃、水热时间60 min时,乙醇体积分数为30%~70%时,不同体积分数的乙醇对异槲皮苷得率的影响有所不同,当乙醇体积分数为 60%时,异槲皮苷溶浸量达到最大为3.087 9 mg/g。分析原因在于,乙醇和水均含有-OH,根据相似相溶原理,可溶解还有8个-OH的异槲皮苷;异槲皮苷虽在水中溶解度仅为25.9 μg/mL,但水可适度增加醇提体系渗透压力,可加大底物表面与溶剂间浓度差,有助于醇溶性物质的充分扩散和溶出;乙醇体积分数偏低,有利于提高多糖、多肽等水溶性物质溶出量[26],乙醇体积分数偏高时,则加大醇溶性物质如叶绿素、叶黄素、亲脂性强的成分溶出,影响异槲皮苷的溶出效果。

图1 单因素试验Fig.1 Single factor test
2.2 异槲皮苷溶浸因素的响应面分析
2.2.1 回归模型构建及显著性检验
运用Design-Expert v8.0软件建立的试验设计及试验结果见表2,对表2中试验数据进行回归分析,得出水热时间(A)、料液比(B)、水热温度(C)、乙醇体积分数(D)与异槲皮苷得率(Y)之间的二次多元回归方程见式(2)。

该回归方程中4个一次项系数均为正值,表明4个因子对异槲皮苷得率都有协同作用[27]。对该模型进行模型系数显著性检验和方差分析,结果见表3。

表2 RSM试验设计与结果Table 2 Experimental design and results of RSM
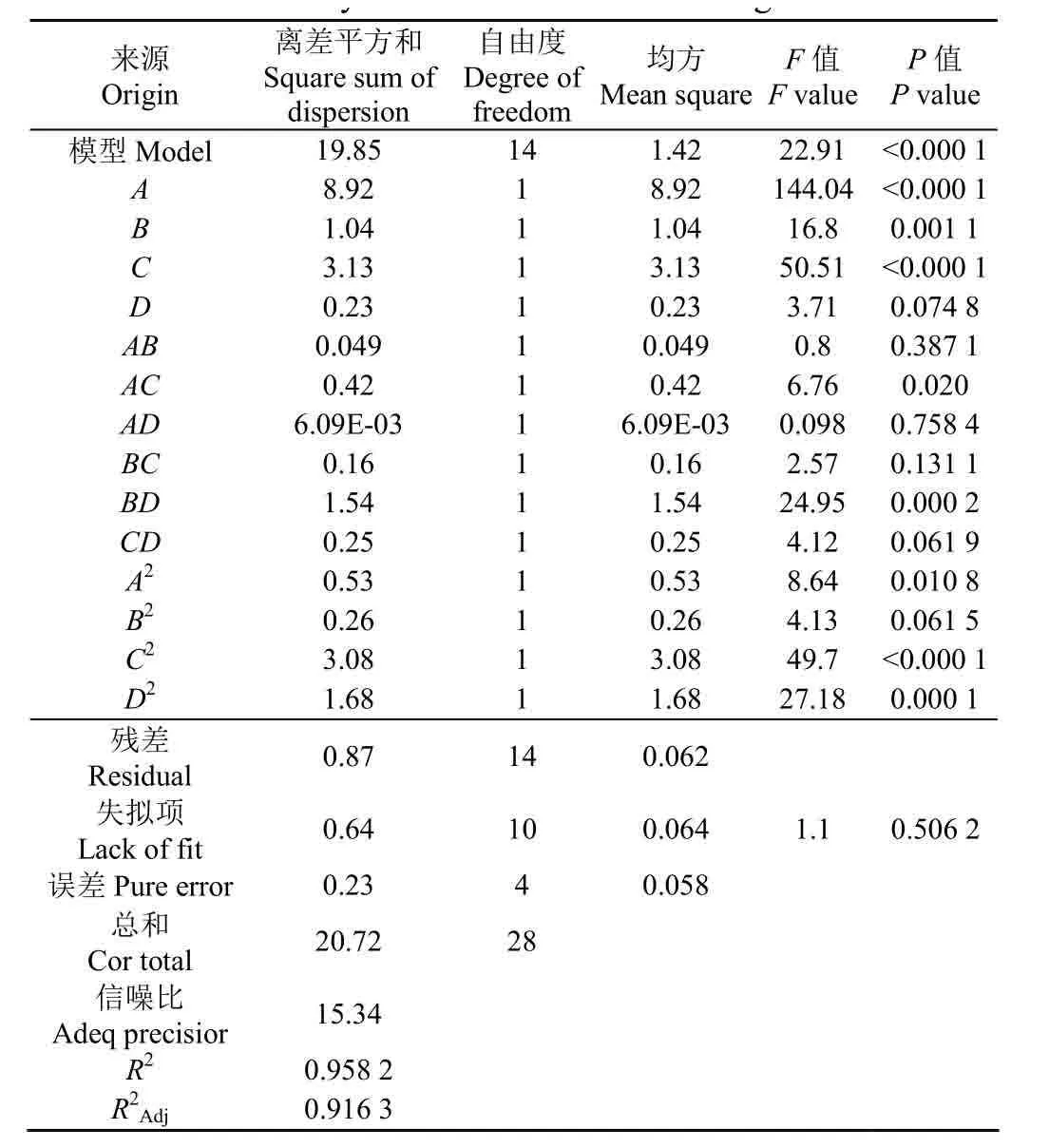
表3 方差分析及显著性检验Table 3 Analysis of variance and test of significance
从方差分析可以看出:该方程P<0.000 1,F=22.91,表明针对本试验的响应目标值 Y所选用的模型具有很好的显著性;失拟项表示模型预测值与实测值不拟合的概率,该模型中失拟项P=0.506 1>0.05,说明试验与该模型的差异程度不显著,无失拟因素存在,影响极显著;决定系数R2=0.958 2,表明约95.82%的异槲皮苷得率变异分布在所选取的4个因素中,总变异中仅有4.18%不能由该模型解释,表明该模型拟合程度良好;校正系数表明试验值与预测值间具有较高相关性,该模型拟合程度良好,可用此模型对水热反应辅助醇提异槲皮苷进行得率的分析和预测。由F值检验可获得影响桑叶异槲皮苷得率的主次因素为:水热时间>水热温度>料液比>乙醇体积分数。
2.2.2 水热解因素响应面及交互作用分析
响应面和等高线能直观地反映各因素的交互作用对响应值的影响[28-30]。以式(2)数学模型为基础,应用Design Expert 8.0.6软件编程,绘制响应值异槲皮苷得率与影响因素的三维关系图。等高线的形状反映交互效应的强弱大小,椭圆形表示交互作用显著,而圆形则相反[31]。由图2a~2d可知,2因素间的响应面图均存在极值,AB、AC、BC和CD的等高线呈椭圆形,椭圆轴线与坐标轴之间有较大的角度,表明响应面中 2个影响因素的交互作用显著;此预测结果与表 3中方差分析及显著性检验所反映的结果一致。

图2 交互作用对异槲皮苷得率的响应面图Fig.2 Response surface diagram of interaction on yield of isoquercitrin
2.2.3 模型验证
采取响应面分析优化的适宜工艺参数,即水热时间为80 min、料液比为1:7、水热温度为154 ℃、乙醇体积分数为57%,分别取5.0 g桑叶进行平行试验3次取平均值,相对标准偏差RSD=1.3%,说明响应曲面法得出的最优工艺参数具有重现性,且该模型对优化此工艺具有可行性;试验浸提所得异槲皮苷平均得率为3.649 1mg/g,是乙醇浸提异槲皮苷得率(0.071 0 mg/g)的51倍。相比单因素试验结果,优化所获工艺参数中水热时间、水热温度有所提高,但优化所获得的异槲皮苷得率较单因素试验值3.087 9mg/g提高了18.2%,显著增加高附加值的天然活性物质的利用率。结果见表4。
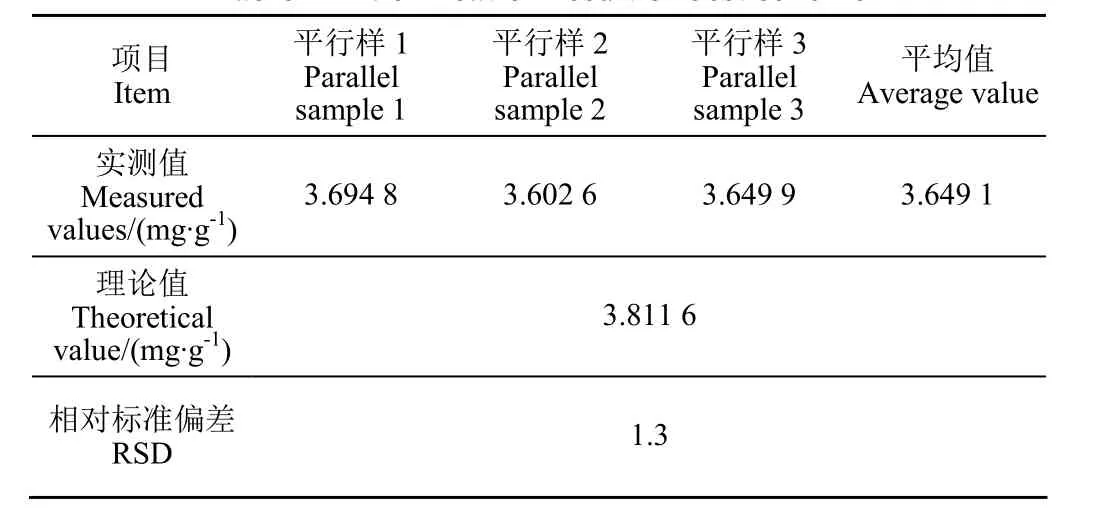
表4 最佳方案验证结果Table 4 Verification result of best scheme
2.3 异槲皮苷溶浸过程解析
2.3.1 异槲皮苷传质扩散模型
天然产物提取的过程其实质为活性成分在植物体与溶剂间的传质扩散作用。将底物桑叶视为多孔介质[32],利用经验公式 Webber-Morris动力学模型扩散方程[33-34]探究异槲皮苷在植物组织在水热解转化及乙醇同步提取作用下、由植物组织体内扩散至溶剂的过程。其中,Webber-Morris动力学模型扩散方程为

式中Kt溶剂内扩散速率常数,mg/(h1/2∙mL);qt为异槲皮苷t时刻浓度,mg/mL;C常数,反应边界层厚度;t为水热时间,min。
基于响应面优化获得异槲皮苷溶浸的适宜条件,开展异槲皮苷溶浸浓度随桑叶水热反应时间的影响研究,并以qt对t1/2作图(图3),相关参数见表5。

图3 水热法溶浸异槲皮苷的qt-t1/2曲线Fig.3 qt-t1/2 curve of isoquercetin dissolved by hydrothermal method

表5 异槲皮苷传质扩散模型参数Table 5 Parameters of mass transfer diffusion model of isoquercetin
从决定系数 R2可知,3阶段的相关性较高,表明该模型可用于分析异槲皮苷的扩散过程。由图 3可知,异槲皮苷溶浸扩散分为 3个阶段:第Ⅰ阶段为渗透溶浸阶段,即溶剂向底物表面及内部渗透,并溶浸底物中有效成分;第Ⅱ阶段为内部扩散阶段,即溶浸的异槲皮苷以分子形态从植物颗粒内扩散迁移到固液界面上;第Ⅲ阶段为固液扩散阶段,即有效成分从植物体内向溶剂主体扩散,直至平衡。从图可知,第Ⅱ阶段呈直线增加,且不过原点,推测内部扩散为异槲皮苷溶出的关键步骤;第三阶段为平缓的直线,表明异槲皮苷溶浸趋于平衡,且当水热辅助醇提至少需80 min,5.000 0 g桑叶中异槲皮苷溶浸才趋于平衡。此外,从表5中可知,3个阶段的反应边界层厚度常数C值大小为CⅠ<CⅡ<CⅢ,呈逐渐增大趋势,而扩散速率常数Kt随着边界层厚度C的增加而变小,说明边界层厚度影响扩散速率,内部扩散不是唯一的速度控制步骤。
2.3.2 桑叶水热解表面红外分析
对比桑叶原料、水热辅助醇提后桑叶底物和醇提后桑叶底物的红外光谱图(图4)发现,经水热反应辅助醇提法处理的桑叶底物在2 916 cm-1[35]处纤维素的C-H伸缩振动、1 417 cm-1处木质素结构支链中甲氧基、1 105 cm-1处的羧基中C-O伸缩振动、895 cm-1处的纤维素中典型的β糖甘键特征吸收峰消失,表明桑叶中木质素的苯基丙烷结构单元以及纤维素表面官能团分解;对比乙醇浸提后底物和桑叶原料,水热反应后底物在1 245 cm-1处的木质素二芳基醚键C-O、1 060 cm-1处的纤维素吡喃糖环所含的醇 C-O伸缩振动[17]的特征吸收峰明显减弱,而1 624 cm-1的C=C出现、表明桑叶中纤维素的多聚糖发生水解。这与水热反应的选取条件有关,当水热温度为154 ℃<250 ℃时,水热反应主要以水解反应为主,生成单糖等水溶性大分子物质;而一定压力使得溶剂密度增大,促使C-O、C-H、C=C键断裂,有利于水解反应发生,促进木质素的三维结构解体。

图4 桑叶底物红外光谱图解析Fig.4 Infrared spectra of mulberry leaves
3 结 论
1)采用水热反应辅助醇提法提取桑叶中异槲皮苷的适宜工艺参数为:水热时间为80 min、水热温度为154 ℃、料液比为1:7、乙醇体积分数为60%时,5.000 0 g桑叶中可溶浸3.649 1 mg/g异槲皮苷,该溶浸质量是乙醇浸提的51倍,较单因素试验值3.087 9mg/g提高了18.2%,显著增加高附加值的天然活性物质的利用率,符合当下经济、环境效益。
2)采用响应曲面法进行二次回归拟合,所得模型P<0.01,表明该模型影响极显著;4个影响因素与响应目标值 Y之间存在交互作用的影响,其影响程度分别为:水热时间>水热温度>料液比>乙醇体积分数。
3)内部扩散模型研究表明,异槲皮苷在反应体系中的扩散存在渗透、内部扩散和边界扩散 3个过程,内部扩散不是唯一的速度控制步骤,扩散速率常数随着边界层厚度增加而变小。解析红外光谱图可知,羧基中 C-O伸缩振动特征吸收峰、C-H弯曲振动消失,O-H和 C-H的特征吸收峰减弱,表明水热反应有助于桑叶木质素中苯基丙烷结构单元分解,促使纤维素表面水解反应发生,有利于提取物异槲皮苷的溶出。

