气质联用法测定反复冻融畜禽肉中胆固醇及其氧化物含量
沈雅萍,王凤玲,关文强,张 月
(天津市食品与生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
肉类蛋白质含量高、质量好,是多种矿物质的较好来源[1]。鸡肉、猪肉和牛肉是日常食用肉类,新鲜肉难以长时间贮藏,日常生活中经常会将肉冻藏,受环境影响可能会出现反复冻融现象,反复冻融会使肉中可溶性矿物质(如钾和钠)随汁液而流失,水分减少,丙二醛含量增加[2],影响肉的品质,增加肉中的胆固醇氧化物的含量[3-5]。
胆固醇是一种对动物代谢具有重要作用的类固醇脂质,是胆汁酸、激素和维生素D的前体[6],广泛存在于肉、蛋、水产品以及奶制品等动物源性食品中[7-8]。胆固醇含量较高的食物在加工或贮藏过程中,受氧气、光照及各种促氧剂的作用,胆固醇的A环、B环或支链发生自氧化反应,生成多种氧化产物,称为胆固醇氧化物(Cholesterol Oxidation Products,COPs)[9-10]。反复冻融的过程中,因为肉中含有化学性质非常不稳定且带有多个双键的多不饱和脂肪酸,在解冻过程中,多不饱和脂肪酸首先被氧化,产生游离基和过氧化物,而肉中胆固醇会在这些游离基和过氧化物的攻击下发生氧化,生成胆固醇的过氧化物,这些过氧化物进一步分解,转变为COPs[11]。COPs具有很强的细胞毒害性、突变性和致癌性,会引起动脉粥样硬化,导致人体固醇类化合物代谢紊乱,危害人体健康[12-14]。Nam等[15]研究了贮存7 d后的新鲜生肉类在真空、空气中、真空辐照、空气中辐照条件下COPs含量的情况,发现COPs含量随贮存时间增加而增加。
COPs的仪器测定方法有很多种,包括气相色谱法[16-18]、高效液相色谱法[19-21]、气相色谱-质谱联用法[22-25]、核磁共振[26]和酶法[27]等。气相色谱-质谱联用具有高分辨率和高灵敏度的特点,常用于复杂组分的分离与鉴定,胆固醇组分复杂,宜用此法测定。Clariana等[28]研究用气相色谱质谱法测定干腌肉中的COPs发现,25-羟基胆固醇、7β-羟基胆固醇、7-酮基胆固醇、20α-羟基胆固醇等多种氧化物的测定具有较好的可重复性,其精确度高达90%。本文采用气相色谱-质谱串联对反复冻融后鸡肉、猪肉和牛肉中的胆固醇及其氧化物进行测定,考察反复冻融后各种肉中类胆固醇及其氧化物含量和相关指标变化情况,为保持冷冻肉品质提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
胆固醇标准品(99.7%) 国家计量科学研究院;5种COPs:7β-羟基胆固醇、5α,6α-环氧化胆固醇、20α-羟基胆固醇、7-酮基胆固醇、25-羟基胆固醇 SIGMA公司;1,1,3,3-四乙氧基丙烷(又名丙二醛乙缩醛) 上海信裕生物科技有限公司;硫代巴比妥酸(TBA) 西格玛奥德里奇(上海)贸易有限公司;正己烷(质谱纯) 德国Merck公司;乙二胺四乙酸二钠 天津市凯通化学试剂有限公司;鸡胸肉(散养鸡,鸡大胸;月龄:7个月)、鸡腿肉(散养鸡,琵琶腿;月龄:7个月)、牛肉(黄牛,牛背长肌;月龄:30个月)、猪肉(白猪,猪后腿;月龄:10个月) 天津某超市,市售新鲜肉;实验室用水 为超纯水。
Trace1300气相色谱仪、TSQ8000Evo三重四极杆质谱仪 美国Thermo公司;AS10200A 超声波提取仪、ME215P电子天平 德国Sartorius公司;RE-52A 旋转蒸发仪 上海亚荣生化仪器厂;FJ200-SH数显高速分散均质机 上海标本模型厂;DK-8D型电热恒温水槽 上海森信实验仪器有限公司;Milli-Q水纯化系统 美国Millipore公司。
1.2 实验方法
1.2.1 样品处理 将鸡肉、猪肉、牛肉实验肉样去皮、去骨、去筋,搅碎后放置-18 ℃冰箱冷冻。以冷冻24 h,室温解冻6 h为1次冻融周期,分别对6个冻融周期的肉进行样品测定,以未经冷冻为对照样品。
1.2.2 GC-MS/MS测定胆固醇及其氧化物标品方法建立
1.2.2.1 标准溶液配制 分别准确称取胆固醇及25-羟基胆固醇、7β-羟基胆固醇、20α-羟基胆固醇、5α,6α-环氧化胆固醇、7-酮基胆固醇标准品各2.50 mg(精确至0.01 mg),超声混合均匀,配制浓度为100 μg/mL的胆固醇及其氧化物标准品的储备液(标准品母液),置于25 mL棕色容量瓶,正己烷定容至刻度线,4 ℃下避光保存。
1.2.2.2 仪器测定参数 参考方益等[11]方法并有所修改。色谱条件:TG-5MS色谱柱(30 m×0.25 mm×0.25 μm);初始温度80 ℃,保持0 min,以10 ℃/min的速率升温至270 ℃,保持22 min;进样口温度250 ℃;进样量1.0 μL不分流进样;载气为氦气(He,纯度>99.999%)。
质谱条件:传输线温度250 ℃;EI离子源,离子源温度200 ℃;电离能量:70 eV;采用特征离子实时扫描搜集模式SIM的扫描方式,扫描质量范围50~650 m/z;溶剂延迟4 min。
1.2.2.3 GC-MS/MS方法学考察 标准曲线绘制:配制3、50、100、200、300 μg/mL不同浓度的胆固醇及0.2、1.0、3.0、5.0、10.0 μg/mL不同浓度的5种胆固醇氧化物的混合标准工作液,利用已建立的色谱条件和质谱条件下进行GC-MS/MS测定分析。
1.2.3 肉品中胆固醇及其氧化物含量的测定
1.2.3.1 脂肪提取 准确称取1.2.1肉样各2.0 g(精确至0.1 g)置于小锥形瓶中,向锥形瓶中加入配制好的Folch试剂(氯仿∶甲醇=2∶1,V/V)18 mL,振荡封膜后放入4 ℃冰箱,静置12 h,进行脂肪提取。取冰箱静置后的脂肪提取液,放置到室温后将提取液倾出至分液漏斗中,再用等量Folch试剂对残渣进行提取。合并提取液于分液漏斗中,加入12 mL蒸馏水振荡洗涤,静置后分出下层溶液,经无水硫酸钠脱水后于旋转蒸发仪上45 ℃旋转蒸干,得到脂类物质[29]。
1.2.3.2 皂化 向1.2.3.1脂类提取物的旋蒸瓶中加入1 mol/L KOH溶液10 mL,甲醇溶液10 mL,混合均匀后接冷凝管,于70 ℃水浴回流,皂化50 min,期间多次摇匀皂化液,皂化结束后冷却至室温。
1.2.3.3 胆固醇及其氧化物提取 在1.2.3.2皂化液中加入10 mL石油醚,振荡摇匀进行提取,用分液漏斗分出下层石油醚溶液,无水硫酸钠吸附水,得到粗提取的胆固醇及其氧化物的石油醚提取液。
在45 ℃下减压旋转蒸发,待完全蒸干,冷却后即得胆固醇及其氧化物提取物,加入2 mL正己烷,200 W超声5 min使其充分溶解,过0.22 μm的尼龙膜,放入进样瓶后按照1.2.2方法对胆固醇及其氧化物含量进行检测。
1.2.4 丙二醛测定 以丙二醛标准使用液的浓度为横坐标,丙二醛含量为纵坐标,进行线性回归分析,得到标准曲线为y=1.1457x+0.0455,R2=0.9999,线性范围为0.01~0.80 μg/mL,根据标准曲线测定肉样中的丙二醛含量。
准确称取1.2.1肉样10.0 g,加入40 mL 5%三氯乙酸混合液(三氯乙酸∶乙二胺四乙酸二钠=75∶1,V/V)后于14000 r/min均质10 min,用中性滤纸过滤,再用5%三氯乙酸混合液将滤液定容至50 mL,取上述滤液5 mL置于25 mL具塞管内,加入5 mL TBA溶液(相当于0.02 mol/L),混匀,加塞,置于90 ℃水浴锅内保温40 min,取出冷却10 min,在532 nm处测吸光值[30]。
1.2.5 水分测定 准确称取1.2.1肉样5.0 g,放入250 mL蒸馏瓶中,加入新蒸馏的甲苯75 mL,连接冷凝管与水分接收管,从冷凝管顶端注入甲苯,装满水分接收管。加热慢慢蒸馏,水分全部蒸出后,从冷凝管顶端加入甲苯冲洗。待接收管水平面保持10 min不变时为蒸馏终点,读取接收管水层的体积,即为肉样的水分含量[31],同时以不加样品的甲苯试剂做为空白对照。
1.3 数据处理
所有实验都进行3次重复,所得数据均以均值±标准偏差表示,由TSQ8000Evo三重四极杆质谱仪中的TraceFinder软件进行方法建立与数据分析。
2 结果与分析
2.1 标准品测定
2.1.1 GC-MS/MS色谱图 根据优化后的色谱质谱条件,得出胆固醇及其5种氧化物的混标图,如图1所示。

图1 胆固醇及其5种氧化物的混标色谱图Fig.1 Mixed standard chromatogram of cholesterol and its five oxides注:A为胆固醇;B为5α,6α-环氧化胆固醇; C为20α-羟基胆固醇;D为25-羟基胆固醇; E为7β-羟基胆固醇;F为7-酮基胆固醇。
由图1可以看出,胆固醇及其5种氧化物有较好的分离度。其中A为胆固醇,保留时间:21.41 min;B为5α,6α-环氧化胆固醇,保留时间:25.29 min;C为20α-羟基胆固醇,保留时间:26.34 min;D为25-羟基胆固醇,保留时间:27.07 min;E为7β-羟基胆固醇,保留时间:27.20 min;F为7-酮基胆固醇,保留时间:30.41 min。
2.1.2 GC-MS/MS质谱分析 通过RSM离子化,AutoSIM得出了定量离子和定性离子(见表1)。
由表1可看出,胆固醇及其氧化物每种物质有三对特征离子对(母离子/子离子对),通过定性离子对来确定其种类,利用定量离子来确定其含量。

表1 胆固醇及其5种氧化物的保留时间、母离子、子离子与碰撞能量Table 1 Retention time,parent ions,daughter ions and collision energies of cholesterol and its five oxides
2.2 方法学考察
2.2.1 标准曲线绘制 取1.2.2.3配制好的标准混合液,利用已建立的色谱条件和质谱条件下进行GC-MS/MS测定分析,以胆固醇及其5种氧化物的定量离子峰面积为纵坐标,标准工作溶液中被测组分的浓度为横坐标作图,得到线性方程和线性相关系数,如表2所示。
由表2可知,由于样品中胆固醇含量较大,胆固醇标准曲线的线性范围为3.0~300 μg/mL,胆固醇氧化物均为0.2~10.0 μg/mL,决定系数均在0.999以上,线性关系良好。

表2 胆固醇及5种COPs线性方程、相关系数、线性范围及检测限Table 2 Linear equation,correlation coefficient,linear range and detection limit of cholesterol and 5 kinds of cholesterol oxides
2.2.2 标准品稳定性考察 取适量新配制的10 μg/mL标准工作液,过0.22 μm滤膜,立即进行检测,将得到的峰面积记为含量100%,即没有损失;随后分别测定放置0、2、4、6、8、10、12、24 h的标准品,对标准品进行稳定性考察。
从以上胆固醇及其5种氧化物标准溶液稳定性考察结果(图2~图3)可看出:胆固醇及其5种氧化物的标准品溶液在配制后6 h内基本稳定,4 h内使用效果最佳。

图2 胆固醇标准溶液稳定性考察Fig.2 Stability study of cholesterol standard solution
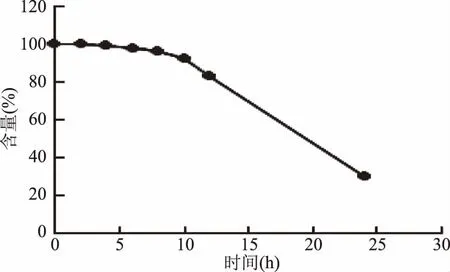
图3 5α,6α-环氧化胆固醇标准溶液稳定性考察Fig.3 Study on stability of 5α,6α-epoxy-based cholesterol standard solution
2.2.3 精密度考察 在仪器状态稳定的情况下,按照优化后的GC-MS/MS条件进行检测,用10 μg/mL胆固醇及其5种氧化物混合标准工作液平行测量五次,通过胆固醇及其5种氧化物的保留时间和峰面积的相对标准偏差(RSD)来考察仪器的精密度,测定结果表明,胆固醇及其5种氧化物的保留时间相对标准偏差(RSD)范围为0.7%~2.8%,峰面积相对标准偏差范围为0.8%~2.6%。
2.2.4 检出限测定 用正己烷不断稀释胆固醇及其5种氧化物的标准工作液,以3倍于基线噪声的响应信号所进样品的浓度来计算检出限。当信噪比(S/N)为3时,得到胆固醇及其5种氧化物的检出限如表3所示。
由表3可知,胆固醇及其5种氧化物的检出限均在0.02~0.08 μg/mL之间,能够满足反复冻融过程中对其变化的定量分析。
表3 胆固醇及其5种氧化物的检出限Table 3 Detection limit of cholesterol and its five oxides

图4 20α-羟基胆固醇标准溶液稳定性考察Fig.4 Study on stability of 20α-hydroxy-cholesterol standard solution

图5 25-羟基胆固醇标准溶液稳定性考察Fig.5 Study on stability of 25-hydroxycholesterol standard solution
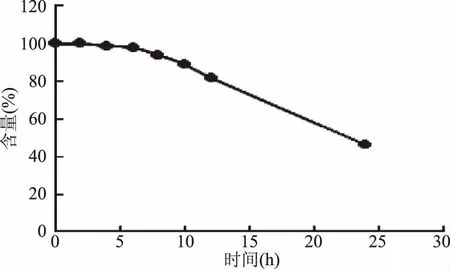
图6 7β-羟基胆固醇标准溶液稳定性考察Fig.6 Study on stability of 7β-hydroxycholesterol standard solution
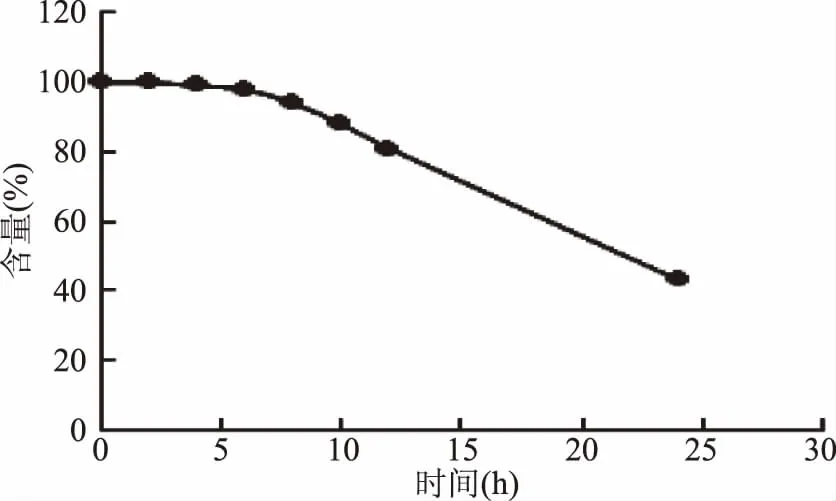
图7 7-酮基胆固醇标准溶液稳定性Fig.7 Study on stability of 7-keto cholesterol standard solution
2.2.5 加标回收率测定 称取已知含量的鸡肉样品(2.000±0.001) g,加入不同体积的10 μg/mL混合标准工作溶液,每个样品取3次平均值测定,测定回收率,结果见表4。

表4 方法的回收率(n=3)Table 4 Recovery rate of the method(n=3)
由表4可知,在未经冻融的鸡胸肉中加入3个不同浓度的标准物质混合样,回收率范围为79%~103%,RSD≤4.7%,实验表明,所建立的方法能够准确测定畜禽肉中胆固醇及其氧化物的含量。
2.3 肉品中胆固醇及其氧化物含量的测定
2.3.1 肉样中胆固醇含量变化 由图8可知,未冻融时,猪肉、牛肉、鸡胸肉和鸡腿肉中的胆固醇含量不同,随着冻融次数的增加,胆固醇含量逐渐减少,其中牛肉中的胆固醇含量变化最大,减少量最高从380.72~348.25 μg/g,减少了32.47 μg/g,可能是由于肉中所含不饱和脂肪酸带有多个双键,性质不稳定,随着冻融次数的增加,与环境中的氧发生氧化反应,氧吸收量急剧增加,由此产生的游离基和过氧化物进攻胆固醇的碳原子,使胆固醇自身产生游离基,引发链式反应,肉样中胆固醇含量就会降低[15],刘莉敏等[32]曾在研究中表明,猪肉和牛肉中的胆固醇含量分别为(52.72±6.19)和(49.98±12.31) mg/100 g,陈艳美等[33]曾对不同月龄槟榔江公水牛肉中胆固醇进行研究,其中成年期水牛胆固醇含量最低,为(22.65±3.70) mg/100 g(背最长肌),其研究结果均与本测定结果保持一致。

图8 反复冻融过程中肉样胆固醇含量的变化Fig.8 Changes in meat-like cholesterol content during repeated freezing and thawing
2.3.2 畜禽肉样中胆固醇氧化物含量的变化 由图9可知,鸡腿肉中的COPs含量变化随着冻融次数的增加而增加,冻融1次后5种COPs均大幅度增加,冻融3次后5种COPs均趋于平稳,其中5α,6α-环氧化胆固醇从未检出上升到0.48 μg/g、20α-羟基胆固醇从未检出上升到0.401 μg/g、25-羟基胆固醇从未检出上升到0.500 μg/g、7β-羟基胆固醇从未检出上升到0.601 μg/g、7-酮基胆固醇从未检出上升到0.170 μg/g。

图9 鸡腿肉中胆固醇氧化物含量变化Fig.9 Change in cholesterol oxide content in chicken thigh
由图10可知,鸡胸肉中的COPs含量变化随着冻融次数的增加而增加,在第3次冻融前除5α,6α-环氧化胆固醇外,其他COPs均有不同程度的增加,第3次冻融后逐渐趋于平稳。5α,6α-环氧化胆固醇冻融5次以内均从未检出,直到冻融到第7次(肉样将坏)时检出量为0.277 μg/g。7β-羟基胆固醇变化量最大,从未检出上升到0.600 μg/g。
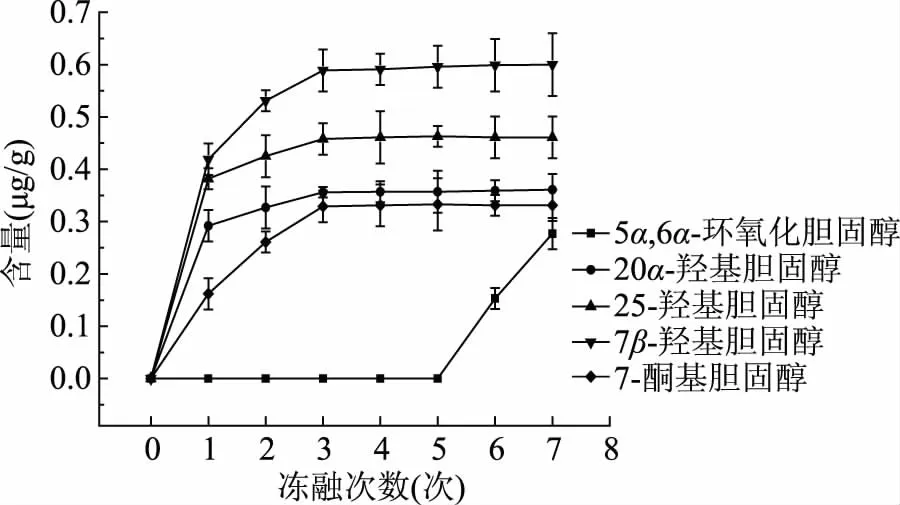
图10 鸡胸肉中胆固醇氧化物含量变化Fig.10 Change of cholesterol oxide content in chicken breast
由图11可知,牛肉中的COPs含量变化随着冻融次数的增加而增加,5种COPs在1个冻融周期后均大幅度增加,直至第4次冻融完成才趋于平稳,其中7β-羟基胆固醇增加量最多,从未检出上升到0.615 μg/g,比20α-羟基胆固醇的增加量高出了0.307 μg/g,且5α,6α-环氧化胆固醇的含量也高于鸡胸肉和鸡腿肉。

图11 牛肉中胆固醇氧化物含量变化Fig.11 Changes in the content of cholesterol in beef
由图12可知,猪肉中的COPs含量变化随着冻融次数的增加而增加,第1次冻融后5种COPs大幅度增加,第5次冻融后趋于平稳,但各氧化物间的差异不是很明显,猪肉中5种COPs的含量均高于牛肉、鸡腿肉及鸡胸肉,分析是由于其胆固醇含量较高导致,其中7β-羟基胆固醇从未检出上升到0.657 μg/g。

图12 猪肉中胆固醇氧化物含量变化Fig.12 Changes in the content of cholesterol in pork
综合图9~图12来看,肉冻融1次后,胆固醇含量相对较高,猪肉胆固醇含量最高为387.1 μg/g,COPs含量相对较低,其中含量最高的是猪肉中的5α,6α-环氧化胆固醇,含量为0.532 μg/g;冻融5次以上后,胆固醇含量大幅度降低,COPs含量上升。猪肉和牛肉因为胆固醇含量高于鸡肉,且与鸡肉相比含有较高的脂肪和血红素,更容易氧化,所以COPs含量要高于鸡肉。
2.4 反复冻融对肉品质的影响
肌肉在冷冻后,发生冷收缩,在解冻时会发生解冻僵直,肉的保水性变差,水分流失,同时由于肌纤维失去完整性[34],加速了脂肪氧化,丙二醛含量增加。
2.4.1 肉水分含量变化 由图13可知,随着肉样的反复冻融,肉样中的水分含量逐渐下降,其中猪肉中的水分减少量为14.236 g/100 g,牛肉中的水分减少量为11.188 g/100 g,鸡腿肉中的水分减少量为5.816 g/100 g,鸡胸肉中的水分减少量为14.472 g/100 g。肉中含量最多的成分是水,冻结过程中水分凝结形成冰晶,肌肉细胞受到机械性破坏,解冻时出现汁液流失,并导致肉中水分减少[35]。

图13 反复冻融过程中肉样水分含量变化图Fig.13 Changes of meat moisture content during repeated freezing and thawing
2.4.2 肉中丙二醛含量变化 由图14可知,冻融1次时鸡肉样中均未检出丙二醛,随着冻融次数增加,肉样中丙二醛含量增加,其中牛肉中丙二醛从未检出上升到1.004 μg/g,含量增加最多,可能是由于反复冻融过程中,自由基作用于脂质,发生过氧化反应,氧化终产物为丙二醛,从而引起蛋白质、核酸等生命大分子的交联聚合,使之具有细胞毒性[36]。结果表明,新鲜肉样中不含丙二醛,随着冻融次数的增加,丙二醛含量也逐渐增加,与胆固醇氧化物形成趋势相同。

图14 反复冻融过程中肉样丙二醛含量变化Fig.14 Change of malondialdehyde content in meat samples during repeated freezing and thawing
3 结论
本实验采用气相色谱-质谱联用测定了反复冻融后鸡肉、牛肉、猪肉中胆固醇及其氧化物的含量变化。结果表明:新鲜肉中不存在COPs,反复冻融造成胆固醇的含量逐渐减少,COPs含量增加,其中牛肉中的胆固醇含量减少尤为明显,减少量为32.47 μg/g。鸡腿肉中7β-羟基胆固醇含量增加最为明显,增加量为0.601 μg/g,减少的胆固醇转化成COPs以及其他物质,过程比较复杂,5种COPs的含量随着冻融次数的增加而增加,最终趋于平衡。
对反复冻融过程中畜禽肉中水分进行测定,发现水分含量随着冻融次数增加而减少,新鲜肉中不含丙二醛,反复冻融后,肉中产生丙二醛,其含量随冻融次数增加而增加,这与胆固醇氧化物形成趋势一致,反映出畜禽肉冻融过程中自由基作用于脂质发生了氧化反应。建议生产和生活过程中要尽量避免肉的反复冻融。

