同型半胱氨酸通过氧化物酶增殖物激活受体α-肝脏X核受体α通路导致动脉粥样硬化的机制研究
代 佩,高 奋,高宏伟,王 远,冯高洁,白 瑞,秦卫伟,宋晓苏,李 虹
(山西医科大学第二临床医学院心内科,太原 030001;*通讯作者,E-mail:gao55555@sina.com)
高同型半胱氨酸(homocysteine,HCY)是导致动脉粥样硬化(atherosclerosis,AS)的独立危险因素之一[1]。HCY可以通过氧化应激、促进炎症反应、损伤内皮细胞、抑制胆固醇逆转运多种机制导致AS,研究证实HCY可以降低ABCA1、ABCG1的表达抑制胆固醇逆转运[2],关于HCY与胆固醇逆转运两者之间相关性是本实验研究的重点。
胆固醇逆转运(reverse cholesterol transport,RCT)是排出体内多余胆固醇的主要途径,参与RCT过程的关键酶三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)主要与贫脂载脂蛋白A-Ⅰ(apolipoprotein A-I,ApoA-Ⅰ)结合,目的使前体高密度脂蛋白(β-HDL)成为成熟的高密度脂蛋白(high density lipoprotein,HDL),三磷酸腺苷结合盒转运体G1(ATP-binding cassette transporter G1,ABCG1)则直接将胆固醇转运至成熟HDL进一步代谢,而卵磷脂胆固醇转移酶(lecithin cholesterol transferase,LCAT)有助于新生HDL酯化成熟的HDL,且ApoA-Ⅰ是LCAT的主要生理激活剂,研究证实动脉粥样患者的ApoA-Ⅰ水平降低,伴随LCAT水平也会降低,因此LCAT不仅参与HDL成熟而且全程参与胆固醇代谢[3,4]。
过氧化物酶增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)和肝脏X核受体α(liver X nuclear receptor α,LXRα)参与与体内脂质代谢,研究证实其可通过视黄醛受体(retinoid X receptor,RXR)/LXR途径上调胆固醇逆转运的关键酶ABCA1、ABCG1、ApoA-Ⅰ的表达,促进胆固醇逆转运,减少脂质聚集,因ApoA-Ⅰ是LCAT的主要生理激活剂,研究证实动脉粥样患者的ApoA-Ⅰ降低[5],因此本研究探讨HCY是否通过PPARα-LXRα通路调节RAW264.7巨噬源性泡沫细胞ABCA1、ABCG1、LCAT的表达及细胞内胆固醇的流出,促进脂质聚集,抑制RCT,导致AS。
1 材料与方法
1.1 细胞株与主要试剂和仪器
与鼠单核巨噬细胞(细胞代号RAW264.7 ATCC,USA),同型半胱氨酸(北京索莱宝公司),ox-LDL(北京欣和佳源公司),DMEM培养基(武汉博士德生物公司),胎牛血清(杭州四季青生物工程材料研究所),RNA提取试剂、Trizol(北京索莱宝公司),逆转录试剂盒(宝生物工程(大连)有限公司),3H胆固醇(美国American Life Science公司)。CO2培养箱(Thermo公司,美国),PCR仪、酶标仪(Bio-Rad,美国),相差倒置显微镜(Nikon TS100),FJ22107P液体闪烁计数仪(国营二六二厂),低温离心机(Eppendorf公司,德国)电子天平(Sartorius公司,德国),酸碱度仪PB-10(Sartorius公司,德国)。
1.2 RAW264.7巨噬细胞的培养及诱导
从液氮罐中取出冻存的RAW264.7巨噬细胞,置于25 cm2的培养瓶中,用DMEM培养基(10%胎牛血清,1%青、链霉素钠),在37 ℃、5% CO2条件下培养,在细胞生长良好的状态下,待细胞覆盖培养瓶的80%-90%时,用含0.25%的胰蛋白酶消化并按(1 ∶4)进行传代。细胞传2-3代,取生长较好的对数期细胞经消化、离心、计数,每孔按1.8×106个/ml细胞接种6孔板,培养箱孵育12 h,,每孔再加入50 mg/L ox-LDL诱导,同时更换DMEM培养基(4%胎牛血清,1%青、链霉素钠)孵育24 h,油红“O”染色观察泡沫细胞是否诱导成功,诱导成功后的泡沫细胞给予不同浓度梯度的HCY干预24 h进行实验。
1.3 实验分组
将RAW264.7源性泡沫细胞细胞分成5组:空白对照组(即正常的RAW264.7细胞组),0.5 mmol/L HCY组,1.0 mmol/L HCY组,2.0 mmol/L HCY组,5.0 mmol/L HCY组。
1.4 油红染色
提前按照说明书配置油红“O”染色液,吸去培养液,预冷的PBS液清洗3次细胞;4%中性甲醛固定10 min,按上述方法再次清洗;每孔加入约1.5 ml油红“O”染色液染色30 min,荧光倒置显微镜下(×20)观察是否诱导为泡沫细胞。
1.5 Western blot检测PPARα、LXRα和ABCA1、ABCG1、LCAT蛋白表达水平
吸去培养液,用预冷PBS(pH7.4)清洗3次细胞;按100 ∶1比例加入细胞裂解液和蛋白酶抑制剂,刮刀刮下细胞,静置20-30 min将裂解的蛋白装入有标记EP管经超声波粉碎机粉碎、离心(12 000g10 min 4 ℃),将上层液体(即收集的蛋白)移入另一EP管,直接用于实验或-80 ℃保存。用BCA蛋白定量法测定蛋白浓度,根据凝胶配置试剂盒说明书进行配胶,经聚丙烯酰胺凝胶电泳、转膜将蛋白转移至PVDF膜上,用含5%含牛奶TBST封闭2 h后孵育一抗,4 ℃摇床过夜,TBST洗膜(5 min 3次),室温摇床孵育二抗2 h,再次洗膜后进行曝光(超敏ECL法)。以目的蛋白和β-actin密度比值表示目的蛋白表达水平。
1.6 实时定量PCR检测PPARα、LXRα和ABCA1、ABCG1、LCAT mRNA表达
不同浓度梯度HCY干预泡沫细胞后,用预冷的PBS(pH7.4)液清洗细胞3次,按照Trizol试剂说明书提取RNA,紫外分光光度计测定RNA的浓度和纯度,使RNA的A260/A280保持在1.9-2.1之间,按照TaKaRa逆转录试剂盒说明书合成cDNA。基因引物序列见表1,GAPDH为内参。PCR扩增反应条件为:95 ℃预变性30 s,95 ℃ 5 s、60 ℃ 40 s循环40次。运用2-ΔΔCt进行分析。

表1 目的基因与内参基因的上下游引物序列Table 1 Upstream and downstream primer sequences of the target gene and the internal reference gene
1.7 液体闪烁计数法分析胆固醇流出率
将RAW264.7源性泡沫细胞用3H标记的胆固醇负荷培养24 h,用PBS(pH7.4)液清洗2次,更换新的培养液按上述实验方案进行,干预后的细胞用PBS(pH7.4)洗涤细胞,培养于25 μg/ml载脂蛋白A-Ⅰ(apolipoprotein,apoA-Ⅰ)的新鲜培养基6 h,用裂解液裂解细胞,通过液体闪烁计数法检测相关实验指标。通过下面公式计算:胆固醇流出率=培养液(count/min)值÷[培养液(count/min)值+细胞(count/min)值]×100%。
1.8 高效液相色谱分析细胞内胆固醇含量
干预后的RAW 264.7巨噬源性泡沫细胞,按上述方法清洗细胞后,加入一定量的0.5% NaCl溶液,超声波粉碎10 min,将裂解的液体分成两份,一份用于提取总胆固醇,一份用于提取游离胆固醇。提取好的胆固醇通过Waters反向C18柱测量方式,流动相为异丙醇 ∶乙腈(50 ∶50),分别以流速1 ml/min,柱温40 ℃,将每组实验提取到的20 μl样品溶液按上述色谱条件测量,记录胆固醇的峰面积。计算总胆固醇量(total cholesterol,TC)和游离胆固醇(free cholesterol,FC)量,总胆固醇量减去游离胆固醇量为胆固醇酯(cholesteryl ester,CE)的量。
1.9 统计学处理
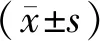
2 结果
2.1 油红“O”染色观察细胞内脂滴含量
在相差倒置荧光显微镜20倍镜下观察油红“O”染色后的细胞状态,结果是对照组未见橘黄色脂滴(见图1A),ox-LDL诱导成功的RAW 264.7巨噬源性泡沫细胞经油红“O”染色可见含橘黄色脂滴,且随HCY浓度梯度增加,细胞内的脂滴数量逐渐增加(见图1B-E)。
2.2 Western blot检测PPARα、LXRα和ABCA1、ABCG1、LCAT蛋白表达的结果
经ox-LDL诱导成为RAW264.7巨噬源性泡沫细胞,再给与不同浓度梯度HCY干预,Western blot检测结果显示,HCY干预组与空白对照组相比较PPARα、LXRα、ABCA1、ABCG1和LCAT的蛋白表达量均降低,差异具有统计学意义(P<0.05);随HCY浓度增加,各组HCY浓度越高,PPARα、LXRα、ABCA1、ABCG1和LCAT的蛋白表达量越低,差异具有统计学意义(P<0.05,见图2)。
2.3 实时定量PCR检测PPARα、LXRα和ABCA1、ABCG1、LCAT mRNA表达结果
经ox-LDL诱导成为RAW264.7巨噬源性泡沫细胞,再给与不同浓度梯度HCY干预,实时定量PCR检测结果显示,HCY干预组与空白对照组相比较PPARα、LXRα、ABCA1、ABCG1和LCAT的mRNA表达量均降低,差异具有统计学意义(P<0.05);而且随HCY浓度增加,PPARα、LXRα、ABCA1、ABCG1和LCAT的mRNA表达量降低,差异具有统计学意义(P<0.05,见图3)。

图1 油红“O”染色观察RAW264.7巨噬细胞内脂滴含量(×20)Figure 1 Oil red “O” staining of intracellular lipid droplets in RAW264.7 macrophages (×20)

与对照组比较,aP<0.05;与5.0 mmol/L组相比较,bP<0.05;与2.0 mmol/L组相比较,cP<0.05;与1.0 mmol/L组相比较,dP<0.05;与0.5 mmol/L组相比较,eP<0.05图2 Western blot检测RAW264.7巨噬源性泡沫细胞中相关指标蛋白表达Figure 2 Expression of related proteins in RAW264.7 macrophages-derived foam cells by Western blot

与对照组比较,aP<0.05;与5.0 mmol/L组相比较,bP<0.05;与2.0 mmol/L组相比较,cP<0.05;与1.0 mmol/L组相比较,dP<0.05;与0.5 mmol/L组相比较,eP<0.05图3 实时定量PCR检测RAW264.7巨噬源性泡沫细胞中相关mRNA表达Figure 3 Expression of related mRNAs in RAW264.7 macrophages-derived foam cells by RT-PCR
2.4 液体闪烁计数法检测细胞内胆固醇的流出
经ox-LDL诱导成为RAW264.7巨噬源性泡沫细胞,再给与不同浓度HCY干预,液体闪烁计数法检测细胞内胆固醇流出率,结果表明,HCY干预组与空白对照组相比较胆固醇流出率均降低,差异具有统计学意义(P<0.05);随HCY浓度增加,胆固醇流出率降低,差异具有统计学意义(P<0.05,见图4)。

与对照组比较,aP<0.05;与5.0 mmol/L组相比较,bP<0.05;与2.0 mmol/L组相比较,cP<0.05;与1.0 mmol/L组相比较,dP<0.05;与0.5 mmol/L组相比较,eP<0.05图4 液体闪烁计数法测RAW264.7巨噬源性泡沫细胞内胆固醇的流出Figure 4 Determination of intracellular cholesterol efflux rate in RAW264.7 macrophages-derived foam cells by liquid scintillation counting
2.5 高效液相色谱分析细胞内胆固醇含量
经ox-LDL诱导成为RAW264.7巨噬源性泡沫细胞,再给与不同浓度梯度HCY干预,高效液相色谱检测细胞内胆固醇含量,结果表明,HCY干预组与空白对照组相相比较胆固醇含量均增加,差异具有统计学意义(P<0.05);随HCY浓度增加,胆固醇含量升高,差异具有统计学意义(P<0.05,见表2)。

表2 高效液相色谱分析RAW264.7巨噬源性泡沫细胞内胆固醇含量Table 2 Analysis of intracellular cholesterol by high performance liquid chromatography
TC:总胆固醇;FC:游离胆固醇;CE:胆固醇酯;对照组比较,aP<0.05;与5.0 mmol/L组相比较,bP<0.05;与2.0 mmol/L组相比较,cP<0.05;与1.0 mmol/L组相比较,dP<0.05;与0.5 mmol/L组相比较,eP<0.05
3 讨论
动脉粥样硬化(AS)是冠心病的病理基础,脂质代谢异常是导致AS的主要机制,泡沫细胞的形成是AS的起始标志之一,如何阻断泡沫细胞的形成仍是目前研究的重点[6]。
高同型半胱氨酸(HHCY)为导致冠心病的独立危险因素,血管造影证实总HCY水平是预测冠状动脉疾病死亡率的强有力的因子[7]。HCY通过氧化应激、炎症反应、损伤内皮细胞、促进血栓形成及抑制胆固醇逆转运等多种途径导致AS,.本实验主要研究HCY与血脂代谢及RCT之间的相关性,ABCA1、ABCG1作为ATP结盒转运蛋白(ATP-binding cassette transporter,ABC)家族的成员,主要参与能量和脂质代谢[8],相关研究证实HCY可下调RCT过程中的关键酶如ABCA1、ABCG1的表达抑制胆固醇逆转运,促进脂质聚集[9]。RCT是以HDL为载体排出体内多余胆固醇的主要途径,ABCA1通过细胞表面ApoA-Ⅰ将新生盘状HDL即不成熟HDL转变为成熟HDL,且ABCA1介导的胆固醇外流是RCT的第一步也是其限速步骤,ABCG1直接将胆固醇直接转运至成熟HDL进行代谢[8]。1962年,Glomset[10]发现LCAT是由肝脏分泌的一种糖蛋白,体内大约80%的胆固醇酯通过LCAT代谢,说明其在胆固醇代谢中不可缺少,体内LCAT通过酯化作用促进HDL的成熟而参与胆固醇的代谢,且HDL中apoA-Ⅰ是LCAT的唯一激活剂,动脉粥样患者体内ApoA-Ⅰ明显降低,会间接导致体内LCAT水平降低[11]。同时研究证实LCAT还可以通过上调ABCA1和ABCG1的表达及细胞内外浓度梯度间的被动扩散转运胆固醇等多种方式参与RCT[12]。Ly等[13]和Kunnen等[14]均证实LCAT是促进胆固醇向肝脏转运的关键酶之一。因此我们提出假设HCY影响胆固醇逆转运时直接影响LCAT的表达。实验结果证实,与空白对照组比较,HCY干预组ABCA1、ABCG1、LCAT的表达量均降低(P<0.05),细胞内的胆固醇含量逐渐增高(P<0.05)。而且随HCY浓度增加,ABCA1、ABCG1、LCAT的表达量逐渐降低(P<0.05),细胞内的胆固醇含量逐渐增高(P<0.05)。因此HCY可下调ABCA1、ABCG1、LCAT表达,影响胆固醇逆转运,导致脂质聚集增加,进而加重AS病变。
过氧化物酶增殖物激活受体α(PPARα)和肝脏X核受体α(LXRα)做为核受体超家族的成员,结合相应配体后,再与视黄醛受体(retinoid X receptor,RXR)形成异二聚体具有活性,主要参与脂类代谢、促进胆固醇流出[15]。Rubic等[16]研究证实活化后的PPARα可上调与HDL代谢有关的酶:ABCA1、ABCG1、apoA-Ⅰ,同时还增加脂肪酸的氧化,减少脂肪堆积。Zeng等[17]研究发现LXR在RCT整个过程中均发挥作用,其调节的靶基因主要包括ABC家族、Apo E等,在巨噬细胞实验中发现其可上调ABCA1和ABCG1的表达,将胆固醇经apoA-Ⅰ转运至HDL进行代谢,同时降低泡沫细胞的形成。吕湛等[18]在研究中证实在巨噬细胞通过PPARα摄取低密度脂蛋白的过程可以促进LXRα的释放,同时LXRα上调ABCA1和ABCG1的表达而促进胆固醇的流出,说明PPARα和LXRα具有协同作用,且都是通过调节ABCA1、ABCG1的表达发挥作用。因此,我们提出假设HCY通过PPARα-LXRα影响胆固醇逆转运。结果证实,与空白对照组比较,HCY干预组PPARα和LXRα的表达量均降低(P<0.05),细胞内的胆固醇含量逐渐增高(P<0.05)。而且随HCY浓度增加,PPARα和LXRα的表达量逐渐降低(P<0.05),细胞内的胆固醇含量逐渐增高(P<0.05)。因此HCY可通过抑制PPARα-LXRα通路下调胆固醇逆转运的关键酶:ABCA1、ABCG1、LCAT表达,降低胆固醇逆转运效率,导致脂质聚集增加,进而加重AS病变。
综上所述,HCY做为冠心病的独立危险因素,HCY可通过抑制PPARα-LXRα通路下调ABCA1、ABCG1、LCAT表达,影响胆固醇逆转运,导致脂质聚集增加,明确HCY与胆固醇逆转运之间的相关性。这不仅有助于阐明HCY致动脉粥样硬化的新机制,更为心血管疾病的发病机制和治疗靶点提供新的思路。

