不同生境下的象头花光合生理特性探究
陈金珠,黎云祥,杨佳,何理,权秋梅,*
1.西华师范大学生命科学学院,南充 637002
2.西华师范大学环境科学与工程学院,南充 637002
0 前言
光合作用的研究历史悠久,1772年Priestly 便揭示了光合作用就是呼吸作用的逆反应[1]。光合作用作为植物生命的维系,是所有植物生存和发展最为关键的生理过程。同时,光合作用受到生态环境的影响,这使得植物形成了适应环境的形态结构和生理调节特征[2]。目前,对环境因子影响植物光合作用的理解来自植物光合作用对光的响应[3-4]。通过恰当的光合模型拟合植物光响应曲线可得到许多具有参考价值的光合生理参数(诸如最大净光合作用速率Pmax、光饱和点LSP、光补偿点LCP、表观量子效率AQY以及暗呼吸速率Rd),可用以描述植物光合作用能力及环境适应性能评价[5-6]。国内外已建构的多种光合模型,不同模型对不同植物的适应性各不相同[7-11]。因此,对于模型的选取应当对比验证,需考量模型的准确性以及与实际测量值的相符程度。除模型拟合外,当前进行了诸多控制性试验,通过人工控制外部环境因子水分、温度、光照等,从而改变植物气孔导度、蒸腾与光合作用速率,影响植物的生长状况[12-15]。但对于自然生境中植物的光合速率变化的探索仍相对匮乏。
在对天南星属(Arisaema)植物的研究和文献调查中显示象头花(Arisaema franchetianumEngl.)为我国特有物种。具药用功能,以块茎入药,有解毒消肿,散结止痛之效[16-17]。中药质量评价当中象头花抗肿瘤和镇咳祛痰效果较佳,现已能从其块茎中分离出18 种化合物主要是生物碱及酰基甘油糖苷[18-19]。现已知对该属植物的研究主要集中在化学成分提取及分析[19-20]、药理作用研究[21-22]、种植生产等方面[23]。为合理的开发象头花资源,我们探究不同的自然环境因子下象头花光合生理特性,为象头花的生理生态和栽培繁殖研究提供参考。
1 材料与方法
1.1 研究区域概况
唐家河国家级自然保护区(32°32′—32°41′N,104°36′—104°56′E),隶属四川省青川县,岷山山系,总面积40000 hm2。该区雨量充沛,温暖湿润,属亚热带季风气候。1月平均温度1.8 ℃,最高温度5.3 ℃,最低温度-11 ℃,6—8月气候温凉,平均温度13.1— 14.2 ℃,最高为22.6—24.7 ℃。年降雨量1100—1300 mm,无霜期180 d[25]。整个保护区植被类型包括山地常绿阔叶林、常绿与落叶阔叶混交林、针阔混交林、亚高山针叶林和高山灌丛与高山草甸[26],土壤类型有山地黄壤、山地黄棕壤、山地灰棕壤和山地棕色灰化土等[25]。其丰富的植被与土壤资源,孕育了大量的野生动植物。
1.2 实验方法
实验于8月22 号至8月24 号,晴朗天气的上午进行。因其地下块茎多年生,地上部分每年死亡[16],我们在林缘、林下两种常见生境各选取3 株长势相近的健康植株,测量其生长旺盛的新叶的光响应曲线。具体而言,使用Li-6400XT(LI-COR,Lincoh,USA)便携式光合作用测量系统,红蓝LED 光源,Light curve2自动测量系统,CO2浓度400 μmol·mol-1,叶室温度25 ℃,空气流速500 μmol·s-1,光合有效辐射梯度为2000、1800、1600、1400、1200、1000、800、500、250、120、60、30、15、0 μmol·m-2·s-1。而后,通过模型(表2)拟合光合有效辐射PAR与光合速率Pn,绘制曲线图,获取光合参数,筛选出最适模型;分析光响应曲线同步输出的光合因子参数(气孔导度Cs、蒸腾速率Tr、胞间CO2浓度Ci)和环境因子参数(样品室CO2浓度CO2S、空气温度Tair、样品室相对湿度RH-S、叶室外光合有效辐射PARO)与Pn的相关性并绘制曲线图。为初步比较林缘、林下两种生境环境因子的差异,在测量期间使用GARMIN GPS 导航仪定经纬度与海拔定位;利用FIELDSCOUT3413 照度计、KIMO HD100 温湿度计分别测量两种生境中各10 个个体周围的光照、温度、湿度三个环境因子。最后,为探讨饱和光强下不同生境植株这些因子的差异显著性以及对植株长势的影响,我们根据光响应曲线得出的饱和光强,将光合辐射设为500 μmol·m-2·s-1其余设定同光响应曲线,测量饱和光强下两种生境中各10 个个体的光合因子,并记录每个测量个体株高、直径、叶长、叶宽。每次实验至少3 次重复,最后取用均值。
2 数据分析
2.1 数据分析模型及检验公式
在曲线拟合的过程当中,选取了最为常见的五种模型如表1进行拟合。各式相同的字符含义相同。(1)式中Pn:净光合速率;φ:初始量子效率;Pmax:最大净光合速率;I:光合有效辐射;Rd:暗呼吸速率;(2)式中θ:光响应曲角,反应光响应曲线弯曲程度,取值0<θ≤1;公式(1)、(2)计算时需要估算植物的饱和光强,为了估算植物的饱和光强,就需要用直线方程拟合弱光强条件下 (PAR≤200 μmol·m-2·s-1)的光响应数据得到表观量子效率(AQY),然后解直线方程:Pmax=AQY×LSP-Rd可以得到光饱和点(LSP)[26-27]。(3)式α:I=0 和I=Ic 时,两点连线的斜率;β:修正系数;γ:为光饱和项,光响应曲线初始斜率与最大净光合速率之比,即γ=α/Pmax;LCP:光补偿点[9]。公式(4)估算植物的饱和光强时需要假定光合速率为0.9Pmax或 0.99Pmax(5)式中当I=0 时,Rd=0;当Pn=0 时,光补偿点当I=0 时,光响应曲线在该点的斜率为内禀量子效率φ0=Pn´(I=0=-αβ+γε);当αβ=γε时,Pn´=0,Pn存在最大值;公式(3)、(5)可以直接计算植物的饱和光强和最大净光合速率[10-11]。
1.4 数据处理
数据基本处理、光合参数计算、作图均由Microsoft Excel 2010 完成,模型公式基本参数计算、皮尔逊相关性检验、单因素方差分析均由SPSS 23.0 完成。
3 结果与分析
3.1 五种模型光响应曲线拟合
5 种模型的象头花净光合速率光响应曲线如图1所示。由图1A 看出林缘象头花的净光合速率Pn随着光合有效辐射PAR的增加先迅速增加(PAR<250 μmol·m-2·s-1),而后缓慢增大至光饱和点LSP。达到500 μmol·m-2·s-1时,随着PAR增强Pn呈现出略微下降的趋势,故林缘象头花的光响应曲线在强光阶段(PAR>500 μmol·m-2·s-1)的表现为弱度抑制型[28]。图1B 中林下象头花的光响应曲线在PAR<500 μmol·m-2·s-1阶段的走势与林缘象头花走势相近,而后随着PAR增强Pn呈现出明显的下降趋势,因而林下象头花的光响应曲线在强光阶段表现出强度抑制型[28]。
光合生理参数常用于衡量植物的光合作用能力,但诸如光补偿点LCP、最大净光合速率Pmax等无法进行直接的测量,模型模拟计算逐渐的成为了计算光合生理参数主要手段[5]。象头花模型拟合参数见表2。其中,决定系数R2反应了拟合的精确程度,其越接近1 表示相关方程的参考价值越高[29]。林缘、林下两种生境中的R2均大于0.9,说明5个模型均满足拟合的精度要求。从R2来判断,非直角双曲线模型、直角双曲线修正模型、指数模型、改进指数模型对林缘的光响应曲线拟合效果均较好;林下的光响应曲仅有改进指数模型具有较好的拟合效果。无论是在林缘还是林下5 个模型均能一定程度的拟合出光响应过程中的生理参数,但其中4 个模型拟合的LSP均远低于实测值,仅有改进指数模型能较好的拟合出LSP。此外,改进指数模型能较好的拟合出最大净光合速率Pmax、光补偿点LCP、暗呼吸速率Rd与表观量子效率AQY,其拟合值均与实测值较为相符。鉴于此,改进指数模型为林缘、林下两种生境象头花光响应曲的最适拟合模型。

表1 五种光响应模型 Table1 Five kinds of light response models

图1 五种模型拟合不同生境象头花的光响应曲线,林缘(A)、林下(B)) Figure1 Photosynthesis-light response curve of five fitted models of A.franchetianum Engl.in different habitats under-canopy (A) and gap edge (B)

表2 5 个模型各项光合参数与实测值的比对 Table2 Comparison of the photosynthetic parameters of five models with measured values
3.2 净光合速率与光合因子的相关性
由表3可知,林缘象头花的净光合速率Pn与气孔导度Cs、蒸腾速率Tr、空气温度Tair、和样品室相对湿度RH-S的相关系数分别为 0.902**、0.914**、0.814**、0.894**,呈显著正相关关系(P<0.01);而与胞间CO2浓度Ci、样品室CO2浓度CO2S的相关系数分别为-0.951**、-0.981**,呈显著负相关关系(P<0.01);林下象头花的Pn与Cs、Tr、Tair、RH-S和PARO的相关系数分别为0.931**、0.907**、0.883**、0.903**、0.725**,呈显著正相关关系(P<0.01);而与Ci的相关系数分别为-0.972**,呈显著负相关关系(P<0.01);与CO2S无明显的相关性。
3.3 光合因子随光照辐射的变化
如图2A 所示,随光照辐射的增强,林缘、林下象头花叶片的气孔导度Cs均呈现出上升趋势,在PAR为800μmol·m-2·s-1时达到峰值;且林下生境中象头花叶片的Cs始终高于林缘生境中象头花叶片Cs。图2B 中林缘、林下两种生境中的胞间CO2浓度Ci均随着光照辐射的增强呈现出明显下降的趋势,且林缘的Ci在光照辐射的增强的整个过程中几乎均低于林下的Ci。图2C 中,林缘、林下象头花叶片的蒸腾速率Tr与Cs的走势一致,均随光照辐射的增强呈现出上升趋势,且在PAR为800 μmol·m-2·s-1时达到峰值,林缘象头花叶片的Tr在相同的光照辐射下总是低于林下象头花叶片的Tr。图2D 中的水分利用效率WUE来自光合速率与蒸腾速率的比WUE=Pn/Tr,其反应了植物对水分的利用情况[30]。由图2D可知,林缘、林下象头花叶片的WUE均随光照辐射的增强呈现出先上升(PAR<250 μmol·m-2·s-1)而后处于3.5 μmolC02·molH2O-1水平呈上下波动,波动范围在34 μmolC02·molH2O-1。最后,图2E 中的林缘、林下象头花叶片的Pn随光照辐射的增强呈现出先上升(PAR<250 μmol·m-2·s-1)的趋势,而后林缘Pn趋于稳定水平,仅林下Pn呈现出略微下降趋势;但自(PAR>120 μmol·m-2·s-1)开始,同等光照强度下林下Pn总是大于林缘Pn。
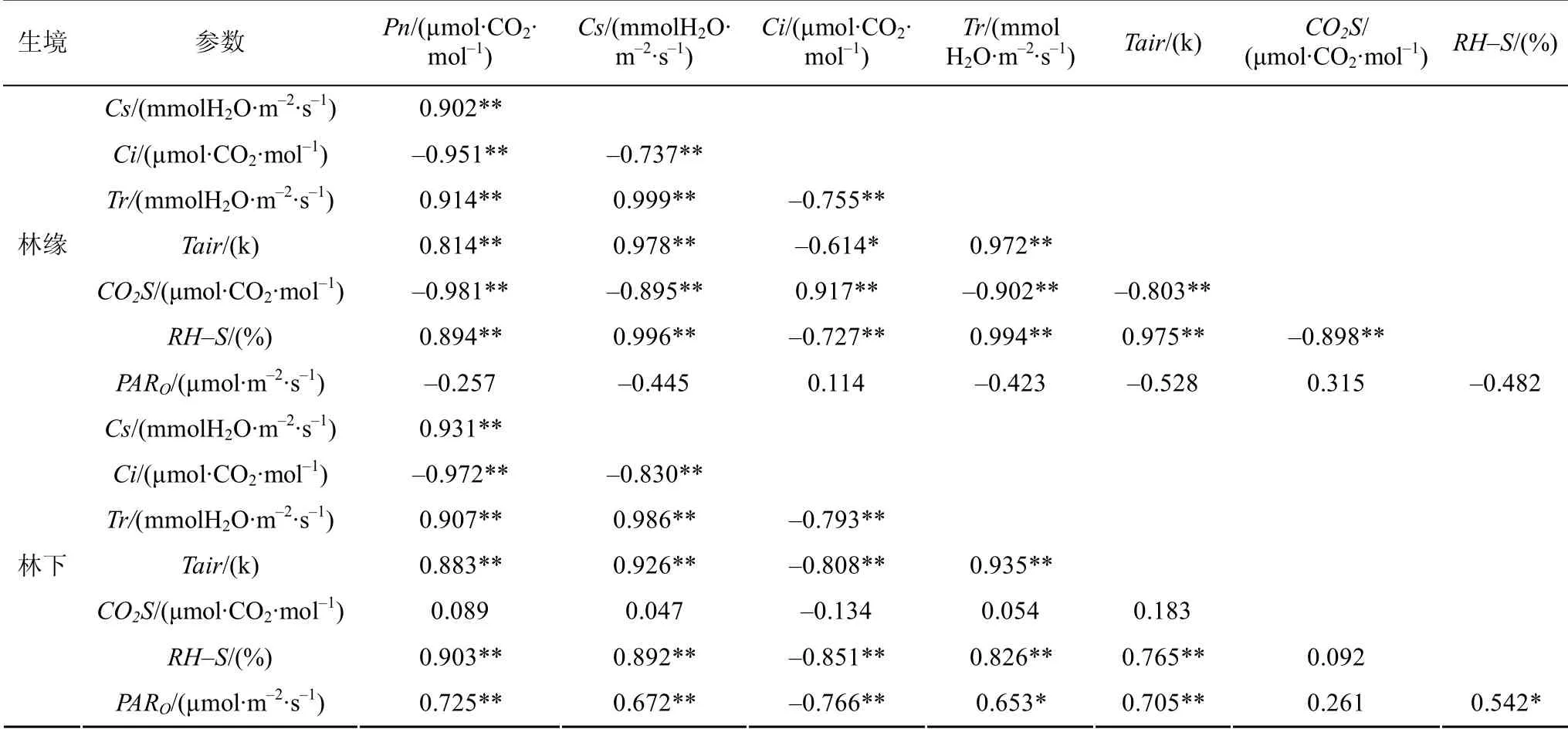
表3 不同生境净光合速率参数相关性分析 Table3 Correlation analysis of Pn parameter in different habitats
3.4 饱和光强下光合因子对比
由表4可见,温度、湿度在林缘和林下两种生境中均未见明显差异,光强差异显著(P<0.05),即林缘的光强高于林下的光强。表5中光合速率Pn、气孔导度Cs和蒸腾速率Tr差异显著(P<0.05),且林下的这三个指标均高于林缘。其余参数均未见明显差异;两种生境的光强均设置在了饱和点水平,结合光响应曲线中的Ci的情况来看,两种生境中Cs与Tr对象头花Pn的影响更大。
3.5 植株长势对比
对比林缘、林下象头花植株的长势(表6),可知林缘、林下的象头花的株高、叶长、叶宽的呈显著差异(P<0.05),而象头花直径未见显著差异(P> 0.05)。同时林下象头花株高、叶长、叶宽均大于林缘象头花。林下株高、叶长、叶宽分别达到了(10.27±1.01) cm、(14.4±1.0) cm、(69.87±0.61) cm;而林缘分别为(7.93±3.93) cm、(11.6±0.52) cm、(8.43±0.06) cm。由此可见,处于林缘生境当中的象头花长势更好,这也与林下环境中象头花的光合作用能力强有助于象头花对于有机物的积累相对应。
4 讨论
在象头花最适模型的筛选过程中,改进指数模型为林缘、林下两种生境中象头花光响应曲线的最适模型。LSP反应了植物Pmax的最大需求光照,根据最适模型拟合的参数可见,林缘的LSP为516.405 μmol·m-2·s-1,林下的LSP为638.500 μmol·m-2·s-1,这说明林下象头花在达到最大光合速率时对光照的需求高于林缘的象头花。而林下的LCP为8.142 μmol·m-2·s-1高于林缘的LCP为5.498 μmol·m-2·s-1,这说明林缘象头花对环境的适应性更强。研究表明植物的AQY范围为0.03—0.07[34],而林缘的AQY为0.029 μmolCO2·μmol-1,林下的AQY为0.038 μmol CO2·μmol-1;林缘AQY处于最低值边缘,林下的AQY也处于较低水平。因此,林下象头花相对于林缘象头花对光照的利用效率更高,但是从整体来说两种生境中的象头花对光照的利用效率均处于较低水平。其LSP、LCP、AQY均较低具有阴生植物的特性[35]。暗呼吸是植物新陈代谢重要的生理过程,其反应了植物自身消耗情况;林缘的Rd为0.068 μmol·m-2·s-1明显低于林下的Rd为0.159 μmol·m-2·s-1,林下象头花的生理活性更强,并不利于有机物的积累。但是,林下象头花的最大净光合速率Pmax为6.740 μmol·m-2·s-1明显高于林缘Pmax为4.290 μmol·m-2·s-1,那么林下象头花的有机物的生产量也更多。这是因为不同生境中植物对资源的投资与分配会有所不同,这是植物与其生境长期适应和进化(生境选择)的结果[36]。

图2 象头花光合生理参数对不同光合有效辐射的响应 Figure2 Photosynthetic physiological factors of A. franchetianum Engl.response to different PARs

表4 不同生境的环境因子 Table4 Environment factor of in different habitats

表5 不同生境的净光合速率参数 Table5 Pn parameter in different habitats

表6 不同生境植株长势 Table6 Growth potential of plant in different habitats
植物进行光合作用,或多或少的都因受到了外部环境的影响,研究表明影响植物光合作用的因子复杂且多变[37],而且这些因子对光合作用的影响不仅是综合的,而且因子之间也会相互影响[8]。本实验中,将两种生境当中象头花的净光合速率与光合因子进行相关性分析,结果表明林缘象头花的Pn与气孔导度Cs、蒸腾速率Tr、空气温度Tair、和样品室相对湿度RH-S、胞间CO2浓度Ci和样品室CO2浓度CO2S均相关性极为显著(P<0.01);而林下象头花的Pn除与Cs、Tr、Tair、RH-S、Ci相关性极为显著(P<0.01)外,还与PARO相关性极为显著(P<0.01),这说明光照对林下象头花的影响大于对林缘生境中象头花的影响。结合两种生境当中光合因子随光照辐射的变化看来,在同等的光照条件下林下的象头花叶片不管是Cs、Tr还是Ci均高于林缘生境中的象头花;两种生境当中象头花叶片的水分利用效率WUE虽不相上下但是最终林下象头花的光合作用能力更强。这与其同类植物半夏(Pinellia ternata)的生长特性研究结果一致[38]。
饱和光强是植物进行光合作用的理想光照条件,有研究指出生境和植物类型对气孔响应行为具有显著影响[39],叶片对光照亦具有不同的适应策略[40]。本实验中,林缘、林下的自然环境因子除光强外温度、湿度均未见明显差异,仅林缘的光强高于林下的光强。在测量过程当中,将林缘、林下的象头花叶片均置于饱和光强下,同时保障两种生境空气温度Tair、样品室CO2浓度CO2S、叶室外光合有效辐射PARO和胞间CO2浓度Ci均处于相似水平条件,即Tair、CO2S、PARO和Ci均未见明显差异。研究发现,林下的气孔导度Cs和蒸腾速率Tr均高于林缘,那么林下的气孔响应更为积极,与之对应的光合速率Pn也自然更大。象头花对林下生境的适应,也造就了林下象头花在相同的光照条件下其光合作用能力强于林缘象头花,这与上文林缘、林下两种生境光响应曲线中净光合速率的变化图2E 相一致。林下高的Pn理因使得林下的象头花植株长势好于林缘的象头花,从表6可见林下象头花也的确实现了株高、叶长、叶宽均大于林缘象头花。但象头花为多年生草本,以块茎入药,是否高的地上茎、叶投入与地下块茎的生长情况相匹配,还有待进一步探究。
综上所述,5 种模型中改进指数模型是拟合两种生境中象头花光响应曲线的最优模型,更符合植物的生理学意义。Cs、Tr、Tair、RH-S、Ci等光合作用因子均与象头花的Pn密切相关。林缘、林下两种生境中的自然环境因子温度、湿度未见明显差异,仅林缘光照高于林下光照,但是由于象头花叶片对林下生境的适应,林下象头花叶片的光合作用能力强于林缘。林下象头花的植株长势也好于林缘。
本文只是对生长旺盛期林缘、林下两种生境象头花的光合光响应特征进行了研究,为更加深入地了解象头花的光合特性,还应继续开展更多生境中象头花在不同生长期的光响应、CO2响应、日变化等响应规律的研究,今后还需要做大量研究工作,以期为象头花的生理生态研究以及开发利用提供依据。

