春雷霉素高产菌株选育及其工业生产应用
田 露, 王 亮,, 闵建红, 祁晨娟, 张志敏, 龚国利*
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.陕西麦可罗生物科技有限公司, 陕西 渭南 714000; 3.陕西省微生物研究所, 陕西 西安 710043)
0 引言
春雷霉素(Kasugamycin)又名春日霉素、加收米、加瑞农等,是由春日链霉菌(Streptomyceskasugaensis)所产生的一种氨基糖苷类抗生素.春雷霉素作为农用杀菌剂,被广泛应用于农业生产,不仅具有较好的防治植物疾病的效果[1,2],并且对人畜无毒害作用,无污染和无残留符合现代环保要求,是目前最具推广前景的绿色农药之一,也是当前农作物病虫害防治中具有广阔发展前景的农药之一.
春雷霉素的结构由春雷胺(Kasugamine)、D-肌醇(D-inositol)和二碳侧链(Two-carbon side chain)共三部分组成,如图1所示.
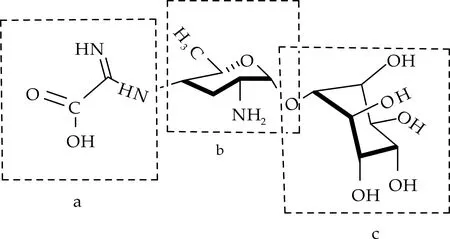
(a)二碳侧链 (b)春雷胺 (c)D-肌醇图1 春雷霉素的化学结构
传统育种中,春雷霉素产生菌通常采用紫外线照射法进行诱变育种[3].Genome shuffling技术是利用基因洗牌技术在全基因组水平上的拓展,采用递归原生质体融合的方法来模拟基因组洗牌技术中的PCR热循环.可以对不同突变表型的若干个菌株的全基因组进行随机的重组,从而选育出具有良好生产性能、遗传特征具有较大改进的杂交菌株的方法.例如,Zhang等[4]利用基因组洗牌育种的方法提高弗氏链霉菌的泰乐菌素的产量;龚国利等[5,6]通过基因组洗牌技术选育埃博霉素B高产菌株,使得纤维堆囊菌的埃博霉素B产量提高了35.1倍.
本文以从不同发酵罐批分离筛选到5株遗传多样性的春雷霉素生产菌株作为出发菌株,通过基因组洗牌技术选育出高产春雷霉素的重组菌株.
1 材料和方法
1.1 材料
1.1.1 菌株
从不同发酵罐批分离筛选到5株春雷霉素产生菌S 17-128,S 17-261,S 18-050,S 18-051,S 18-081,其春雷霉素的产量分别为14 007,14 738,14 520,14 551和14 048 mg/L,这5个菌株作为Genome shuffling育种的出发菌株,工业生产菌KB2010 S 17-182由陕西麦可罗生物科技有限公司提供.菌株培养在小金色链霉菌固体平板上,菌体细胞悬浮在40%甘油溶液中低温冰箱保存.
指示菌:灰梨孢菌DLB2015由陕西麦可罗生物科技有限公司提供.
1.1.2 培养基
(1)斜面培养基及分离培养基:葡萄糖(AR) 1.0%、蛋白胨(BR) 0.3%、黄豆饼粉(IR) 1.0%、NaCl(AR) 0.5%、CaCO3(AR) 0.3%、琼脂2%,蒸馏水配制,消前pH7.2~7.4.
(2)摇瓶种子培养基:玉米油2%、豆饼粉5%、卵磷脂0.2%、磷酸氢二钾0.5%、硫酸镁0.05%、氯化钠0.2%,pH自然.
(3)摇瓶发酵培养基:玉米油2%、卵磷脂0.5%、豆饼粉5%、磷酸氢二钾0.2%、硫酸镁0.1%、氯化钠0.3%,pH自然.
(4)种子罐培养基:玉米油2%、豆饼粉5%、卵磷脂0.2%、磷酸氢二钾0.3%、硫酸镁0.05%、氯化钠0.2%,pH自然.
(5)发酵罐培养基:豆油2%、豆饼粉6%、卵磷脂0.5%、硫酸铵0.01%、磷酸氢二钠0.1%、磷酸二氢钾0.3%、硫酸镁0.01%、氯化钠0.2%,pH自然.
1.1.3 溶液
(1)TPM液: 0.001 mol/L K2HPO4-KH2PO4,0.008 mol/L硫酸镁,0.01 mol/LTris-HCl,pH7.6,灭菌备用.
(2)Tris缓冲液:0.067 mol/L,pH8.0,灭菌备用.
(3)EDTA溶液:称取5 g EDTA于90 mL水中溶解,调节pH至8.0,然后定容至100 mL,灭菌备用.
(4)MMM缓冲液:0.02 mol/L马来酸,0.3 mol/L甘露醇,0.02 mol/L氯化镁,pH6.5,灭菌备用.
1.1.4 主要试剂
Lyticase(10 U/μL)溶菌酶,购自上海翊圣生物科技有限公司.
1.1.5 摇瓶,种子罐和发酵罐等的培养条件
(1)摇瓶培养条件:培养液30 mL/300 mL广口三角瓶,培养温度28 ℃;转速220 rpm;培养周期30~36 h.
(2)种子罐培养条件:培养温度28 ℃;通气量1∶1 VVM;搅拌转速300 rpm;培养周期24~28 h;接种量1%.
(3)发酵罐培养条件:培养温度28 ℃;通气量1∶0.7 VVM;搅拌转速150 rpm;发酵周期192~210 h;接种量10%.
1.1.6 仪器
MQ D-0.4型压力蒸汽灭菌器(邢台医疗器械厂),OLYMPUS CX31RTSF显微镜(日本Olympus公司),YT-CZ-ZN超净工作台(北京亚泰科隆有限公司),MBR-304DR血液保存箱(深圳市凯铭杰仪器设备有限公司),HY-5回旋多用振荡器(金坛市华峰仪器有限公司),HW·SY21-KP4电子恒温水浴锅(北京市长风仪表仪器厂),LC-10Avp液相色谱仪(岛津仪器(苏州)有限公司),LRH-1500F生化培养箱(上海一恒科学仪器有限公司),无菌96孔板(赛默飞世尔科技(中国)有限公司).
1.2 方法
1.2.1 出发菌株的分离与纯化
无菌操作取不同发酵罐批发酵190 h的发酵液,在无菌室超净工作台内将无污染的发酵液划线在分离培养基上,28 ℃恒温恒湿培养9~11 d后取出平板,在无菌室超净工作台内挑取草帽型灰色菌落,转接后进行划线分离,直至挑取到单个菌落,其孢子生长丰满,呈灰白色至粉灰色,基内菌丝及分泌的可溶性色素为淡黄色.然后挑取单菌落作为种子菌进行液体培养2~3 d,离心收集菌体.
1.2.2 原生质体的制备和再生
收集出发菌株,调整其浓度为1×106cell/mL, MMM缓冲液悬浮,加入10 U/μL的溶壁酶液,28 ℃,30 min进行酶解,离心收集原生质体,MMM缓冲液重悬离心后继续用MMM缓冲液悬浮备用.取酶解完全的原生质体悬液0.5 mL,适量MMM缓冲液稀释后于斜面培养基,28 ℃培养直至观察到单菌落[5].
1.2.3 原生质体的融合方法
本研究采用灭活原生质体融合,提高了基因组洗牌育种的效率.
紫外线灭活:在无菌室超净工作台内,把悬浮的原生质体转到Φ9 cm的无菌平皿内,于30 W的紫外灯下,分别照射20 s、40 s、60 s、80 s和100 s进行紫外灭活,经再生培养检查灭活效果.
加热灭活:把悬浮的原生质体转到无菌试管中分别置于不同温度水浴(40、50和60 ℃),热灭火处理1 min、3 min、5 min和7 min,然后利用再生培养检查其灭活的效果.
取1 mL浓度为1×108cell/mL不同灭活的出发菌株悬液混合,离心收集,弃上清液后用MMM缓冲液悬浮.随后加入2 mL 40%的PEG-MMM,28 ℃ 15 min.离心MMM洗涤,MMM重悬,利用双层培养法再生,28 ℃培养9~11 d.融合率通过融合子和灭活亲本的再生情况进行计算.
首先选取的PEG浓度为10%、20%、30%和40%,反应时间为10 min,得到最佳浓度后,设置5 min、10 min、15和20 min不同对反应时间进行实验.
融合率a=[(b-c)/d]×100%,式中a为原生质体融合率;b为融合再生的菌落数目;c为灭活亲本再生的菌落数目;d为亲本再生的菌落数目.
1.2.4 基因组shuffling
将灭活后的原生质体在合适条件下进行随机融合,通过双层平板培养法再生后,平板上的再生菌落为F1代的融合菌群[7];然后将其作为出发菌株,灭活后再融合,再生,反复重复5轮融合再生后得到F2代融合菌群,然后反复5轮融合再生.获得的最终菌群对其筛选和检测,从而获得到高产春雷霉素菌株[8,9].其中对照组为加入的溶菌酶用无菌水代替,其他实验步骤一致.
1.2.5 高产重组菌株的初筛
本实验通过高通量筛选法进行筛选,首先在96孔板中的孔中加入200μL灭菌的固体发酵培养基,平行接种诱变菌株于两块96孔板(a板和b板).然后再a板的孔加入适量的灰梨孢菌,28 ℃培养9~11 d,然后用微板光谱仪进行检测,选取透光度较大的菌株作为目标菌株.b板于20 ℃下培养4 d后,保藏于4 ℃冰箱待用.等a板培养结束后,从b板上取出相应的菌株进行检测.
1.2.6 高效液相色谱的复筛
将初筛获得的高产重组子通过液体摇瓶扩大培养40 h,然后按照1∶50的接种量接种于发酵培养基.发酵体系:300 mL三角瓶装发酵培养基50 mL,28 ℃,220 r/min培养144 h.144 h发酵液用草酸调pH3.0,5 000 r/min离心10 min,收集上清液待用.然后上清液采用HPLC(岛津高效液相色谱系统)进行定性和定量测定.
色谱柱:150×3.9 mm(id)不锈钢色谱柱,ODS,粒径5μm;
流动相:4.0 g十二烷基硫酸钠溶于纯水中,加200 mL乙腈,定容至1 L,用磷酸调pH2.55,过滤超声后备用.
流速:1.0 mL/min;
检测波长:紫外检测仪,波长为210 nm;
柱温:25~35 ℃;
进样量:5μL.
本实验的春雷霉素标准品购买于sigma公司.
1.2.7 重组菌株的遗传稳定性测定
获得的高产春雷霉素菌株进行传代培养5次后,进一步利用发酵筛选,筛选得到春雷霉素产量高并且遗传稳定性好的重组菌株,然后保藏菌种.
1.2.8 春雷霉素的效价测定方法
(1)标准溶液配制
称取标样0.05 g(精确至0.000 2 g)置于50 mL容量瓶中,用流动相溶解,稀释至刻度,摇匀.
(2)试样溶液的配制
称取约含春雷霉素0.05 g的试样(精确至0.000 2 g)置于50 mL容量瓶中,用流动相溶解,稀释至刻度,摇匀,并用0.45μm滤膜过滤,备用.
(3)测定
在上述条件下,待仪器稳定后,连续注入数针标准溶液,计算各针响应值的重复性,待相邻两针的响应值变化小于1.5%时,按照标样溶液、试样溶液、试样溶液、标样溶液的顺序进行测定.
(4)计算
将测得的两针试样溶液以及试样前后两针标样溶液中春雷霉素的峰面积分别进行平均,试样中春雷霉素的质量分数 (%),按式(1)计算:
(1)
式(1)中:A1-标样溶液中,春雷霉素峰面积平均值;A2-试样溶液中,春雷霉素峰面积平均值;m1-春雷霉素标样的质量,g;m2-试样的质量,g;ω1-标样中春雷霉素的质量分数,%.

表1 制备条件对原生质体制备率的影响情况
2 结果与讨论
2.1 获得出发菌株
将不同批次的发酵罐中筛选到的具有遗传多样性的菌株作为出发菌株,利用小金色链霉菌(S.microaureus)分离平板筛选到了到5株遗传差异大的菌株,分别为S 17-128,S 17-261,S 18-050,S 18-051,S 18-081,这5株菌株作为Genome shuffling的出发菌株.产量最高的菌株S 17-261的春雷霉素产量为14 738 mg/L,见图2所示.
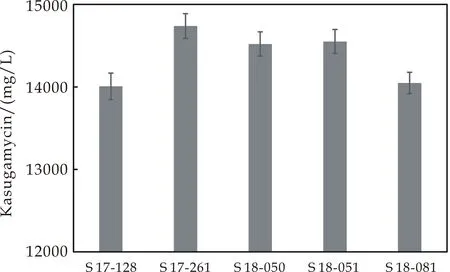
图2 出发菌株春雷霉素产量
2.2 原生质体的制备与再生
基因组shuffling过程中的关键步骤在于原生质体制备与再生,本实验中首先确定了制备和再生的培养基的种类、方法和渗透压稳定剂.另外酶解的温度、时间和酶解前预处理的因素见表1所示.结果表明,在制备原生质体时,EDTA预处理细胞可以提高细胞壁酶解的效率.通过实验结果,本文最终选择的渗透压稳定剂为0.3 mol/L的甘露醇,EDTA预处理10 min,酶解时间30 min,原生质体再生采用自然扩展法.
2.3 优化原生质体融合的条件
本研究通过加热和紫外照射两种灭活方法,来确定原生质体的双亲菌株的灭活条件.从图3可以看出,随着温度和紫外的灭活时间延长,原生质体存活的数量呈现降低趋势,当灭活率达到99%以上后,继续灭活所需要时间成倍增长.因此,本研究确定了灭活率达到100%的灭活条件,即加热灭活:50 ℃,10 min;紫外灭活:30 W,235.7 nm,30 cm,2 min.
原生质体融合时融合率受PEG的聚合度、浓度、反应时间以及温度影响见表2所示.实验结果表明,当PEG6000浓度为40%时,融合率随着反应时间增加而呈现递增,但当达到一定的值后,融合率不再随融合时间增加而提高;并且反应时间过长融合子的再生率也会受到影响.在融合过程中的反应温度对融合率也会造成一定的影响,温度过低和过高都会降低融合率,本实验结果显示26 ℃的反应温度融合率最高.
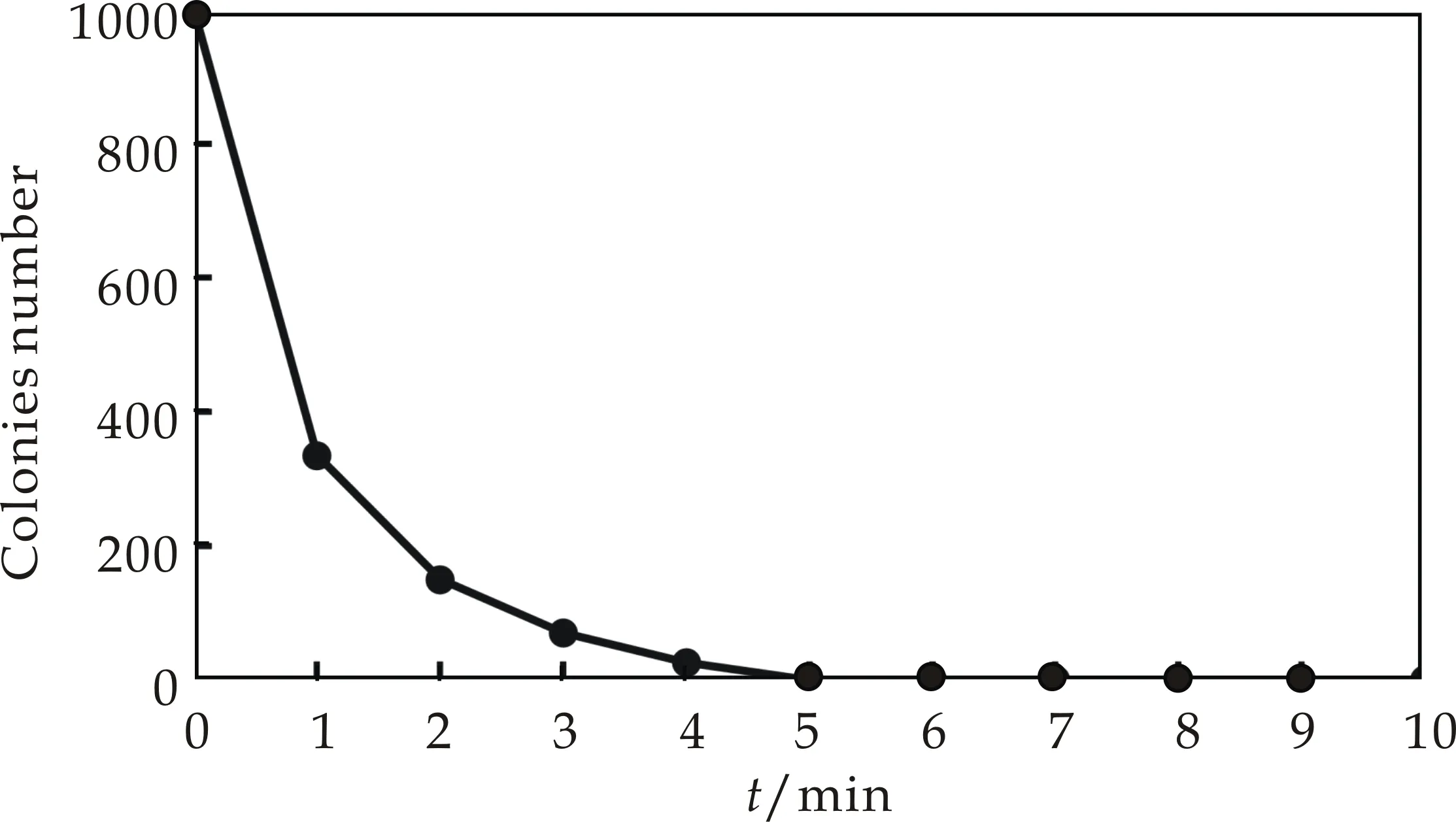
(a)温度灭活曲线
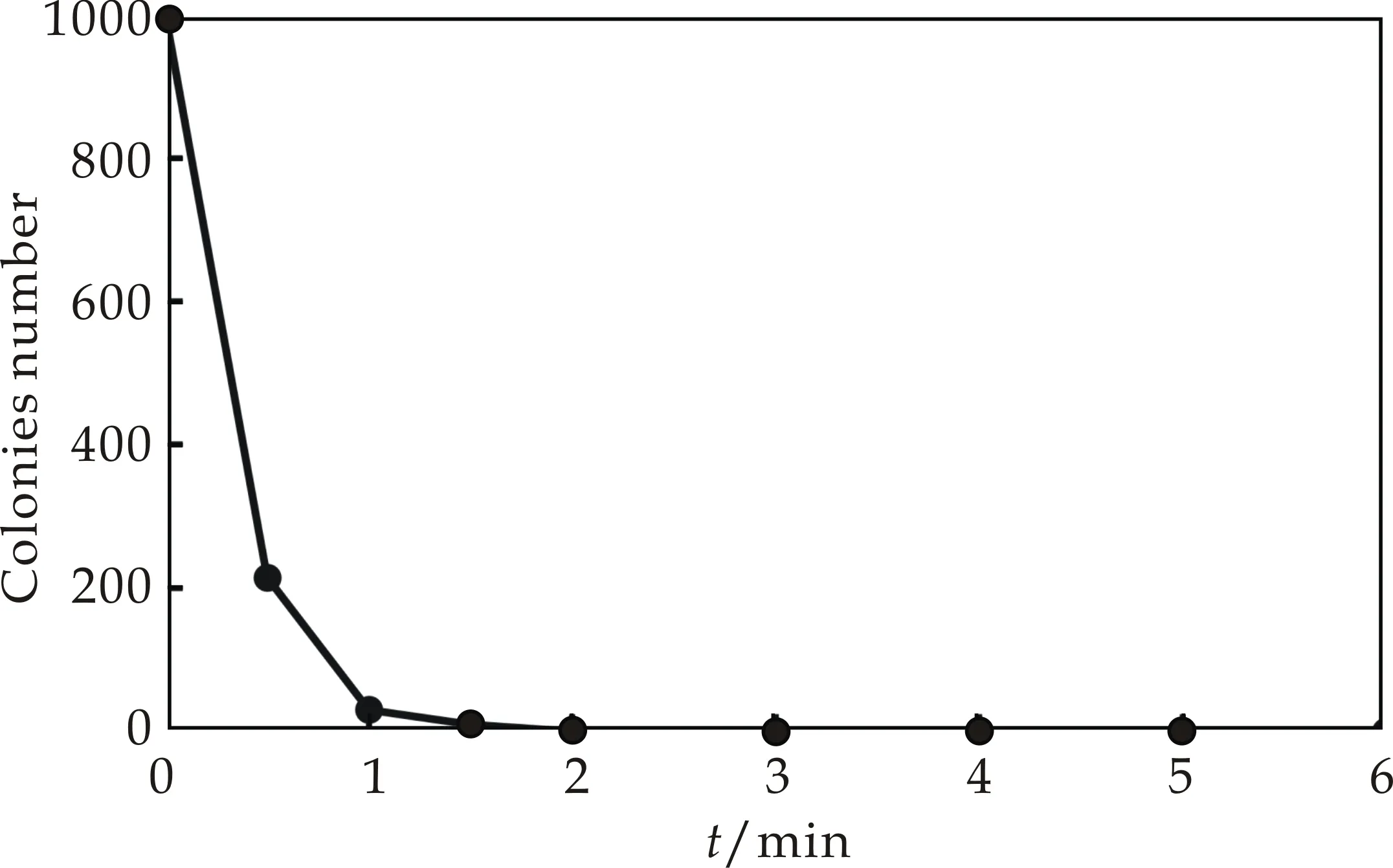
(b)紫外灭活曲线图3 温度和紫外灭活曲线
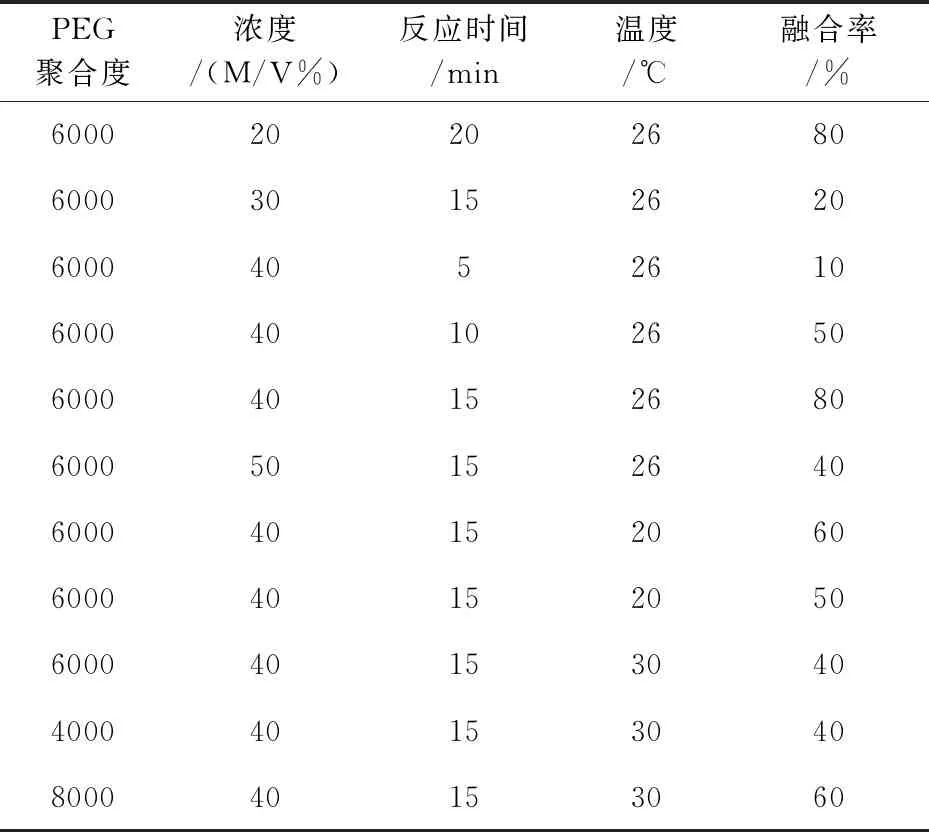
PEG聚合度浓度/(M/V%)反应时间/min温度/℃融合率/%60002020268060003015262060004052610600040102650600040152680600050152640600040152060600040152050600040153040400040153040800040153060
2.4 基因组shuffling选育高产春雷霉素的菌株
为了获得高产春雷霉素菌株,在原生质体融合过程中,每次融合结束后选取100个再生单菌落测定其透光度,选取其中具有高透光度的10株菌株进一步发酵培养,然后定量检测.在经过基因组shuffling后,本研究观察了1580株的诱变融合菌落的生长状况见表3所示,并且获得了透光度超过19%的10株融合菌,其余1 570株融合菌的平均透光度(光线波长420 nm)为13.2%,出发菌株的平均透光度(光线波长420 nm)为8.7%.获得的10株高透光度的融合菌株通过摇瓶发酵后,利用HPLC对其进行定性和定量分析检测.最后,本研究筛选得到了3株春雷霉素高产菌株,产量分别为17 320 mg/L、18 882 mg/L和19 823 mg/L见表4所示.而对照组春雷霉素的产量无明显变化,从而证实了基因组shuffling育种能有效筛选出春雷霉素高产的菌株.

表3 亲本和诱变菌株在96孔板上的生长情况
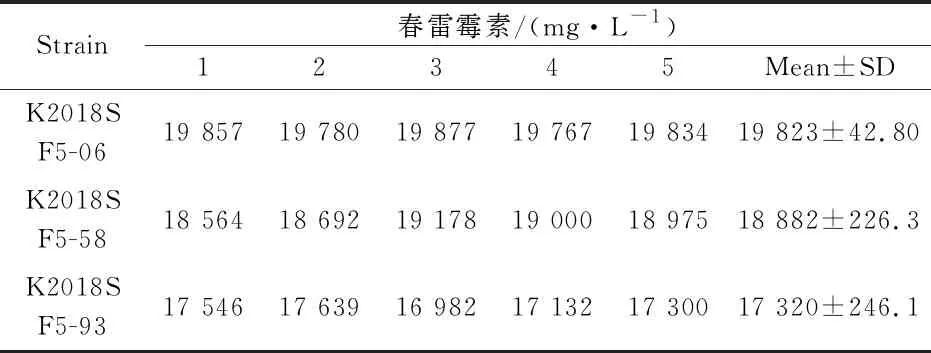
表4 高产春雷霉素菌株接种培养不同代数的产量情况
2.5 重组菌株的遗传稳定性测定
把获得的3株高产春雷霉素的菌株进行连续传代培养5次,然后通过发酵培养基进行发酵培养,观察菌株的颜色、生长速度等特征,发现均没有明显变化.进一步通过HPLC进行检测,发现菌株产生春雷霉素的产量没有明显变化,见表4所示.实验结果说明筛选到的重组高产菌株的性状稳定.
2.6 生产罐上发酵结果
将筛选获得的高产菌株 K2018S F5-06和工业生产菌K2010 S 17-182在30吨发酵罐上实验各4批,放罐后的发酵结果显示,新菌株平均效价为19 608 mg/L,工业生产菌株平均放罐效价为 14 305 mg/L.因此,新菌种效价提高37.1%(5 303 mg/L),见表5所示.对8批罐上的发酵液效价做趋势图对比,见图4(a)所示.
从罐上发酵动态趋势图对比,显然新菌株K2018S F5-06不论起步效价还是整个罐批发酵效价增加幅度及增长趋势均明显高于生产菌株K2010 S 17-182.显微镜观察菌株生长染色涂片可见,前期新菌株菌体均匀、粗壮、舒展不结团,着色能力强,表明菌体嗜碱性强,代谢旺盛.43 h菌丝体断裂均匀同步,菌体转入产春雷霉素旺盛期,至211 h才出现膨大的空泡,见图4(b)所示.新菌株30吨发酵罐上发酵总体表现出起步效价高,生产期效价增长快,菌体衰老晚的优势,正好满足工业化生产需要.
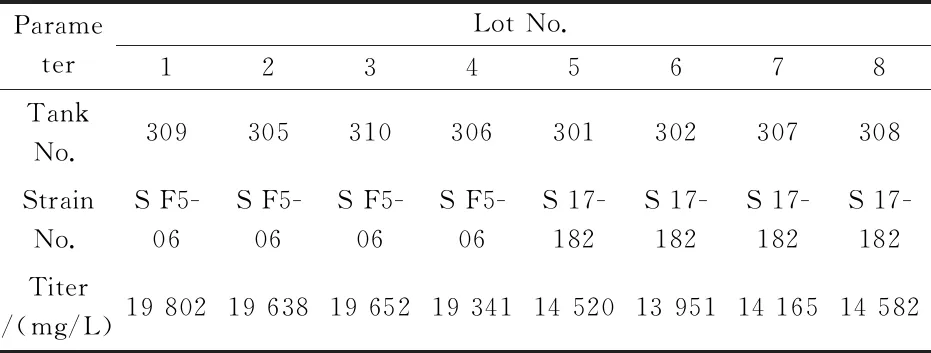
表5 在30吨发酵罐K2018S F5-06与K2010 S 17-182发酵结果
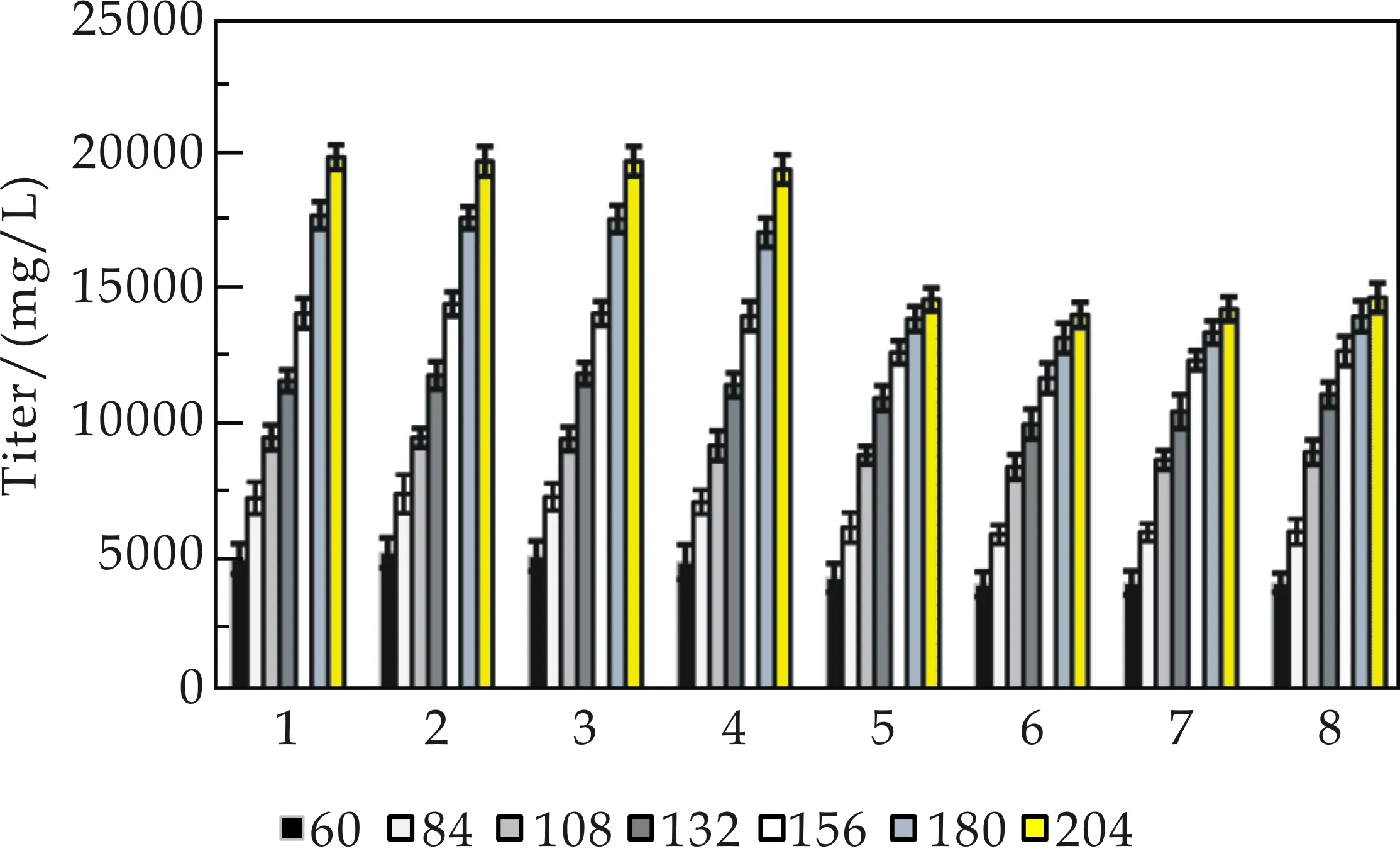
(a)发酵罐中春雷霉素效价趋势变化图

(b)K2018S F5-06发酵各阶段菌丝形态图4 发酵罐中春雷霉素效价趋势
3 结论
本研究利用基因组洗牌育种技术改良春雷霉素生产菌,成功选育出了3株产量较稳定的高产春雷霉素菌株.春雷霉素的发酵效价提高到19 608 mg/L,提高了37.1%.选育菌株在30吨发酵罐中发酵后,表现出起步效价高,生产期效价增幅快,而菌体的衰老晚等优势.传统诱变育种往往只能是1至几个基因发生突变,生产菌株经过多年的诱变育种后往往产生疲劳效应,通过传统育种方法很难大幅度提高产品的产量;而基因组洗牌育种技术是在若干个亲本菌株的全基因组水平上同时进行重组,可以将不同程度变异的遗传信息整合到1个细胞株中,从而实现菌株良好遗传信息的集中,使得菌株合成目标产物的产量提高,生产性能可以大幅度改良.因此,基因组洗牌育种技术较传统诱变育种对菌株改良的速度更快,并且可以加速工业生产菌株向人们预期的方向的进化[10,11].

