荒漠草原土壤相对湿度对猪毛蒿表型可塑性的影响
陈 林,苏 莹,李月飞,杨丽娜,王 磊,宋乃平,*,杨新国,卞莹莹,祝忠有,孟文婷,陈 娟
1 宁夏大学西北退化生态系统恢复与重建教育部重点实验室,银川 750021 2 宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,银川 750021 3 Biostatistics Department, Pennsylvania State University, Hershey, PA 17033 4 宁夏大学 农学院,银川 750021
植物表型可塑性被定义为同一个基因型植物响应并适应不同生境而改变形态、生理和行为等现象或能力的特性[1],也可以是一个基因型在环境作用下能表达的表型范围[2],是植物对环境条件或刺激作出的重要反应和方式[3- 4]。凭借表型可塑性,植物可以获取更多资源,占据广阔的地理范围和多样化的生境,使其具有更宽的生态幅和更好的耐受性,从而成为生态位理论中的广幅种[5]。一般来说,具有较大可塑性的植株,能更好地适应环境的变化[6]。植物对环境的响应性是反映植物对环境适应过程中内部与外部不同功能之间的权衡,是植物在特定环境下生存适应策略的重要表现[7],因此,研究植物表型可塑性具有重要的生态学意义[8]。加之由于植物分布广、易生长繁殖,而且植物的表型可塑性指标测量简单易行,可明显地呈现出环境对其生长和发育的影响[9],长期以来,一直受到相关学者的关注[10]。在近30年中对不同植物可塑性研究的数量呈指数增长[11]。
在自然条件下,植物生长繁殖所处的环境条件和所需资源往往呈现出异质性分布[12],普遍存在的自然生境异质性使得植物获取资源的难度大大增加[13],严重影响其生长、繁殖和扩散[10]。而环境差异造成植物的生长分异是植物生长可塑性的基础表现[14],作为植物在选择压力下所形成的一种有效获取必需资源的生态适应对策[15]。因此植物表型可塑性与其环境异质性密不可分[16]。荒漠草原年降水量少,水分是影响该地区植物存活、生长和繁殖的关键性限制因子之一[17]。由于受地形地貌的影响,小尺度范围内的土壤含水量也会发生较明显的变化。但目前,在荒漠草原开展关于水分条件对植物表型可塑性影响的相关研究尚少。
表型可塑性是植物普遍存在的现象[14,18],目前,已在陆生植物的多个类群中开展了相关研究[10],但大多集中在入侵物种,而对于非入侵物种的研究较少[5]。猪毛蒿是一种广泛分布的物种,在我国新疆、宁夏、云南等大部分地区均有分布,局部地区往往可形成单一优势种群和次生演替的先锋物种。此外,由于猪毛蒿种群生长环境的差异性,种群的维持和更新与其自身形态可塑性关系密切,对不同土壤相对湿度条件下猪毛蒿表型可塑性研究,有助于认识猪毛蒿的生态适应性,以提高对该物种的预警和控制能力。目前,关于猪毛蒿的研究主要集中在群落演替、化学成分、化感作用等方面[19],对荒漠草原异质生境下猪毛蒿表型可塑性的相关研究尚未引起足够重视。本文通过调查研究猪毛蒿生物量及其不同器官分配格局,试图回答以下问题:(1)在荒漠草原,不同土壤相对湿度条件下猪毛蒿是否具有表型可塑性?(2)猪毛蒿具有什么样的繁殖适应策略?以期为荒漠草原的恢复及管理提供基础资料和科学依据。
1 材料与方法
1.1 研究区概况
本研究区处于宁夏中部干旱带的荒漠草原,地貌为鄂尔多斯缓坡起伏高原。气候特点为干旱少雨,蒸发量大,冬春两季风大沙多,属典型的中温带大陆性气候。近50年平均气温为8.46℃,年降水量为276.3 mm,年日照时数为2862.6 h。该区域植被主要受水分因素限制[20],表现出物种多样性较低、群落结构简单、沙生特征明显。地下水资源匮乏。20世纪60年代以来,由于人类活动加剧,土地沙化面积仍不断扩大。
1.2 研究材料与方法
猪毛蒿(Artemisiascoparia)为菊科(Asteraceae)蒿属(Artemisia)植物,广布于欧、亚大陆温带至亚热带地区,局部地区构成植物群落的优势种。由于控制实验条件下的研究背景不包括所有潜在的环境选择力,与植物生境的真实情况有很大差距[21-22],而自然环境包括多种因素的共同影响和同时、异时的交互作用,因此,最好评价自然条件下种群中的可塑性及其结果对环境因子和表型可塑响应的复杂性[23-24]。本研究在宁夏中部荒漠草原采用随机取样的方法,选取39个典型的猪毛蒿群落样地(图1)。
图1 猪毛蒿采集样地分布示意图Fig.1 Distribution of sampling sites of A. scoparia in the heterogeneous habitats in desert steppe
所有的猪毛蒿植株样本于2017年10月4—8日进行采集,先用GPS定位并记录采样点的经纬度和海拔信息,然后在每个样地设置5个样方,样方间的距离大于10 m。取样前1个月内无>5 mm单次降雨且近7 d内无降雨事件发生。采用便携式土壤水分测量仪(England,ML3)对0—5 cm、5—10 cm和10—20 cm土层土壤水分进行测量;土壤硬度采用数显式土壤紧实度仪(USA,SC- 900)进行测量;盖度测量选择常用的目测估算法;密度为实际测量值。每个样地随机选取生长健康、没有人为干扰和病虫害影响的猪毛蒿5株,用卷尺测量地上部分高度和冠幅后,挖取整株,根部清理干净分株装于信封袋带回实验室。室内测量猪毛蒿植株特征前,去除杂草、小石块等杂质,把植株分为头状花序、根、茎和叶等部分,分别装入信封并置于65℃烘箱中烘干48 h至恒重,然后用万分之一电子天平进行称重。
1.3 数据处理与分析
0—20 cm土层土壤含水量为0—5 cm、5—10 cm和10—20 cm土层土壤含水量的加权平均值。采用0—20 cm土层土壤含水量与田间持水量(风沙土田间持水量实测值为23.9%,灰钙土为29.3%,风化基岩为24.6%)的百分比,即土壤相对湿度[25]进行统计分析,划分出3个等级:<30%、30%—40%和>40%,所对应样方数量分别为87、77和26个。
对个体大小应该用营养器官生物量还是地上部分总生物量来衡量并不统一,本研究中猪毛蒿个体大小以地上部分生物量干重为准[26];繁殖器官大小以头状花序干重为准;营养器官是根、茎和叶的干重之和;株高为主茎最上端与地面间的自然高度;冠幅为东西向长度和南北向长度的乘积;繁殖分配为繁殖器官干重占植物个体总生物量干重的百分比。在位置效应分析中,将植株按株高平均分为上部、中部和下部[27],分别统计单株猪毛蒿各部位的生物量、繁殖体数量、繁殖体重量,并计算单个繁殖体重量,单个繁殖体重量为单株繁殖体重量与单株繁殖体数量的比值。采用经典的异速方程:Y=βxα进行异速增长关系分析,个体大小(V)与繁殖器官(R)的数据进行对数转换以去除变量偏差对回归系数的影响,然后进行统计分析相关性[28]。根冠比为地下生物量和地上生物量的比值[14]。
可塑性的表达方式有很多,最基本的一种是计算不同环境下特征平均值的差异,目前很多常用的公式衍生于此[23]。还可直接用方差分析得出的环境因子导致的特征变异程度评价可塑性[29],本研究采用两者结合的方法进行分析。
所有数据在Excel 2016和SPSS 21.0软件中进行统计、计算和制图,采取单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)分析不同生境各特性、猪毛蒿株高、茎粗、根长、根重以及各生物量等方面的差异。
2 结果与分析
2.1 猪毛蒿生长和生物量特征
从图2中可以看出,当土壤相对湿度>40%时,猪毛蒿的株高(42.51 cm)极显著高于其他两种土壤相对湿度生境,且土壤相对湿度<30%的株高(22.84 cm)又极显著低于30%—40%的土壤相对湿度生境(27.88 cm)(P<0.001)。土壤相对湿度>40%的猪毛蒿平均茎粗为4.44 mm,极显著大于其他两种土壤相对湿度生境(P<0.001),而土壤相对湿度<30%的茎粗(2.50 mm)和30%—40%(2.99 mm)间无显著差异(P>0.05)。根长方面,30%—40%的土壤相对湿度生境和>40%、<30%生境间均无显著差异(P>0.05),但>40%生境下的平均根长(18.34 cm)显著高于<30%生境(14.27 cm)(P<0.05)。不同土壤相对湿度生境下根重间的差异和茎粗的情况一样,土壤相对湿度>40%生境下(1.88 g)极显著大于<30%(0.31 g)和30%—40%(0.53 g)生境(P<0.001),而<30%和30%—40%间无显著差异(P>0.05)。从单株生物量来看,土壤相对湿度>40%生境下(17.61 g)远高于<30%(2.10 g)和30—40%(4.27 g)土壤相对湿度生境,达到了极显著差异(P<0.001)。但对根冠比的分析发现,土壤相对湿度<30%、30%—40%和>40%生境下的平均值分别为0.189、0.185和0.152,随着土壤相对湿度的增大而呈减小的趋势,但无显著差异(P>0.05)。

图2 不同土壤相对湿度下猪毛蒿的生长和生物量特征Fig.2 Growth and biomass characteristics of A. scoparia in the heterogeneous habitats不同大写字母表示不同土壤相对湿度间差异显著。图中符号“×”表示平均值
2.2 位置效应
不同土壤相对湿度生境下猪毛蒿的地上生物量、头状花序数量和重量、单个头状花序重量的比较结果见图3。可以看出,土壤相对湿度>40%生境下单株地上生物量、单株头状花序数量和重量均显著大于<30%和30%—40%生境(P<0.05),而土壤相对湿度<30%和30%—40%生境间差异不显著(P>0.05)。
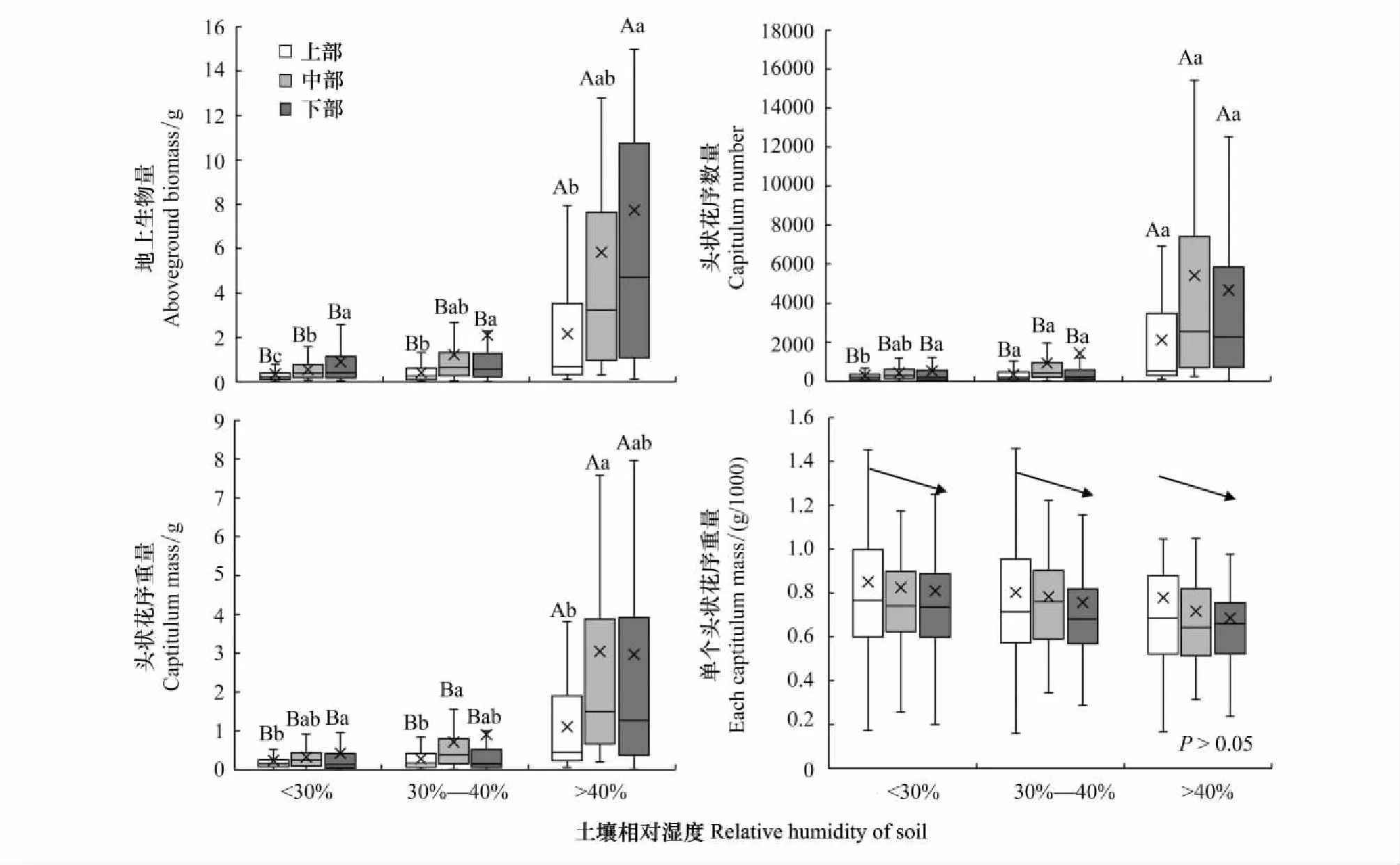
图3 不同生境下的猪毛蒿个体大小和繁殖器官格局特征Fig.3 The structure characteristics of aboveground biomass and reproductive body of A. scoparia in heterogeneous habitats不同大写字母表示表示不同土壤相对湿度间差异显著,不同小写字母表示同一土壤相对湿度不同部位间差异显著
不同土壤相对湿度生境下,猪毛蒿不同部位生物量大小排序为:上部<中部<下部,且下部显著大于上部(P<0.05),除<30%生境下中部生物量与上部和下部间有显著差异(P<0.05),其他两种土壤相对湿度生境下中部与上部和下部间均无显著差异(P>0.05)。
从头状花序数量来看,土壤相对湿度30%—40%和>40%生境猪毛蒿上部、中部和下部头状花序平均数量分别为352.90、934.81、1441.00个和2117.42、5408.25、4665.38个,但同一土壤相对湿度生境差异不显著(P>0.05),<30%生境下上部、中部和下部头状花序平均数量分别为302.43个、426.54个和530.45个,下部数量显著多于上部(P<0.05)。
从头状花序重量来看,<30%生境下上部、中部和下部分别为0.24 g、0.32 g、0.42 g,下部的头状花序重量显著高于上部(P<0.05),中部和上部、下部间无显著差异(P>0.05);30%—40%生境猪毛蒿上部、中部和下部分别为0.28 g、0.71 g、0.90 g,>40%生境下分别为1.10 g、3.05 g、2.97 g,这两种生境下中部头状花序重量显著高于上部(P<0.05),而下部则与上部和中部无显著差异(P>0.05)。
土壤相对湿度<30%生境下上部、中部和下部单个头状花序重量分别为8.5×10-4、8.2×10-4、8.1×10-4g,30%—40%和>40%生境下上部、中部和下部分别为8.0×10-4、7.8×10-4、7.6×10-4g和7.8×10-4、7.2×10-4、6.9×10-4g,均表现为上部>中部>下部。猪毛蒿不同部位的单个头状花序重量间均无显著差异(P>0.05)。
2.3 不同土壤相对湿度下猪毛蒿繁殖器官绝对投入量
异速生长描述的是非线性数量关系,通常以幂函数形式表示[30-31]:Y=βxα。其中,Y为繁殖器官生物量,X为植物的个体大小,β和α是常数。通过对繁殖器官生物量与个体大小进行对数转换后,分析两者间的异速增长关系。不同土壤相对湿度生境下猪毛蒿的繁殖器官绝对投入量(lgR)随着个体大小(lgV)的增大而增加(图4),呈极显著的正相关关系(P<0.001)。根据繁殖阈值的概念,当y轴为0时,土壤相对湿度<30%、30%—40%和>40%生境下x轴的截距(图4中虚线)分别为0.272、0.298和0.302,所应对繁殖阈值的个体大小分别为1.868、1.987和2.006 g。
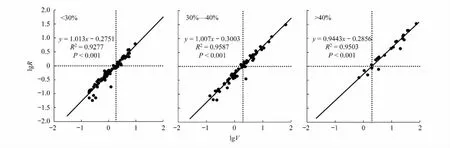
图4 不同土壤相对湿度下猪毛蒿繁殖器官生物量(lg R)和个体大小(lg V)的相关性Fig.4 Correlation analysis between aboveground biomass (lg V) and reproductive biomass (lg R) of A. scoparia in heterogeneous habitats
2.4 不同土壤相对湿度下的猪毛蒿繁殖分配
猪毛蒿的平均繁殖分配在土壤相对湿度<30%、30%—40%和>40%3种生境下分别为0.259、0.345和0.484,呈极显著差异(P<0.001)。3种土壤相对湿度生境下猪毛蒿个体大小和繁殖分配间达到了极显著正相关水平(R2=0.254,P<0.01),但只有在土壤相对湿度为30%—40%时,两者间呈显著正相关水平(R2=0.0755,P<0.05),而在<30%和>40%生境下未达到显著水平(P>0.05)(图5)。
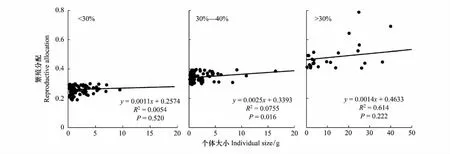
图5 不同土壤相对湿度下猪毛蒿植株个体大小与繁殖分配的关系Fig.5 Correlation analysis between individual size and reproductive allocation of A. scoparia in heterogeneous habitats
2.5 猪毛蒿生物量间的相关关系
猪毛蒿的平均营养器官生物量在土壤相对湿度<30%、30%—40%和>40%3种生境下分别为1.287 g、1.546 g和18.801 g,而对应的繁殖器官生物量分别为1.078 g、1.251 g和15.505 g。3种土壤相对湿度生境下营养器官和繁殖器官生物量间均呈极显著正相关关系(P<0.001)(图6)。整体分析,荒漠草原猪毛蒿的繁殖器官和营养器官生物量间呈线性正相关关系(R2=0.9449,P<0.001),说明猪毛蒿的繁殖器官和营养器官生物量间存在正向权衡。
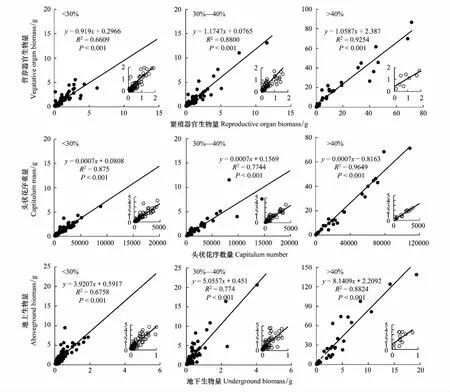
图6 猪毛蒿各组生物量之间的线性回归关系Fig.6 Linear regression relationship between each biomass group of data of A. scoparia
不同土壤相对湿度生境下猪毛蒿的头状花序数量分布在107—108841个,单株头状花序重量则在0.0569—71.2536 g。其中,<30%生境下单株猪毛蒿的头状花序平均个数仅为1388.01,平均头状花序重量也仅为1.08 g;30%—40%生境下单株猪毛蒿头状花序为1666.40个,重量平均为1.26 g;而>40%生境下猪毛蒿的单株头状花序个数高达24267.00,头状花序平均重15.50 g。综合分析得出,荒漠草原猪毛蒿的头状花序重量和数量间呈极显著线性正相关关系(R2=0.9717,P<0.001),说明猪毛蒿的繁殖体数量和质量间也存在着正向权衡。
土壤相对湿度<30%生境下单株猪毛蒿平均地上生物量为2.01 g,平均地下生物量为0.36 g;30%—40%生境下单株猪毛蒿平均地上生物量为2.41 g,平均地下生物量则为0.39 g;而>40%生境下平均地上生物量为30.79 g,平均地下生物量为3.51 g。可以看出,3种土壤相对湿度生境下猪毛蒿的地上生物量均大于地下生物量,且地下生物量随着地上生物量的增大而增加,两者间均呈极显著正相关关系(P<0.001)。同样表明猪毛蒿的地上和地下生物量间也存在着一定的权衡。
2.6 猪毛蒿生物量的权衡
土壤相对湿度<30%生境下猪毛蒿单个头状花序平均重量为0.791 g,30%—40%生境下单个头状花序平均重量为0.781 g,>40%生境下为0.636 g,不同土壤相对湿度生境下的单个头状花序重量间均无显著差异(P>0.05)。从图7中可以看出,猪毛蒿单个头状花序重量与个体大小间呈正相关关系,但相关性不显著(P>0.05)。单个头状花序重量与单株头状花序数量间呈负相关关系,同样未达到显著水平(P>0.05)。说明单个头状花序重量并不随着个体大小和头状花序数量的增加而发生显著变化。
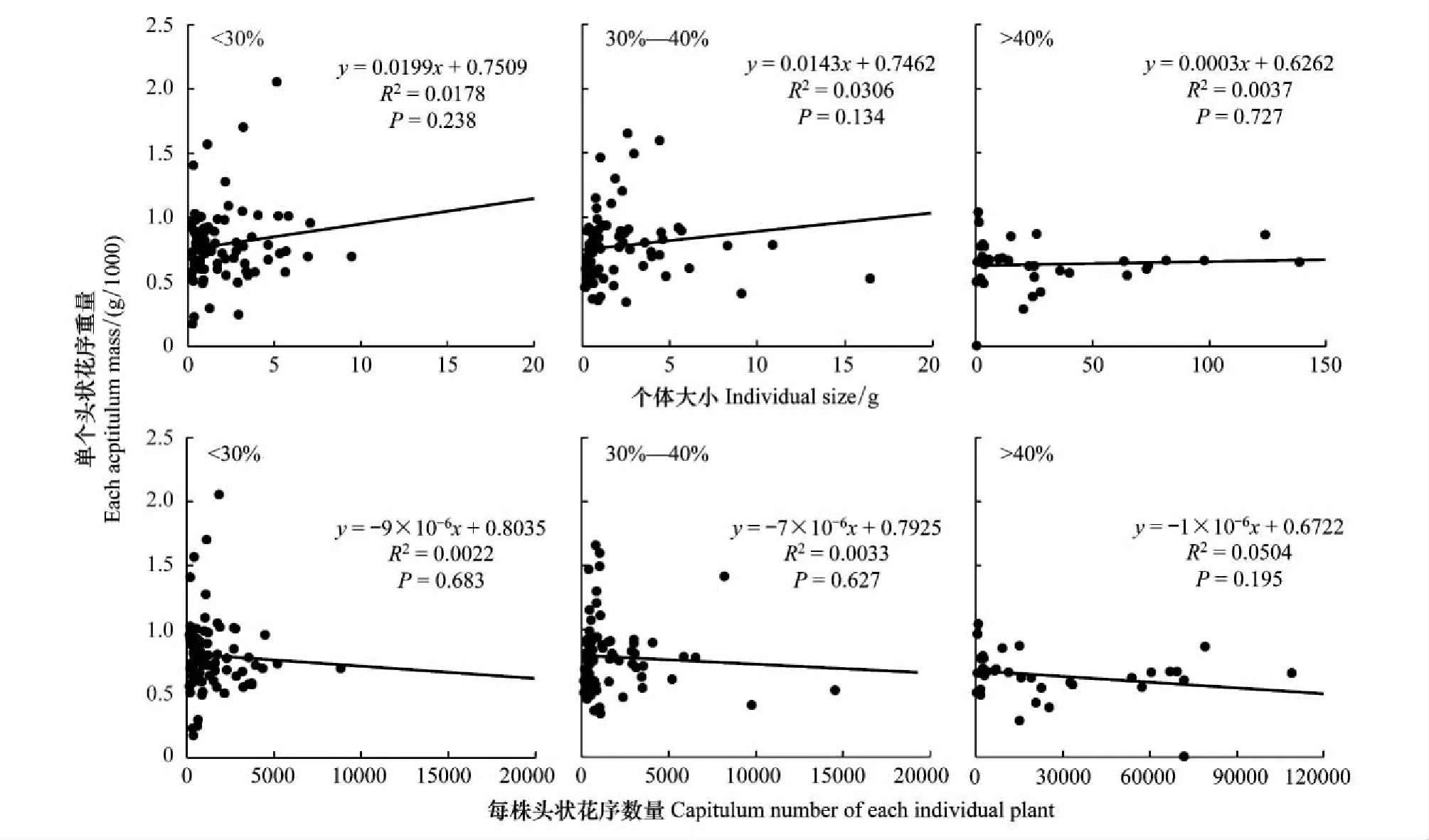
图7 单个头状花序重量与个体大小、每株头状花序数量的线性回归关系Fig.7 Liner regression relationship of capitulum mass with individual size and capitulum number
3 结论与讨论
植物表型可塑性Bradshaw-Sultan效应理论[32]认为,植物体某些关键表型特征的相对稳定性是以另外一些特征可塑性的升高为代价的,前者一般而言与植物适合度的关系更为紧密。本文研究结果为该理论提供了实验证据,猪毛蒿的根冠比、单个头状花序重量、繁殖阈值特征不受其他表型特征的影响,均表现出相对的稳定性,而其他表型特征则对土壤水分状况表现出明显的可塑性。此外,大量研究已经发现,花的数量和大小之间存在权衡关系[33],但也有学者研究发现Amphibromusscabrivalvis的这种权衡未被有力证明[34],本研究对猪毛蒿的研究结果同样发现,单株头状花序的数量和单个头状花序的重量间虽然呈负相关关系,但未达到显著水平(P>0.05)。因此,花数量和大小间的权衡关系在不同研究目标植物间是有差异的。
生态学之所以被称为“自然的经济学”,原因之一在于它将资源投入与分配及其收益之间的权衡作为理解自然界各种生物学特征及适应进化的基础[35]。植物在其生长和发育过程中增加对根生物量的投入,保证了植株随个体大小的增长而不断增加的养分和水分需求[36]。也有研究发现,生物量的分配随着生育期而发生变化,叶生物量分配在幼年阶段较高,而在成熟阶段会减小[37],主要是植物在不同时期会动态调整生物量的分配以利于自身在有限资源条件下的生长和生存,即异速生长[31]。本研究中,平均地下生物量(0.94 g/株)较地上生物量小(7.32 g/株),这可能是在生长后期,猪毛蒿将营养物质尽量投入到繁殖生长,以保证后代的延续。从所处的生境来看,在土壤相对湿度高的条件下(土壤相对湿度>40%),猪毛蒿地下生物量相对较多(3.51 g/株),以提供生长所需要的营养,同时可以将更多的资源分配给地上部分的生长(30.79 g/株),因此整株生物量较大,这可以保证其在光照、空间、养分等方面的竞争力。
猪毛蒿株高、茎粗、根长、根重以及地上生物量均表现出随土壤相对湿度的增大而增加,表明水分条件对于猪毛蒿的生物量积累是至关重要的。当土壤相对湿度高时,相对资源水平和环境容量也高,猪毛蒿植株的生长旺盛,在充分利用有限资源的基础上,进行种群扩张,以占据更为有利的生境;当土壤相对湿度低时,由于资源的限制,土壤中可用水量减少会引起叶内水分含量下降,从而减慢光合速率,进而导致生物量积累的下降[38]。由此可以预测,荒漠草原猪毛蒿在土壤相对湿度较好的立地比土壤相对湿度较差的立地、降雨量多的年份会比降雨少的年份产生更高的生物量,这对于猪毛蒿的防控具有一定的参考价值。
随着进化-发育生物学的兴起,使得表型变异产生的发育过程和分子机制研究成为热点,表型可塑性的生态-进化学意义将是未来研究的重点[23]。此外,无论从短期还是长期看,可塑性响应都是一个动态过程,目前关于面对环境变化时种群可塑性动态及其对群落贡献的研究很少,还需要关于可塑性与物种当代或多代的生境适应、物种交互作用等问题之间关系的广泛研究[39]。以上涉及的内容和方向都将是未来研究的重点和热点。

