西藏巨柏双向电泳叶片总蛋白提取方法优化
尹泽超,王玉婷,王耀杰,桑利群,罗秋香,孟凡娟
(1.东北林业大学 生命科学学院,黑龙江 哈尔滨 150040; 2.西藏自治区林木科学研究院,西藏 拉萨 850000;3.西藏农牧学院,西藏 林芝 860000)
西藏巨柏Cupressus giganteaW.C.Cheng et L.K.Fu 为柏科Cupressaceae 柏木属Cupressus植物,主要分布于雅鲁藏布江朗县至米林附近的沿江地段,呈零星分布,是西藏特有的古树,又称“雅鲁藏布江柏木”,寿命可达千年[1]。同时也是较为典型的西藏“孑遗植物”,已经在《国家重点保护野生植物名录》中被列为国家Ⅰ级保护植物[2]。此外,西藏巨柏一直以来被用于制作藏香,在藏传佛教的宗教活动中发挥着重要作用,同时巨柏具有耐干旱、耐瘠薄等特征,针对巨柏这些特点开展研究具有较高文化价值和生态价值[3-4]。
但是,由于西藏植物生长在独特的地理环境条件,针对西藏植物开展的深入研究还较少[5]。因此,本研究利用巨柏为研究材料,对于植物生态学和进化生物学研究具有较高生态价值和科学价值。由于生长环境特殊,有关西藏巨柏的研究报道还较少,其蛋白组学方面的研究则更少。蛋白质组学(proteomics)是以蛋白质组为研究对象,可以从整体水平研究细胞、组织或生物体蛋白质组成及其变化规律的科学[6-7]。但是,由于蛋白质双向电泳技术受植物材料本身因素的影响较大,本试验中的研究材料巨柏叶片中含有多种次生代谢物质以及精油组分,在很大程度上影响了叶片蛋白的提取[3]。因此,本试验采取3 种叶片总蛋白质提取方法,同时进行了一些细节的优化,以筛选出一种可获得高质量西藏巨柏叶片总蛋白的提取方法,并建立了适合于西藏巨柏叶片蛋白质组分析的蛋白双向电泳技术体系,从而为从蛋白组水平研究西藏巨柏奠定理论基础。
1 材料与方法
1.1 试验材料及药品使用
将西藏巨柏种子播种于蛭石和土(1 ∶3)混合的土壤中,待叶片生长至30 d 左右进行叶片总蛋白的提取。其中主要使用三氯乙酸,丙酮,醋酸铵,蛋白酶抑制剂,Tris 饱和酚和水饱和酚等化学药品,且皆为化学纯。
1.2 提取方法
1.2.1 酚抽提法
取3 g 巨柏叶片放入研钵中,加入少量液氮,充分研磨;研磨至细小粉末状时,加入Tris 饱和酚和抽提液,用清洁后的药勺转移至50 mL 离心管中;用漩涡震荡器充分震荡,每震荡1 min 冰上冷却1 min,直到离心管中的固体粉末变为液体即可;在4 ℃,10 000 r/min 条件下离心20 min,将上层酚相转移至新离心管中,放置在冰上;向下层水相中加入抽提液和Tris 饱和酚,使用漩涡震荡器震荡30 min,每震荡1 min 冰上冷却1 min,使蛋白质得到充分提取;于4 ℃,10 000 r/min 离心20 min,将酚相转移至新50 mL 离心管中;两次所得酚相合并,加入酚相5 倍体积的醋酸铵甲醇于酚相中,震荡30 s,放置在-20 ℃冰箱中沉淀1 h 或者沉淀过夜;于4 ℃,10 000 r/min 离心15 min,弃上清,加入醋酸铵甲醇,将沉淀沿着管壁分散开,充分混匀,-20 ℃沉淀15 min,重复3 遍;于4℃,10 000 r/min 离心15 min,加入80%丙酮溶液,将沉淀沿着管壁分散开,充分混匀,-20 ℃沉淀15 min;加入100%丙酮溶液,吸打沉淀并充分混匀,-20 ℃沉淀15 min,重复3 遍;晾干,使沉淀干燥,保存于-80℃后备用。当电泳时,加入蛋白样品10 倍体积的裂解液,室温裂解1 h;于4℃,13 000 r/min 离心0.5 h,将上清转移至1.5 mL 离心管中,上清液即为蛋白样品。
1.2.2 TCA/丙酮法
取3 g 西藏巨柏叶片放入研钵中,加入少量聚乙烯吡咯烷酮(PVP)及液氮进行充分研磨;研磨至细小粉末状后分装于5 mL 离心管;加入10%TCA 丙酮于离心管中,充分混匀,再放入-20 ℃冰箱中过夜;然后于4 ℃、13 000 r/min 离心20 min;弃去上清液,加入80%丙酮溶液洗涤沉淀;-20℃反应20 min,4℃、13 000 r/min 离心20 min;弃去上清液,加入100%丙酮混匀,-20 ℃反应20 min。再于4℃、13 000 r/min 离心20 min;用100%丙酮重复洗涤直到沉淀为白色,最后弃去上清液,使用冻干机冻对沉淀进行干燥后按0.1 克加1 mL 的比例加入水饱和酚,再加入1 µL0.1 mol 的DTT,漩涡震荡混匀,至于冰上放置1 h,期间不时震荡;4 ℃,13 000 r/m 离心30 min,吸取上清液,并加入3 倍体积的醋酸铵甲醇和1 µL0.1 mol 的DTT,放置于-20 ℃过夜;重复加入饱和酚提取蛋白的过程,将最终加入醋酸铵甲醇的试管放置于-20 ℃;之后4 ℃、13 500 r/min 离心5 min,弃去上清液;加80%丙酮并用剪过的枪头吸打,-20 ℃反应20 min;然后于4 ℃、13 500 r/min 离心5 min,弃去上清液;加入100%丙酮,并用剪过的枪头吸打,-20 ℃反应20 min;然后于4 ℃、13 500 r/min 离心5 min,弃去上清液;晾干,使沉淀干燥,将沉淀保存于-80 ℃备用。电泳应用蛋白时,方法同上。
1.2.3 TCA/丙酮优化法
对TCA/丙酮法进行细节优化,对具体步骤进行如下调整:样品在用TCA 丙酮处理后,增加丙酮的清洗次数,在清洗过程中,使用剪过的枪头,清洗直到粗蛋白粉末可以在丙酮清洗液中自然沉降为止;在醋酸铵甲醇清洗蛋白质样品的过程中,增加2 次使用醋酸铵甲醇清洗的步骤,并且适当增加用丙酮清洗的次数,直到蛋白样品可以在清洗液中自然沉降;同时延长蛋白质样品在空气中晾干的时间,保证没有丙酮残留;在裂解液中添加蛋白酶抑制剂,并且在超声的环境下进行裂解;与水化液混合后,于4 ℃,13 000 r/min离心30 min,吸取样品时注意不要吸出沉淀物。
1.3 蛋白定量及一向电泳
采用2-D Quant Kit 试剂盒进行蛋白定量的分析测定。每个样品重复测定3 次,取平均值。分别配置分离胶和浓缩胶,在胶孔中加入蛋白样品,根据蛋白质浓度确定上样体积,不够30 µL 的加入蛋白Buffer 补足,用SDS 缓冲液覆盖已经上样的胶孔,注意不要产生气泡或者把蛋白样品溢出,补充SDS缓冲液至液面完全覆盖胶孔,盖上胶条槽盖子,连接电泳仪,恒压80 V 进行3 h。染色等具体方法参考曹原等[6]。用扫描仪进行扫胶,把图片保存为 TIF 格式。扫描完成后对扫描图片进行分析。
1.4 等电聚焦
在胶条槽中加入蛋白质样品,根据蛋白质浓度确定上样体积,不够250 µL 的加入水化液补足,将13cm,pH 值为4.0~7.0 的胶条放入胶条槽,注意不要产生气泡,盖上胶条槽盖子,置于一向电泳仪(Ettan IP Gphor Ⅱ),等电聚焦程序见表1。
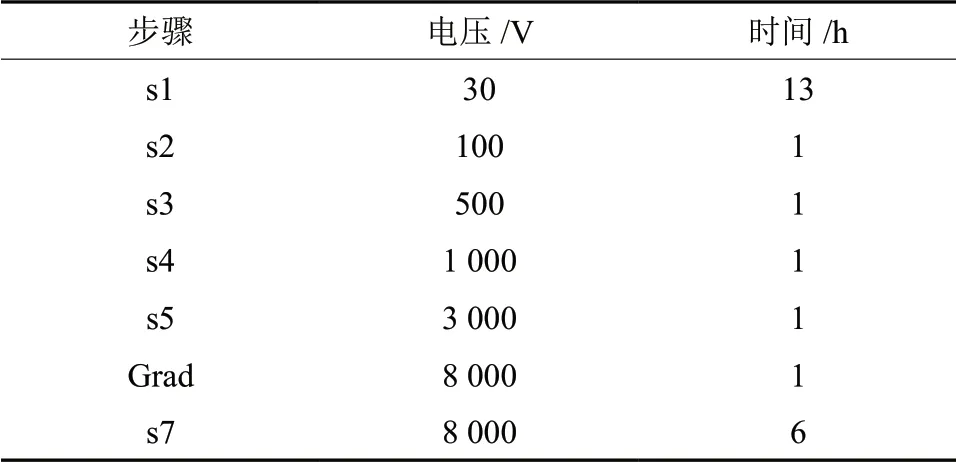
表1 等点聚焦程序Table1 Equal point focusing procedure
第二向SDS-PAGE 的步骤和染色等具体方法参考曹原等[8],并加以改良。用扫描仪进行扫胶,把图片保存为 TIF 格式进行后期比对分析。
2 结果与分析
2.1 不同提取方法对蛋白浓度的影响
由表2可以看出:采用TCA/丙酮法提取的蛋白质浓度高于采用酚抽提法TCA/丙酮法改良法,对TCA-丙酮法进行细节优化后蛋白的浓度虽然有些下降,但却在很大程度上提高了蛋白的纯度,可能方法二提取的蛋白含有一些可以影响蛋白的浓度的杂质。

表2 不同方法提取的蛋白浓度Table2 Concentrations of proteins extracted by different methods
2.2 不同提取方法对蛋白双向图谱的影响
图1为利用3 种不同提取方法对西藏巨柏叶片总蛋白的一向凝胶电泳扫描图。从图中我们可以发现:采用酚抽提法提取的蛋白图谱中,有较多蛋白条带丢失,同时由于丙酮清洗的次数较少,也导致了在大于38 kDa 的蛋白条带清晰度不够;而使用TCA 丙酮法提取的蛋白,蛋白条带数有明显增加趋势,但是大于38 kDa 的蛋白条带不够清晰的问题依旧存在;针对蛋白条带不够清晰的问题,利用TCA/丙酮法并进行了进一步的优化,主要通过增加丙酮清洗次数,利用超声清除残留核酸,通过高速离心沉淀大部分杂质等方法,从而很大程度上提高了蛋白的纯度,在图谱中也可以看到蛋白条带表现清晰。

图1 3 种方法提取蛋白质的一向凝胶电泳扫描图像Fig.1 Continuous gel electrophoresis scanning of proteins by three methods
本试验采取了3 种提取方法分别提取西藏巨柏叶片的总蛋白,比较了3 种不同提取方法的试验结果,同时对双向电泳图谱的影响进行了对比分析(见图2)。通过对比3 张凝胶扫描图,我们可以发现:采用酚抽提法提取的双向电泳图显示有较多的小分子蛋白出现遗失,尤其是碱性端丢失现象比较严重,而且由于丙酮清洗次数较少,图谱中出现明显的横带条纹(图2a)。而使用TCA 丙酮法提取的蛋白双向电泳图显示:蛋白点数量明显增多,但依旧存在较多横纹以及竖纹,尤其是凝胶上部的一些连续的蛋白点分离效果较差(图2b)。采用TCA/丙酮优化法,针对出现较多横竖条纹的现象有所改善,这主要是由于增加了清洗次数,并通过超声清去除了蛋白样品中的核酸成分,并在上样前,通过高速离心的方法,将大部分杂质沉淀在底部而不吸出,从而很大程度上提高了蛋白样品纯度,因此双向电泳图谱中的蛋白点清晰可见,且分布均匀(图2c)。
3 结论与讨论
高质量蛋白质的提取是蛋白质双向电泳能否成功的关键环节,为了获得高质量的叶片蛋白质,不仅需要在提取过程中减少蛋白样品的损失,还要保证样品的纯度[8]。因此,为了保证蛋白样品的浓度和纯度,应该考虑多种因素,首先,对西藏巨柏叶片进行充分研磨是首要的关键步骤,同时使用优质的药品对蛋白进行充分溶解也是必要的环节。此外,在蛋白提取过程中,应避免使用那些可以对蛋白造成过多降解的药品(如:β-巯基乙醇、DTT、蛋白酶抑制剂等)[9-10]。

图2 3 种方法提取蛋白的双向电泳图谱Fig.2 Two-dimensional electrophoresis maps of proteins extracted by three methods
由于西藏巨柏叶片中含有大量对蛋白提取造成影响的物质,这是导致西藏巨柏叶片高质量蛋白质困难的直接因素,这一问题如果不能解决,将会对后期蛋白双向电泳扩增产生较大影响,例如会导致:蛋白点分离效果差;较多横竖条纹出现;分辨率降低;胶板背景脱色不彻底等问题的出现。因此在本研究中,针对蛋白提取过程中的细节问题进行了优化,从而在双向电泳图谱中蛋白点的数量以及分辨率方面有了明显的改善。
通过对比不同方法获得的蛋白图谱,可以发现:与方法3 相比,采用方法一和方法二会导致电泳图谱出现严重的拖尾现象,且方法一提取的蛋白点有较大的损失,同时蛋白点的分离效果也较差,而且不规则的形状严重影响了之后的对比分析。而采用方法3 通过增加提纯步骤,所获得的蛋白质浓度较高,凝胶上的蛋白点数目也有所增加,而且不同蛋白点之间分离较为彻底,同时蛋白点形状更接近较为规则的圆形,较利于后期的分析比对。
在对黄瓜根系[7]、光核桃叶片[5]等叶片的蛋白质提取条件优化的结果也显示:TCA-丙酮法提取的蛋白质量优于酚抽提法。而王新芳等对大豆进行总蛋白双向电泳条件优化的试验结果表明,酚抽提法提取的蛋白质量要优于TCA-丙酮法[6,11]。这些不同方法对不同植物材料的适用性,可能是因为不同植物组织含有的成分不同。因此,要获得不同植物的优质蛋白,需要根据植物自身因素来确定。同时,综合这些方法也发现:优化一些操作细节操作,同时使用一些优质的药品对实验的结果有很大帮助。本试验在TCA/丙酮法的基础上进行了细节优化处理,可以有效的抑制蛋白酶活性,同时去除糖类、盐类等杂质的干扰,从而获得了高质量的西藏巨柏叶片的总蛋白样品以及蛋白点清晰的蛋白质图谱,也为后期的对比分析工作奠定了良好的基础。
本研究只通过3 种方法对巨柏叶片的总蛋白图谱进行了比较,确定了适合巨柏蛋白的提取方法,并获取到了高质量的巨柏蛋白样品,为今后针对该物种进化对环境适应机理方面的深入研究奠定了基础。
采用TCA/丙酮优化法,同时注意操作细节,可以获得高质量的西藏巨柏叶片总蛋白样品,为后续有关西藏巨柏的蛋白组质组学研究奠定了基础。

