手性自组装短肽对子宫创伤修复的影响
吴书祎,兰世建,文静,赵天鑫,黄岚,罗忠礼
手性自组装短肽对子宫创伤修复的影响
吴书祎,兰世建,文静,赵天鑫,黄岚,罗忠礼
重庆医科大学 基础医学院,重庆 400016
本研究旨在探索手性自组装短肽在大鼠子宫创伤修复过程中发挥的作用。通过圆二色谱仪分析手性自组装短肽的二级结构;刚果红染色观察短肽自组装过程;红细胞裂解实验检测短肽对细胞膜的裂解作用;通过在模拟子宫创伤大鼠模型上引入手性自组装短肽,利用HE染色及免疫组织手段分析其在子宫创伤修复过程中的影响。结果显示,手性自组装短肽二级结构均为稳定的β折叠;可在盐离子触发下自组装形成致密的膜状结构;短肽自组装前后对细胞膜无裂解作用;可为细胞提供三维培养支架;Hela细胞在短肽形成的水凝胶环境中可持续生长;动物实验结果表明,手性自组装短肽可明显加快子宫修复过程。手性自组装短肽作为新型生物工程材料,可构建细胞三维培养环境并用于子宫创伤修复。
手性自组装短肽,子宫创伤修复,大鼠模型
子宫为胚胎植入和生长提供了最重要的内部环境,在妊娠建立与维持方面有着不可替代的作用。我国每年约有1 300万次人工流产发生,手术中机械性的刺激损伤可能造成感染、内膜变薄等[1-4],进而影响子宫腔的正常形态功能,最终导致不孕、习惯性流产等产科疾病。而子宫环境的复杂性,决定了药物很少能直接作用于患处。
子宫病理性创伤后自发修复困难。内膜与基底层同时受损,可导致内膜干细胞受损或缺失。与此同时,局部感染和炎症破坏干细胞微环境[5-6],导致细胞修复障碍,血管再生受阻,腺体减少萎缩,进而造成宫腔局部内膜缺失,宫壁产生纤维化或粘连等现象[7-8]。
自组装短肽是一种新型纳米生物支架材料,具有构建仿细胞外基质(Extracellular matrix,ECM) 的功能,能部分模拟ECM功能[9-11]。且自组装短肽仅由氨基酸构成,对生物体无毒害作用[12],具有良好的生物相容性[13]。本课题组在前期研究中发现自组装短肽在心肌修复、快速止血、皮肤创伤[14-16]等再生修复方面具有良好应用。
本研究选用的自组装短肽Sciobio-Ⅱ与Sciobio-Ⅲ均由16个氨基酸残基构成,纯度分别是96.18%与97.03%。我们通过理化性质实验研究Sciobio-Ⅱ与Sciobio-Ⅲ自组装形态及效果;体外细胞实验检测其是否具有良好的生物相容性;通过动物实验分别探究Sciobio-Ⅱ与Sciobio-Ⅲ对子宫创伤模型的修复效果。
1 材料与方法
1.1 材料
本研究使用的手性自组装短肽Sciobio-Ⅱ与Sciobio-Ⅲ由成都赛恩贝生物技术有限公司赠送;磷酸盐缓冲剂 (PBS, 北京鼎国昌盛);高糖DMEM培养基、胰蛋白酶 (Hyclone,美国);青霉素混合液 (Genview,美国);4%多聚甲醛固定液、DAB显色试剂盒 (上海碧云天);刚果红染液 (Genivew,美国);免疫组织化学染色试剂盒 (北京中杉新桥);兔抗MMP-9抗体、鼠抗VEGF抗体(Proteintech,美国);孕马血清注射用血促性素 (PMSG,赤峰波恩药业,批号:兽药字(2012) 050074564);注射液用绒促性素 (HCG,丽珠制药);去离子水;生理盐水。
1.2 方法
1.2.1 短肽溶液配制
分别称取Sciobio-Ⅱ与Sciobio-Ⅲ冻干粉末各10 mg,1 mL去离子水溶解,制成10 mg/mL短肽母液,4 ℃冰箱保存备用。等体积PBS溶液与短肽母液混合,放置于室温下,短肽可发生自组装现象,得到浓度5 mg/mL短肽水凝胶。
1.2.2 检测分析短肽二级结构
圆二色谱仪 (AVIV 400 CD sepectrometer) 对Sciobio-Ⅱ与Sciobio-Ⅲ进行CD检测:分别用PBS与短肽母液配制100 μmol/L Sciobio-Ⅱ与Sciobio-Ⅲ溶液,取400 μL于石英比色皿中,室温下进行CD检测[16]。
参数设置:扫描波长190−260 nm,波长间隔0.5 s,光径2 mm。导入测量值,根据下列公式计算[θ]值,横坐标为波长,纵坐标[θ]作图[16]。
[θ]=[m(deg)]/[10(peptide)ln]
1.2.3 宏观观察短肽自组装过程
用PBS与短肽母液分别配制5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ溶液,37 ℃孵育24 h,在自组装过程第0 h、4 h和24 h,分别吸取10 μL Sciobio-Ⅱ与Sciobio-Ⅲ溶液滴于载玻片上,刚果红染色约20−30 s,镜检观察[16]。
1.2.4 红细胞裂解实验
1) 生理盐水与去离子水分别配制浓度为1、10、100 μg/mL的Sciobio-Ⅱ与Sciobio-Ⅲ溶液;2) 取SD大鼠腹主动脉血,EDTA抗凝,2 000 r/min离心15 min,弃上清;生理盐水洗涤离心3次,至上层澄清透明;3) 分别使用3种不同浓度的短肽溶液稀释红细胞悬液,至其终浓度为2%,作为实验组;去离子水稀释红细胞悬液为阳性对照组;生理盐水稀释红细胞悬液为阴性对照组;4) 样本置于37 ℃下水浴孵育1 h,5 000 r/min离心15 min;吸取200 μL上清液,酶标仪检测其在570 nm处的吸光度值。
1.2.5 构建Hela细胞贴壁和空间三维培养体系
细胞贴壁培养:将Hela细胞复苏后加入培养基重悬为细胞悬液,接种于25 cm2培养瓶,加入高糖DMEM培养基 (10%胎牛血清,1%青链霉素混合液),置于37 ℃、5% CO2细胞培养箱中培养。
细胞三维培养:待细胞二维培养生长覆盖率达90%时进行三维培养。用去离子水和短肽粉末分别配制5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,4 ℃保存。0.25%胰蛋白酶消化后离心,弃上清液加入蔗糖溶液吹打重悬,将细胞浓度调整为约1×105个/mL,分别加入等体积Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,将混合液滴加入96孔板,置于细胞培养箱中孵育5 min,然后每孔加入100 μL培养基,放置于37 ℃、5% CO2细胞培养箱孵育。
1.2.6 CCK-8检测三维环境中细胞活性
1) 取96孔板中贴壁和空间三维培养的Hela细胞,在实验第1、3、5天进行酶标仪检测;2) 每孔加入10 μL CCK-8溶液,37 ℃孵育2–4 h;3) 检测450 nm处吸光度() 值,其中值越大,则细胞活力越强,细胞增殖数量越多。
1.2.7 制备大鼠假孕模型
雌性SD大鼠于颈部皮下注射50 IU PMSG,48 h后皮下注射30 IU HCG,定义注射HCG 24 h后,为假孕第1天[17]。
1.2.8 建立大鼠子宫创伤模型
1) 体重200-220 g的SD假孕模型大鼠,提前8 h对动物禁食,7%水合氯醛溶液按0.4 mL/100 g进行麻醉。将麻醉后动物固定在特定试验台上,备皮消毒;2) 沿腹白线,距耻骨联合上方约2 cm处,纵切一个约2.5−3 cm的切口,依次切开皮肤、肌层、腹膜,进入腹腔,暴露Y型子宫;3) 在距子宫交汇处约1 cm处,水平作一个约0.5 cm的切口,放入特制刮宫针,沿子宫系膜对侧宫腔行走约1 cm后退出;4) 右侧子宫用微量注射器沿划痕注入30 μL 5 mg/mL Sciobio-Ⅱ与Sciobio-Ⅲ短肽溶液,右侧注入等量生理盐水;5) 缝合子宫,温热生理盐水冲洗腹腔,依次缝合关闭腹腔;6) 术后第3、7、14天颈椎脱臼处死大鼠,组织取材。用4%多聚甲醛溶液浸泡子宫组织样本,48 h 后石蜡包埋并切片、制片。
1.2.9 子宫组织苏木精-伊红(HE) 染色
1) 组织包埋块脱蜡:放入二甲苯-Ⅰ浸泡10 min后,再放入二甲苯-Ⅱ浸泡5 min;2) 梯度水化处理:放入100%酒浸泡1min后;放入95%酒精浸泡30 s;再放入80%酒精浸泡30 s;最后放入75% 酒精浸泡30 s;用自来水冲洗2–3次,每次约5 min;3) 染色:苏木素染色8 min;自来水冲洗2–3次;1%盐水乙醇6 s;氨水反蓝作用20 s,自来水冲洗;镜检至细胞核呈清晰蓝色;伊红染色2 min,自来水冲洗;4) 梯度脱水处理:放入80% 酒精浸泡30 s后;再放入95% 酒精浸泡30 s;然后放入100% 酒精浸泡5 min;最后放入无水酒精浸泡2 min;5) 透明:放入二甲苯-I浸泡2 min,再放入二甲苯-II浸泡2 min;6) 中性树脂封片,光镜下观察。
1.2.10 子宫组织免疫组织化学染色
1) 烤片:切片置于60 ℃ 电热恒温烤箱,过夜;2) 组织包埋块脱蜡:放入二甲苯-I浸泡10 min后,再放入二甲苯-Ⅱ浸泡5 min;3) 梯度水化处理:放入100%酒浸泡1 min后;放入95%酒精浸泡30 s;再放入80%酒精浸泡30 s;最后放入75% 酒精浸泡30 s;用自来水冲洗2–3次,每次约5 min;4) 修复:放入0.1 mol/L柠檬酸混合液,高温加热至沸腾,自然冷却。去离子水冲洗5 min,PBS冲洗5 min;5) 阻断:3% H2O2孵育15 min,阻断内源性过氧化物,PBS冲洗10 min;6) 滴入一抗,4 ℃ 孵育过夜;7) 室温孵育30 min,滴入二抗,孵育30 min;8) DAB显色;9) 苏木素染色,脱水处理步骤同前;10) 中性树脂封片,光镜下观察。
2 结果与分析
2.1 手性自组装短肽自组装形态及效果
短肽Sciobio-Ⅱ及Sciobio-Ⅲ在37 ℃下孵育24 h后,可在倒置EP管中观察到其呈现凝胶状(图1);进一步刚果红染色检测,我们发现短肽在盐离子溶液中自组装0 h时,呈现较为分散的细密流沙状结构;4 h时,出现松散膜片结构;24 h后,Sciobio-Ⅱ和Sciobio-Ⅲ形成了颜色透明、稳定均一的膜结构(图2),其中Sciobio-Ⅱ成膜速度更快。由此,我们初步推测Sciobio-Ⅱ及Sciobio-Ⅲ,可为细胞培养提供足够的支撑,从而进行下一步实验。

图1 Sciobio-Ⅱ和Sciobio-Ⅲ水凝胶效果图

图2 Sciobio-Ⅱ和Sciobio-Ⅲ的刚果红染色图(Scale bar=200 μm)
2.2 手性自组装短肽的二级结构特征
经过圆二色谱(CD) 分析,两条自组装短肽的二级结构均为稳定的β折叠结构。且Sciobio-Ⅱ 在198 nm处有一强正峰,在212 nm处有一强负峰。Sciobio-Ⅲ与Sciobio-Ⅱ呈镜像相关,在198 nm处有一强负峰,212 nm处有一强正峰(图3)。
2.3 红细胞膜裂解实验
通过分析数据可得,3种不同浓度的Sciobio-Ⅱ及Sciobio-Ⅲ短肽溶液(1、10、100 μg/mL) 均对红细胞的裂解程度较低。与阳性对照组裂解度相差30%左右。结果表明,手性自组装短肽在自组装24 h前后对细胞膜都没有破坏与裂解作用,可作为下一步动物实验材料参与大鼠子宫创伤修复实验(图4)。
2.4 细胞在二维、三维环境中的形态观察
光学显微镜下观察可以看到,在二维培养中Hela细胞呈贴壁生长,分布均匀,细胞多为菱形;在三维培养中,细胞为圆球形,细胞透亮边界清晰,表现为分层生长。在三维环境中,细胞相较于二维环境生长较为缓慢,但生长状态较好,细胞数量持续增长(图5)。
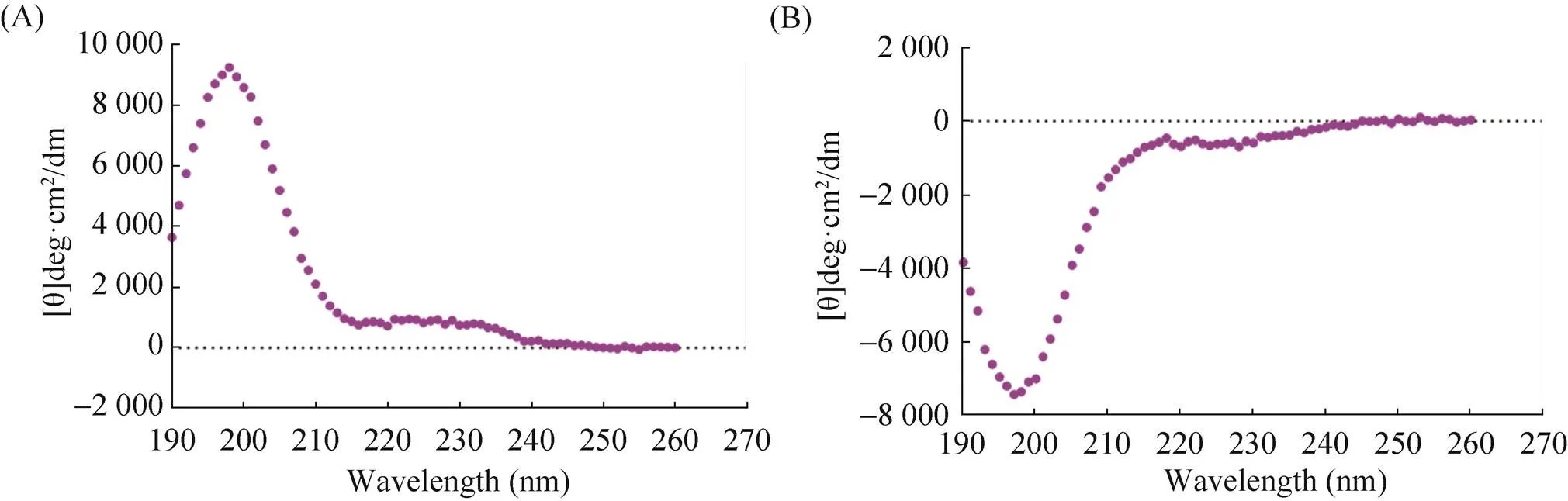
图3 Sciobio-Ⅱ和Sciobio-Ⅲ的圆二色谱图

图4 红细胞裂解实验

图5 Hela细胞在贴壁与三维培养环境中第3天的生长状态(Scale bar=200 μm)
2.5 细胞在贴壁和空间三维环境中的CCK-8 (Cell counting kit-8)检测
CCK-8检测结果显示,Hela细胞在由Sciobio-Ⅱ及Sciobio-Ⅲ构建的空间三维环境中增速与二维环境相比较为缓慢,但未出现细胞数量减少,说明Hela细胞可以在Sciobio-Ⅱ及Sciobio-Ⅲ构建的三维环境中生长,短肽Sciobio-Ⅱ及Sciobio-Ⅲ对细胞正常生长、增殖无抑制作用(图6)。
2.6 大鼠子宫组织HE染色
实验第3天,Sciobio-Ⅱ短肽组基层细胞排列基本有序,Sciobio-Ⅲ短肽组腺体形态与Sciobio-Ⅱ 组相比较为混乱,对照组宫腔内可见脱落物,内膜形态异常,内膜层与基层界限模糊。第5天,Sciobio-Ⅱ组基层细胞增多,Sciobio-Ⅲ组较Sciobio-Ⅱ组仍可见基层细胞排列紊乱,对照组出现膜上皮细胞粘连。实验第14天,短肽组基本完成修复过程,与Sciobio-Ⅲ组相比,可见Sciobio-Ⅱ组基底层细胞数量更多,且排列趋向规律,腺体增多;对照组仍可见内膜与腺体出现复层扁平上皮细胞,腺体上皮细胞异常(图7)。

图6 Hela细胞在贴壁、三维体系中的CCK-8检测
2.7 免疫组织化学染色
实验选取在子宫修复过程中发挥重要作用的基质蛋白酶-9 (MMP-9) 与血管内皮生长因子(VEGF) 进行免疫组织化学染色。结果显示:实验第7天,VEGF主要表达在Sciobio-Ⅱ与Sciobio-Ⅲ腔内膜上皮、腺体上皮广泛表达,对照组阳性表达水平较低;第14天,3组均可见VEGF阳性水平上升,短肽组表达量更高,其中Sciobio-Ⅱ组在近腔侧基质中表达略高于Sciobio-Ⅲ组。MMP-9主要在近肌层基质中,实验第7天,短肽组阳性表达均高于对照组,其中Sciobio-Ⅱ组阳性水平略高于Sciobio-Ⅲ组;第14天,对照组中阳性表达分散在内膜基质中,短肽组仍集中在近肌层基质,其中Sciobio-Ⅲ组表达水平略高于Sciobio-Ⅱ组(图8)。
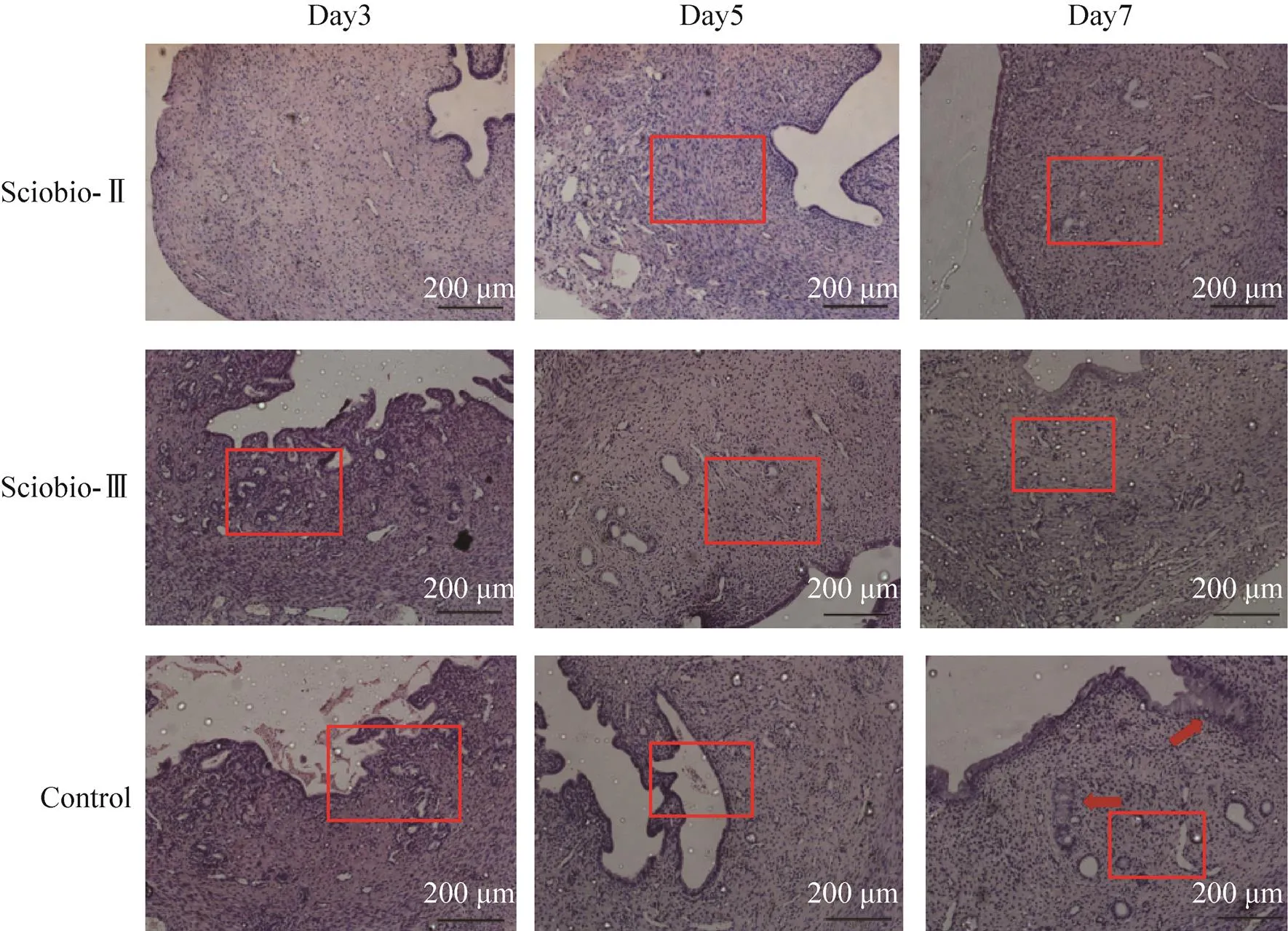
图7 手性自组装短肽对子宫修复的HE染色图(Scale bar=200 μm)
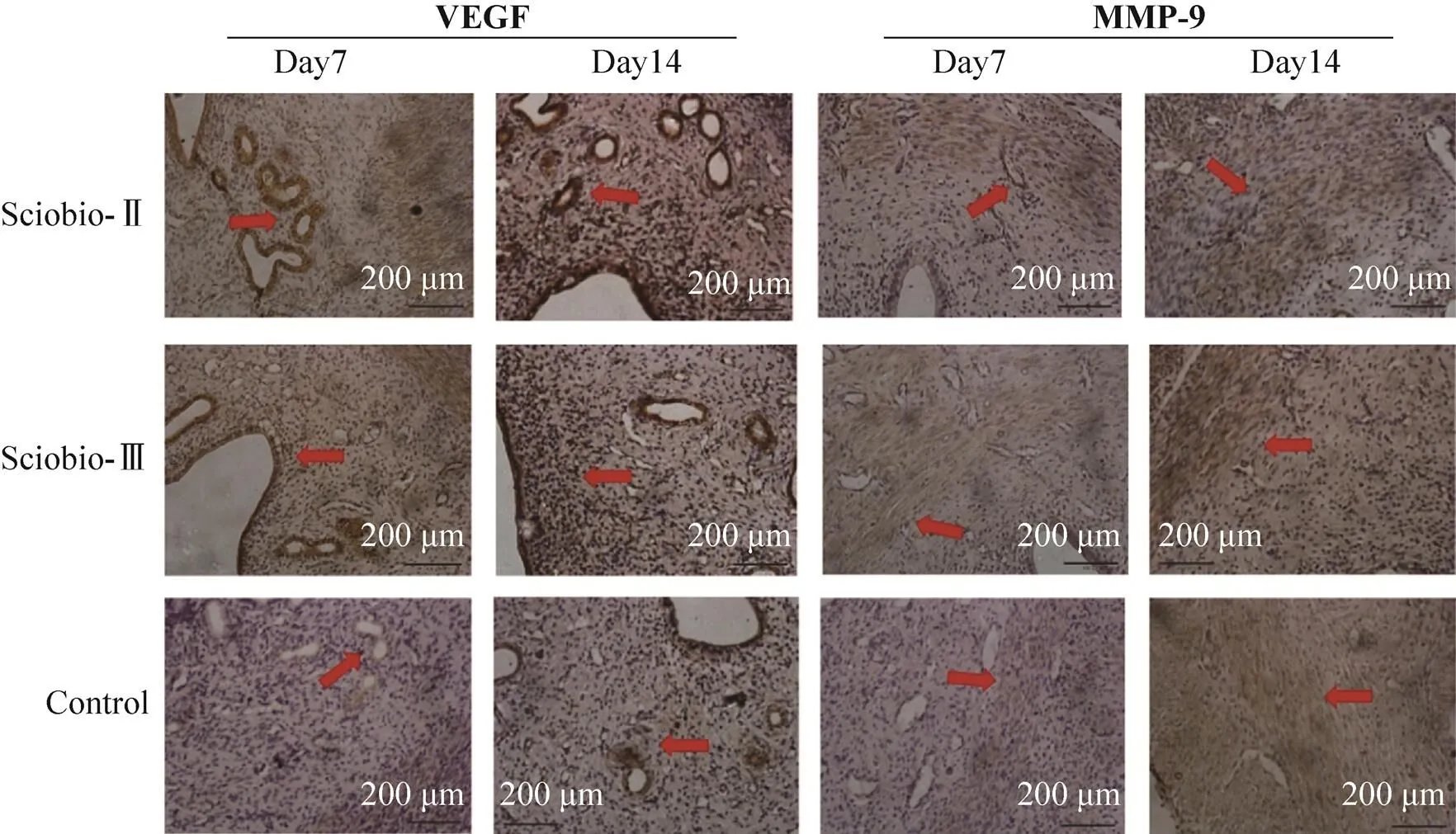
图8 手性自组装短肽对子宫修复的免疫组织化学染色(Scale bar=100 μm)
3 讨论
子宫创伤是人工流产术后常见损伤,临床上,宫腔手术或感染一旦损伤子宫内膜基底层,会导致上皮、间质细胞再生障碍,新生血管形成受损,内膜难以实现自我修复[11],宫腔缺乏内膜覆盖,壁层可发生纤维化、瘢痕化及粘连,进而产生宫腔粘连(IUA)、月经不止、子宫瘢痕等并发症[17-19]。传统组织工程支架材料如合成聚酰类、去细胞基质、胶原类等存在组织强度大[20]、制备工序复杂和机械强度不足等缺点[21-22]。因此,构建适合体内培养的优质支架材料,成为子宫组织工程研究的关键。
本研究所用两条自组装短肽是由氨基酸合成的新型高分子材料,具有良好的生物相容性[23-25],在室温下均可自组装形成水凝胶结构;同时圆二色谱 (CD) 结果显示,Sciobio-Ⅱ及Sciobio-Ⅲ均可自组装形成纳米纤维交织的膜状结构,两者的二级结呈镜像相关的β折叠结构,其中Sciobio-Ⅱ的成膜速率更快。通过上述结果我们推测,Sciobio-Ⅱ及Sciobio-Ⅱ可为组织细胞提供一定的强度支撑,且构建成分单一、结构稳定。通过体外红细胞裂解实验与CCK-8细胞活性检测,提示在自组装短肽构建三维培养体系中,Hela细胞可持续生长,其中Sciobio-Ⅱ组细胞活动状态更加稳定。以上结果提示,手性自组装短肽对细胞无裂解作用,且细胞能在短肽形成的三维环境中持续增殖。动物实验我们制备假孕大鼠模拟刮宫术构建子宫创伤模型,结果显示,与对照组相比,短肽组中组织修复速度更快。在7 d与14 d两个时间点,短肽组VEGF表达量均高于对照组,其中Sciobio-Ⅱ组阳性水平更高。同时,与对照组相比,Sciobio-Ⅱ及Sciobio-Ⅲ实验组MMP-9表达量更稳定,其中Sciobio-Ⅱ与Sciobio-Ⅲ相比,两个时间点MMP-9表达量提升幅度更小。有研究者认为组织修复前期MMP-9高表达有利于细胞增殖与细胞外基质(ECM) 分泌[26-28],后期相对低表达可促进多余ECM吸收,消除水肿。由此我们推测手性自组装短肽在促进子宫修复过程中模拟了部分ECM功能,改善了创面细胞微环境,从而促进部分生长因子与蛋白的表达释放,加快创伤修复进程。
但手性自组装短肽促进修复的分子机制,以及其作为组织工程支架材料与种子细胞、生长因子结合应用研究,还需要进一步探索。期望其能为临床减少宫腔术后并发症提供新材料和新思路,并具有更广泛的研究价值与市场前景。
致 谢 感谢成都赛恩贝公司对本研究的赞助和支持。
[1] Luo ZL, Zhang SG. Designer nanomaterials using chiral self-assembling peptide systems and their emerging benefit for society. Chem Soc Rev, 2012, 41(13): 4736–4754.
[2] Zhang SG. Discovery and design of self-assembling peptides. Interface Focus, 2017, 7(6): 20170028.
[3] Cai SX, Liu AR, Chen S, et al. Activation of Wnt/β-catenin signalling promotes mesenchymal stem cells to repair injured alveolar epithelium induced by lipopolysaccharide in mice. Stem Cell Res Ther, 2015, 6: 65.
[4] Luo ZL, Zhao XJ, Zhang SG. Structural dynamic of a self-assembling peptide d-EAK16 made of only D-amino acids. PLoS ONE, 2008, 3(5): e2364.
[5] Saeed D, Maryam Y, Mehraveh G, et al. Induced abortion: a systematic review and meta-analysis. Mater Sociomed, 2017, 29(1): 58–67.
[6] Gabriela FM, Carla O, Susana V, et al. Apoptosis is increased and cell proliferation is decreased in out-of-phase endometria from infertile and recurrent abortion patients. Reprod Biol Endocrinol, 2010, 8: 126.
[7] Ying L, Reshef T, Nicola P, et al. Systemic administration of bone marrow–derived cells leads to better uterine engraftment than use of uterine–derived cells or local injection. J Cell Mol Med, 2018, 22(1): 67–76.
[8] Xu L, Ding LJ, Wang L, et al. Umbilical cord-derived mesenchymal stem cells on scaffolds facilitate collagen degradation via upregulation of MMP-9 in rat uterine scars. Stem Cell Res Ther, 2017; 8: 84.
[9] Ando K, Imagama S, Kobayashi K, et al. Effects of a self-assembling peptide as a scaffold on bone formation in a defect. PLoS ONE, 2018, 13(1): e0190833.
[10] Bellat V, Ting R, Southard TL, et al. Functional peptide nanofibers with unique tumor targeting and enzyme-induced local retention properties. Adv Funct Mater, 2018, doi: 10.1002/adfm.201803969.
[11] Hainline KM, Gu FQ, Handley JF, et al. Self-assembling peptide gels for 3d prostate cancer spheroid culture. Macromol Biosci, 2019, 19(1): e1800249.
[12] Ichihara Y, Kaneko M, Yamahara K, et al. Self-assembling peptide hydrogel enables instant epicardial coating of the heart with mesenchymal stromal cells for the treatment of heart failure. Biomaterials, 2018, 154: 12–23.
[13] Kokil GR, Veedu RN, Le BT, et al. Self-assembling asymmetric peptide-dendrimer micelles - a platform for effective and versatilenucleic acid delivery. Sci Rep, 2018, 8: 4832.
[14] Li Y, Cui T, Kong XD, et al. Nanoparticles induced by embedding self-assembling cassette into glucagon-like peptide 1 for improvingstability. FASEB J, 2018, 32(6): 2992–3004.
[15] Lu J, Wang X. Biomimetic self-assembling peptide hydrogels for tissue engineering applications. Adv Exp Med Bio, 2018, 1064: 297–312.
[16] Zhang HN, Li MM, Wen J, et al. Self-assembling peptide R2I4R2for skin wounds repairing. Chin Biotechnol, 2018, 38(2): 7–12 (in Chinese). 张慧楠, 李萌萌, 文静, 等. 自组装短肽R2I4R2对皮肤创伤快速修复过程的研究. 中国生物工程杂志, 2018, 38(2): 7–12.
[17] Li GB, Liu XF, Song CJ, et al. Experimental study of endothelial progenitor cell differentiation to endothelial cell on corpus luteum of pseudocyesis rats. Tianjing Med J, 2012, 40(6): 579–581 (in Chinese). 李广斌, 刘晓帆, 宋春静, 等. 骨髓内皮祖细胞在假孕大鼠黄体向血管内皮细胞分化的实验研究. 天津医药, 2012, 40(6): 579–581.
[18] Lin NC, Li XA, Hu YL. Establishing of rat uterus repair model after full-thickness injury. Prog Obstet Gynecol, 2015, 6: 401–404 (in Chinese).林娜成, 李新安, 胡娅莉. 大鼠子宫全层损伤修复模型的建立. 现代妇产科进展, 2015,6:401–404.
[19] Lin NC, Li XA, Hu YL. A review of endometrial repair after endometrial injury. J Southeast Univ: Med Sci Edi, 2011, 30(4): 636–640 (in Chinese).林娜成, 李新安, 胡娅莉. 子宫内膜损伤后修复的研究进展. 东南大学学报: 医学版, 2011, 30(4): 636–640.
[20] Zhu XY, Zhao HY, Wang L, et al. Effect of different vacuum pressures on incomplete abortion and endometrial injuries. Acta Med Univ Sci Technol Huazhong, 2014, 43(01): 106–108 (in chinese).祝鑫瑜, 赵海燕, 王莉, 等. 不同负压对不全流产以及子宫内膜损伤的影响. 华中科技大学学报, 2014, 43(01): 106–108.
[21] MacEwan MR, MacEwan S, Kovacs TR, et al. What makes the optimal wound healing material? A review of current science and introduction of a synthetic nanofabricated wound care scaffold. Cureus, 2017, 9(10): e1736.
[22] Mehralitabar H, Taghdir M, Naderi MH. A combination of bioactive and nonbioactive alkyl-peptides form a more stable nanofiber structure for differentiating neural stem cells: a molecular dynamics simulation survey. J Biomol Struct Dyn, 2018, 21: 1–21.
[23] Ruan H, Xiao RS, Jiang XH, et al. Biofunctionalized self-assembly of peptide amphiphile induces the differentiation of bone marrow mesenchymal stem cells into neural cells. Mol Cell Biochem, 2019, 450(1/2): 199–207.
[24] Avitabile C, Diaferia C, Della Ventura B, et al. Self-assembling of fmoc-GC peptide nucleic acid dimers into highly fluorescent aggregates. Chemistry, 2018, 24(18): 4729–4735.
[25] Brasted M, White CA, Kennedy TG, et al. Mimicking the events of menstruation in the murine uterus. Biol Reprod, 2003, 69(4): 1273–1280.
[26] Beltrami AP, Barlucchi L, Torella D, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration. Cell, 2003, 114(6): 764–776.
[27] Mabry KM, Payne SZ, Anseth KS. Microarray analyses to quantify advantages of 2D and 3D hydrogel culture systems in maintaining the native valvular interstitial cell phenotype. Biomaterials, 2016, 74: 31–41.
[28] Go BS, Sirohi S, Walker BM. The role of matrix metalloproteinase-9 in negative reinforcement learning and plasticity in alcohol dependence.Addict Biol, 2019: 1–11.
Chirality Self-assembling peptide for rats endometrial regeneration model
Shuyi Wu, Shijian Lan, Jing Wen, Tianxin Zhao, Lan Huang, and Zhongli Luo
College of Basic Medical Sciences, Chongqing Medical University, Chongqing 400016, China
Here we investigate the physical and chemical properties of chiral self-assembling peptides and the role of uterine trauma regeneration. The circular dichroism was used to analyze secondary structure of chiral self-assembled peptide, and Congo red staining was used to observe the macroscopic process of peptide self-assembling. Erythrocyte lysis assay was used to examine the cleavage of peptide on cell membrane. The nanofiber scaffolds self-assembled by Chiral self-assembling peptides were used as the three-dimensional culture material to observe the growth effect of Hela cell. CCK-8 (cell counting kit-8) was used to study cell viability level between 2D (2-dimensional) and 3D (3-dimensional) culture environment. Rats endometrium curettage model was founded to evaluate the changes by immunohistochemistry staining and and HE staining. The secondary structure of chiral self-assembling peptides was stable β-sheet, and peptide could form dense membrane structure after 24 hours self-assembling cultured in salt ions. There was no harmful for the cell membrane of the peptide before and after self-assembling. Animal experiments show that chiral self-assembling peptide can significantly reduce the inflammatory response, promote the production of neovascularization, and accelerate the repair process. Chiral self-assembling peptide, as a new type of scaffold material, can construct a three-dimensional cell culture environment and used to repair uterine trauma.
Chiral Self-assembling peptide, uterine repair, rats model
December 11, 2018;
March 4, 2019
Zhongli Luo. E-mail: Zhongliluo@163.com
10.13345/j.cjb.180515
吴书祎, 兰世建, 文静, 等. 手性自组装短肽对子宫创伤修复的影响. 生物工程学报, 2019, 35(6): 1079–1087.
Wu SY, Lan SJ, Wen J, et al. Chirality Self-assembling peptide for rats endometrial regeneration model. Chin J Biotech, 2019, 35(6): 1079–1087.
(本文责编 陈宏宇)

