TSP1对高糖诱导的肾小管上皮细胞损伤的影响研究
周才芳 曾秀琴 曾庆义
糖尿病肾病是常见的糖尿病微血管并发症,其是诱导终末期肾病发生的主要原因之一,肾小管上皮细胞具有调节水电解质平衡、分泌等作用,肾小管上皮细胞损伤是终末期肾病发生的重要病理变化[1-2]。研究显示,高糖可以诱导肾小管上皮细胞凋亡和氧化损伤,这可能是糖尿病肾病肾组织损伤发生的机制之一[3]。血小板反应蛋白1(thrombospondin1,TSP1)是一种与细胞凋亡、血管生成和细胞黏附等有关的多功能蛋白质,其在人体的脑组织、血管、肺脏和心脏等组织中广泛表达,在机体受到氧化应激以后,其在成纤维细胞、巨噬细胞和血管平滑肌细胞等多种细胞中高表达,TSP1参与肿瘤、衰老和免疫等相关疾病的发生[4-5]。目前的研究已经显示,TSP1在糖尿病肾病组织中高表达,TSP1表达水平与肾组织肾小管上皮细胞凋亡呈正相关[6-7]。本研究以肾小管上皮细胞为研究对象,通过慢病毒转染TSP-1 shRNA(shTSP-1),沉默TSP-1基因;以转染慢病毒为对照,探讨下调TSP1对高糖条件下肾小管上皮细胞损伤的影响,为研究糖尿病肾病肾小管组织损伤提供参考。
材料与方法
一、材料
肾小管上皮细胞HK-2购自中国科学院上海细胞资源中心;SYBR Premix Ex Taq Realtime PCR试剂盒、PrimeScript RT reagent Kit购自大连Takara公司;TSP1抗体购自美国BioVision公司;TSP1 shRNA慢病毒和对照慢病毒购自上海吉凯基因化学技术有限公司;引物由金斯瑞生物科技有限公司构建;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素 -8(interleukin-8,IL-8)含量检测试剂盒购自南京建成生物研究所;丙二醛(malonaldehyde,MDA)含量检测试剂盒购自北京索莱宝科技有限公司;活性氧(reactive oxygen species,ROS)含量检测试剂盒购自美国Abnova公司;活化的Caspase-3(c-caspase-3)抗体购自美国Santa Cruz Biotech公司;Polybrene购自美国Santa Cruz Biotechnology公司。
二、方法
1.细胞转染和分组:(1)对照组:肾小管上皮细胞,以5.6 mmol/L的葡萄糖细胞培养液培养。(2)高糖组:肾小管上皮细胞,以含有30 mmol/L的葡萄糖细胞培养液培养;(3)NC+高糖组:转染方法同干扰+高糖组,只是将转染的TSP1 shRNA慢病毒换成对照慢病毒。(4)干扰+高糖组:肾小管上皮细胞接种到24孔板内,放在37 ℃,5% CO2培养箱中培养,在倒置显微镜下观察细胞密度为50%时,把TSP1 shRNA慢病毒用含有10%胎牛血清的DMEM稀释,分别添加至24孔板内,感染复数调整为10,同时在孔内添加 5 μg/ml的 Polybrene,继续培养12 h,将原培养液吸弃后,添加新鲜的细胞培养液(含有10%胎牛血清的DMEM),继续培养3 d。用嘌呤霉素筛选10 d,取稳定感染TSP1 shRNA慢病毒的肾小管上皮细胞,用30 mmol/L的葡萄糖细胞培养液培养,用于后续实验。
2.高糖处理后肾小管上皮细胞中TSP1表达检测:细胞培养48 h以后,用Realtime PCR和Western Blot检测细胞中 TSP1表达水平。(1)Realtime PCR:高糖组和对照组细胞分别用PBS洗涤细胞,按每 10 cm2细胞加 1 ml的 TRIZOL,用 200 μl氯仿将RNA抽提以后,分别添加500 μl的异丙醇溶液沉淀RNA,75%乙醇溶液洗涤,紫外分光光度计检测OD 260 nm/OD 280 nm的比值(介于1.8 ~ 2.0之间)。取适量的RNA,按照PrimeScript RT reagent Kit进行反转录,合成的cDNA保存在-80℃。用SYBR Premix Ex Taq进行Realtime,PCR程序为:90℃,30 s;(95℃,5 s;60℃,30 s)×40个循环。按照2-△△CT方法计算分析TSP1的表达。GAPDH引物 Sense:5,-TGGGTGTGAACCACGAGAA-3',Antisense:5,-GGCATGGACTGTGGTCATGA-3'。TSP1 引物 Sense:5,-GGCCACTGCAGCTGATGCGATGC GTAA-3',Antisense:5,-GGACACAACGACTGGC TTCTGGAC-3'。(2)Western Blot:高糖组和对照组细胞分别用PBS洗涤2次,加入蛋白裂解液,于冰上裂解 30 min以后,4 ℃高速,12 000×g离心10 min,各组蛋白存在于上清液中。按照BCA法分别对蛋白定量检测以后,于-80℃保存。把蛋白样品与等体积的上样缓冲液混合,100 ℃煮沸反应5 min。依照每孔中的上样量为30 μg进行电泳,设置浓缩胶中电压为80 V,设置分离胶中电压为120 V,电泳总时长为2.5 h。在4 ℃条件下,以100 V电泳进行转膜,把存在于凝胶上的蛋白转移到PVDF膜上。PVDF膜在5 %牛血清白蛋白中37 ℃孵育结合2 h。PVDF膜置1 : 800稀释的TSP1抗体反应液中,于4 ℃过夜,再放置于1 : 3 000稀释的二抗中,37 ℃反应1.5 h。按照ECL发光试剂盒发光以后,GAPDH作为内参,对TSP1蛋白进行定量分析。
3.细胞中ROS水平检测:对照组、高糖组、NC+高糖组、干扰+高糖组细胞培养48 h以后,收集细胞,用DCFH-DA法检测细胞中ROS水平,步骤同试剂盒说明书,以激发波长为488 nm和发射波长为525 nm的荧光分光光度计检测荧光强度,用荧光强度表示ROS表达水平。
4.细胞培养液中MDA含量检测:对照组、高糖组、NC+高糖组、干扰+高糖组细胞培养48 h以后,收集细胞培养液上清,用硫代巴比妥酸法检测培养液中MDA含量,步骤同试剂盒说明书。
5.细胞培养液中TNF-α、IL-8含量检测:对照组、高糖组、NC+高糖组、干扰+高糖组细胞培养48 h以后,收集细胞培养液上清,用ELISA法检测培养液上清中TNF-α、IL-8含量,步骤同试剂盒说明书。
6.细胞凋亡检测:对照组、高糖组、NC+高糖组、干扰+高糖组细胞培养48 h以后,收集细胞,分别用300 μl的缓冲液将各组细胞悬浮以后,依次添加 Annexin V-FITC和PI工作液各 5 μl,置于流式细胞仪上检测凋亡情况,在检测前每组再添加200 μl的结合缓冲液。
7.细胞中c-caspase-3蛋白表达水平检测:对照组、高糖组、NC+高糖组、干扰+高糖组细胞培养48 h以后,收集细胞,用Western Blot方法检测细胞中c-caspase-3蛋白表达水平,步骤同上。
三、统计学分析方法
采用SPSS 21.0软件进行分析,细胞中TSP1 mRNA和蛋白表达量、细胞培养液中TNF-α、IL-8、MDA含量等用表示,两组均数差异比较采用独立样本t检验,多组均数间差异比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1.高糖诱导肾小管上皮细胞中TSP1表达:结果见图1和表1中所示,高糖处理可以诱导肾小管上皮细胞中TSP1转录和表达。
2.TSP1 siRNA下调高糖条件下肾小管上皮细胞中TSP1表达:结果见图2和表2中所示,在肾小管上皮细胞中转染TSP1 shRNA后,可以明显下调高糖条件下肾小管上皮细胞中TSP1转录和表达。
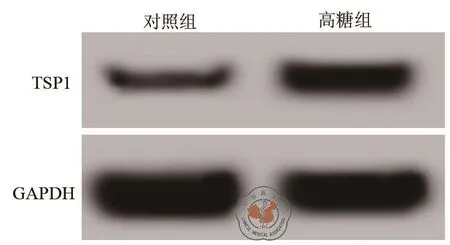
图1 Western Blot测定高糖对肾小管上皮细胞中TSP1表达影响
表1 高糖诱导肾小管上皮细胞中TSP1表达(±s)
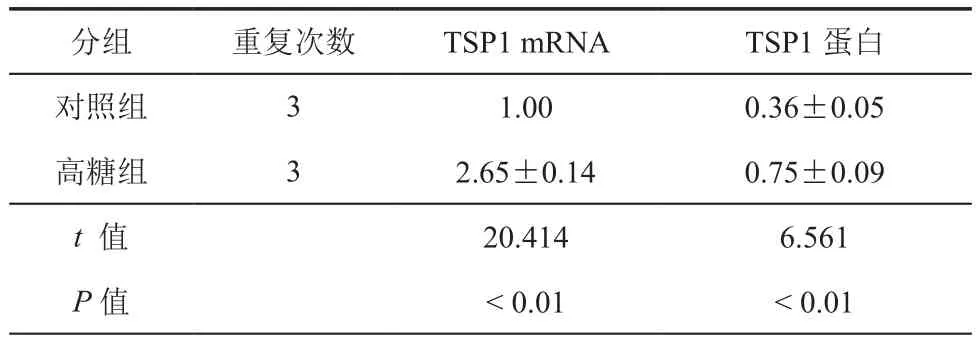
表1 高糖诱导肾小管上皮细胞中TSP1表达(±s)
分组 重复次数 TSP1 mRNA TSP1蛋白对照组 3 1.00 0.36±0.05高糖组 3 2.65±0.14 0.75±0.09 t 值 20.414 6.561 P值 < 0.01 < 0.01
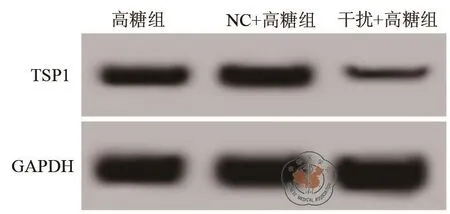
图2 Western Blot检测TSP1 shRNA对高糖条件下肾小管上皮细胞中TSP1表影响
表2 TSP1 shRNA下调高糖条件下肾小管上皮细胞中TSP1表达水平(±s)
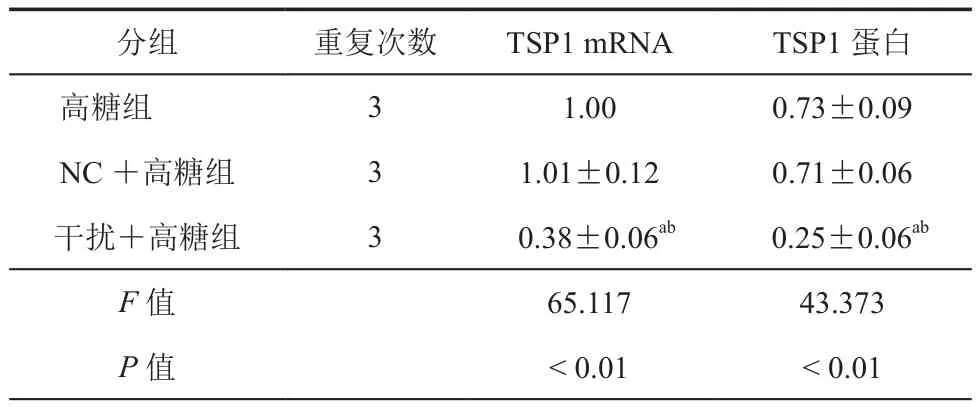
表2 TSP1 shRNA下调高糖条件下肾小管上皮细胞中TSP1表达水平(±s)
注:与高糖组比较,aP < 0.05;与 NC +高糖组比较,bP < 0.05
分组 重复次数 TSP1 mRNA TSP1蛋白高糖组 3 1.00 0.73±0.09 NC+高糖组 3 1.01±0.12 0.71±0.06干扰+高糖组 3 0.38±0.06ab 0.25±0.06ab F值 65.117 43.373 P值 < 0.01 < 0.01
3.下调TSP1减少高糖条件下肾小管上皮细胞炎症因子分泌:结果见表3中所示,高糖处理后的肾小管上皮细胞培养液中TNF-α、IL-8含量升高;下调TSP1可以下调高糖条件下肾小管上皮细胞培养液中TNF-α、IL-8含量。
4.下调TSP1减轻高糖诱导的肾小管上皮细胞氧化损伤:结果见表4,图3中所示,高糖处理后的肾小管上皮细胞中ROS水平升高,同时细胞培养液中MDA含量也升高;下调TSP1可以明显抑制高糖条件下肾小管上皮细胞中ROS表达,减少细胞培养液中MDA含量。
5.下调TSP1减少高糖条件下肾小管上皮细胞凋亡:结果见图4和表5中所示,高糖处理后的肾小管上皮细胞凋亡率升高,细胞中c-caspase-3蛋白水平升高;下调TSP1可以下调高糖条件下肾小管上皮细胞凋亡率和c-caspase-3蛋白水平(图5)。
表3 下调TSP1对高糖条件下肾小管上皮细胞培养液中TNF-α、IL-8 含量影响(±s)
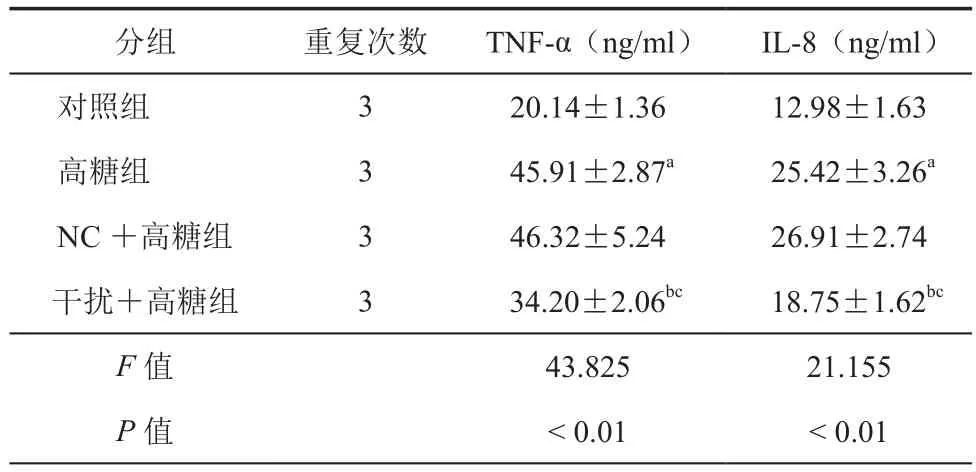
表3 下调TSP1对高糖条件下肾小管上皮细胞培养液中TNF-α、IL-8 含量影响(±s)
注:与对照组比,aP < 0.05;与高糖组比较,bP < 0.05;与 NC+高糖组比较,cP < 0.05
分组 重复次数 TNF-α(ng/ml)IL-8(ng/ml)对照组 3 20.14±1.36 12.98±1.63高糖组 3 45.91±2.87a 25.42±3.26a NC+高糖组 3 46.32±5.24 26.91±2.74干扰+高糖组 3 34.20±2.06bc 18.75±1.62bc F值 43.825 21.155 P值 < 0.01 < 0.01
表4 下调TSP1对高糖条件下肾小管上皮细胞中ROS和培养液中MDA含量影响(±s)
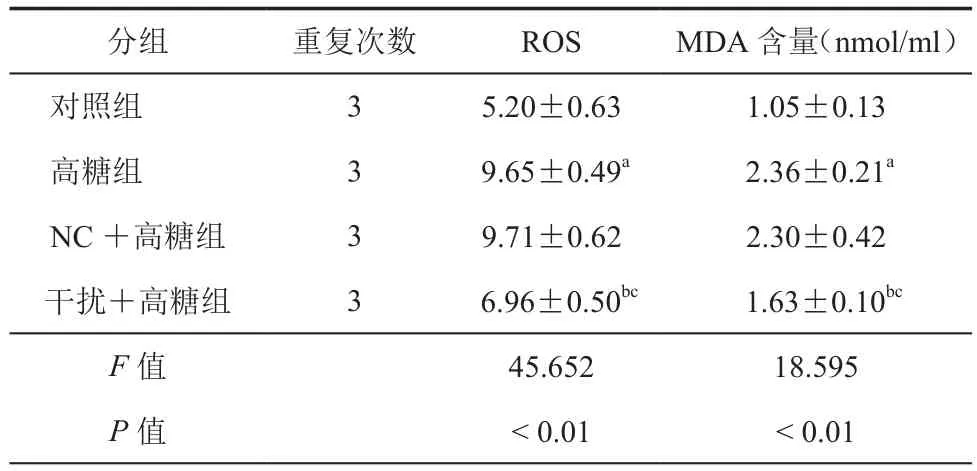
表4 下调TSP1对高糖条件下肾小管上皮细胞中ROS和培养液中MDA含量影响(±s)
注:与对照组比,aP < 0.05;与高糖组比较,bP < 0.05;与 NC+高糖组比较,cP < 0.05
分组 重复次数 ROS MDA含量(nmol/ml)对照组 3 5.20±0.63 1.05±0.13高糖组 3 9.65±0.49a 2.36±0.21a NC+高糖组 3 9.71±0.62 2.30±0.42干扰+高糖组 3 6.96±0.50bc 1.63±0.10bc F值 45.652 18.595 P值 < 0.01 < 0.01
表5 下调TSP1对高糖条件下肾小管上皮细胞凋亡和c-caspase-3蛋白水平影响(±s)

表5 下调TSP1对高糖条件下肾小管上皮细胞凋亡和c-caspase-3蛋白水平影响(±s)
注:与对照组比,aP < 0.05;与高糖组比较,bP < 0.05;与 NC+高糖组比较,cP < 0.05
分组 重复次数 凋亡率(%)c-caspase-3对照组 3 4.69±0.51 0.26±0.03高糖组 3 24.56±2.38a 0.85±0.09a NC+高糖组 3 23.92±2.69 0.86±0.07干扰+高糖组 3 18.48±1.23bc 0.45±0.04bc F值 69.632 69.187 P值 < 0.01 < 0.01
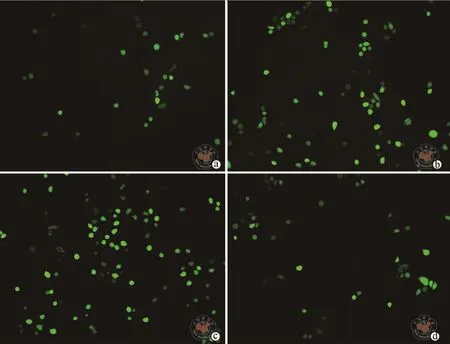
图3 荧光显微镜下观察下调TSP1对高糖条件下肾小管上皮细胞中ROS含量影响(×200)

图4 流式细胞术测定细胞凋亡变化
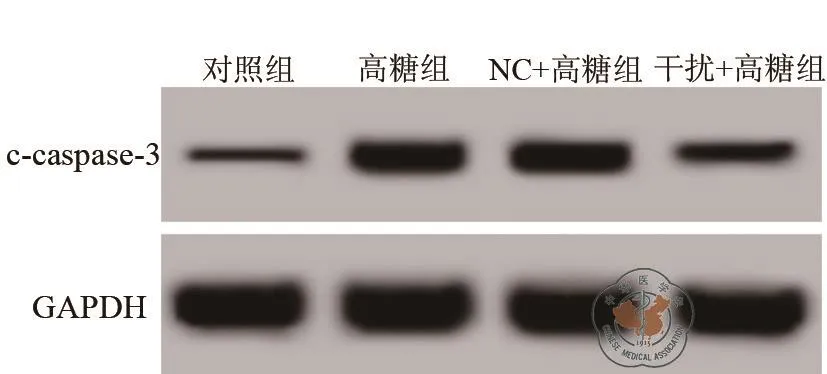
图5 Western Blot检测细胞中c-caspase-3蛋白水平
讨 论
糖尿病肾病是一种常见的引起终末肾疾病的原因之一,高糖环境下的肾小管上皮细胞功能损伤是糖尿病肾病发生的关键[8]。高血糖可以诱导肾组织中氧化应激和炎症损伤,诱导细胞凋亡[9-11]。本实验结果表明,高糖处理后的肾小管上皮细胞凋亡率升高,说明成功构建了糖尿病肾病肾小管上皮细胞损伤模型。
TSP1是一种糖蛋白,由3个相同的肽链构成的外基质糖蛋白,其分子量约为145 kDa,因最初是在血小板纯化中发现而得名[12]。TSP1蛋白含有6个功能结构域,分别发挥血小板调控、血管生成、诱导凋亡、钙离子结合和细胞黏附等作用[13]。正常情况下,TSP1在脑组织、肺脏等多种组织中表达,内皮细胞、巨噬细胞和血管内皮细胞等在受到炎症、氧化应激等刺激后能够高表达TSP1。TSP1可促进氧化损伤,诱导细胞凋亡发生[14]。很多研究显示,TSP1是一种与纤维化疾病发生有关的调控因子,在糖尿病肾病、糖尿病心肌病等组织中高表达。TSP1还能够诱导肾小管上皮细胞凋亡[15]。本实验结果显示,高糖处理后的肾小管上皮细胞中TSP1表达上调,与文献报道一致,均提示,TSP1在糖尿病肾病肾小管上皮细胞中表达上调。
肾小管上皮细胞是肾脏组织的重要组成部分,在受到外界因素刺激后,能够分泌大量的炎症因子,促进组织炎症反应[16]。TNF-α在糖尿病肾病肾组织中表达上调,其可以由肾小管上皮细胞分泌,是肾组织炎症反应的促进因子[17]。IL-8也是一种促炎因子,高血糖刺激肾脏后可以诱导IL-8的分泌和表达[18]。TSP1是一种炎症诱导因子,其表达缺失可以减轻组织和细胞炎症[19]。本组资料干扰+高糖组细胞培养液中的TNF-α和IL-8明显低于NC+高糖组,提示下调TSP1具有抑制高糖诱导的肾小管上皮细胞分泌TNF-α和IL-8、减轻炎症反应的作用。
研究表明,炎症与氧化应激反应密切相关,炎症因子可以刺激细胞中ROS产生,同时细胞中ROS过度积累可以诱导炎症因子分泌。细胞中过量的ROS能够诱导细胞中脂质发生过氧化,产生大量的MDA[20]。另外,ROS还可以激活细胞中Caspase凋亡蛋白的激活,诱导细胞凋亡发生,Caspase-3活化是细胞凋亡进入不可逆反应的标志[21]。本组资料干扰+高糖组的细胞中ROS水平明显低于NC+高糖组;培养液中MDA含量亦明显降低,提示下调TSP1的表达可以下调高糖条件下肾小管上皮细胞中ROS水平,减少细胞中MDA合成,同时下调TSP1还可以抑制高糖条件下肾小管上皮细胞中Caspase-3活化,减少细胞凋亡,其机制可能通过抑制高糖诱导的肾小管上皮细胞氧化应激而减少细胞凋亡。
本组资料表明,下调TSP1可能通过抑制高糖诱导的肾小管上皮细胞分泌炎症因子、减轻炎症损伤并减少细胞凋亡,TSP1可能是治疗糖尿病肾病的潜在靶点,为以后研究TSP1在糖尿病肾病中的作用机制奠定基础。

