体外诱导骨髓间充质干细胞向甲状腺滤泡细胞分化的实验研究
潘倩 章建全 张传森
甲状腺功能减退症发病率不断攀升,干细胞治疗甲状腺功能减退症的研究备受关注,选择适宜的种子细胞,并将其诱导成甲状腺滤泡细胞(thyroid follicular cells,TFCs)是关键环节。Lin等[1]首次将小鼠胚胎干细胞(mouse embryonic stem cells,ES)诱导成TFCs。此后,利用促甲状腺激素、活化素A、胰岛素或胰岛素样生长因子-1等诱导ES[2-4],但效果并不显著。研究热点继而转向ES及诱导多能性干细胞(induced pluripotent stem cells,iPS)中核转录因子8(paired box gene 8,PAX8)与甲状腺转录因子1(thyroid transcription factor 1,TTF1)基因过表达[5-8]。然而,ES及iPS面临的伦理争议势必限制其临床应用。骨髓间充质干细胞(bone marrow derived mesenchymal stem cell,BMSCs)为成体干细胞,可向内胚层分化,具有广阔临床应用前景。目前利用间充质干细胞诱导成甲状腺前体细胞已经有了初步可行性研究[9-11],但均未对分化程度鉴定及分化条件优化。本实验旨在通过甲状腺转录因子TTF1、PAX8及甲状腺滤泡细胞标志性蛋白分子钠/碘同向转运体(sodium/iodide cotransporter,NIS)、甲状腺过氧化物酶(thyroid peroxidase,TPO)、甲状腺球蛋白(thyroglobulin,Tg)探索BMSCs向TFCs分化的适宜条件。
材料与方法
一、材料
1、细胞株和实验动物:大鼠甲状腺滤泡细胞系(FRTL-5细胞系),购自 American Type Culture Collection(美国模式培养物保藏所,ATCC)。150 g雄性SD大鼠,购于上海第二军医大学实验动物中心。
2.细胞培养试剂及耗材:DF-12培养基(DMEM/F-12 Medium,液体,含15mmol/L HEPES,L-谷氨酰胺,500 ml)(美国Gibco公司);胎牛血清(fetal bovine serum,FBS)(美国Invitroegn公司);牛促甲状腺素(thyroid-stimulating hormone,TSH)、胰岛素(insulin,来源于牛胰腺)、氢化可的松(hydrocortisone,HC)、生长抑素(somatostatin,SST)、牛转铁蛋白(transferrin,TF)(美国SIGMA公司);培养瓶、培养板、EP管、离心管等(美国Costar Corning 公司)。
3.免疫荧光试剂:兔单克隆抗体、小鼠单克隆抗体、小鼠单克隆抗体、兔单克隆抗体(英国Abcam公司);兔多克隆抗体(英国Biorbyt公司);山羊抗兔IgG(RED)、山羊抗小鼠IgG(RED)(美国Invitrogen公司)。
4.RT-PCR主要实验试剂及耗材:总RNA提取试剂(美国Invitroegn公司);第一链cDNA合成试剂盒(美国Thermo公司);荧光定量试剂盒(瑞士Roche公司);引物(美国Invitroegn公司);离心管、TIP头(美国Axygen公司)。
二、方法
(一)BMSCs向甲状腺细胞分化的诱导实验
1.BMSCs的分离、培养:取150 g左右雄性SD大鼠,按全骨髓贴壁法分离、纯化获取原代BMSCs,扩增至第3代,备用。
2.实验分组:实验分为5组:阴性对照组(B组):P3代SD大鼠BMSCs悬液以1×105个/ ml的细胞密度接种于6孔板,每孔加入3 ml含10%FBS的D/F-12培养基。阳性对照组(T组):FRTL-5细胞悬液以1×105个/ml的细胞密度接种于6孔板,每孔加入3 ml 含5%FBS的FRTL-5培养基。共培养组(C组):将P3代SD大鼠BMSCs悬液以1×105个/ml 的细胞密度接种于6孔板,嵌入Transwells小室。调节FRTL-5细胞密度为1×105个/ml,将 FRTL-5加入Transwells小 室 PET膜上。用含10%FBS的DF-12培养基将Transwells小室内外液体均补足为1.5 ml。诱导素组(F组):P3代SD大鼠BMSCs悬液以1×105个/ ml 的细胞密度接种于6孔板,每孔加入3 ml 含10%FBS的诱导分化培养基。隔天全量换液,诱导7 d。共培养+诱导素组(C+F组):将P3代SD大鼠BMSCs用诱导分化培养基重悬,悬液以1×105个/ml的细胞密度接种于6孔板,嵌入Transwells小室。调节FRTL-5细胞密度为1×105个/ ml,将 FRTL-5加入Transwells小室PET膜上。用诱导分化培养基将Transwells小室内外液体均补足为1.5 ml。
(二)诱导分化细胞的分析及鉴定
1.形态学观察:以FRTL-5作为形态学阳性对照组,倒置相差显微镜下逐日观察C+F组、C组和F组中诱导细胞的形态学变化。
2.细胞 TTF1、PAX8、NIS、Tg、TPO 表达蛋白的免疫荧光染色:细胞免疫荧光染色法检测经不同条件诱导后的细胞中蛋白标志物TTF1、PAX8、NIS、Tg、TPO的表达。主要步骤包括:BMSCs经共培养+诱导素、共培养及诱导素三种不同条件下诱导1周后,消化离心收集细胞,重悬,接种于铺有玻片的24孔板,培养1 d。巴氏吸管吸除24孔板中培养液,PBS充分洗涤后,以4%多聚甲醛室温固定细胞15 min,PBS洗3遍,取出玻片置于封口膜上,有细胞的一面向上。滴加0.3%TritonX-100,室温下15 min透膜;用10%山羊血清室温封闭30 min。PBS充分洗涤,按照说明书,加入按1 : 100或1 : 50比例稀释的一抗,4℃湿盒内过夜。16 h后PBS洗去一抗,加入1 : 100稀释的罗丹明标记的荧光二抗,避光保存4 h,PBS充分洗涤,以0.5%DAPI处理15 min标记细胞核,PBS充分洗涤后甘油封片,倒置荧光显微镜下观察细胞荧光显示情况。
3.RT-PCR基因转录分析法检测不同培养条件下基因 TTF1、PAX8、NIS、Tg、TPO 的表达:具体步骤:(1)mRNA的提取;(2)总RNA浓度的测定;(3)RNA逆转录成cDNA;(4)RT-PCR检测基因表达情况(反应引物序列见表1)。按照Sybr Green试剂盒进行操作。

表1 特异性引物核苷酸序列
三、统计学分析方法
应用SPSS 21.0软件进行统计分析,不同培养条件下基因 TTF1、PAX8、NIS、Tg、TPO RT-PCR 数据由表示,多组间均数比较使用单因素方差分析(ANOVA),两组间资料差异比较采用独立t检验。以P< 0.05为差异有统计学意义。
结 果
一、细胞形态学观察
1周后倒置显微镜下观察各实验组细胞生长情况,发现各实验组细胞形态较B组略有改变,细胞表面凸起略少。另外C+F组部分底层细胞趋向于培养孔边缘生长,且形态变化显著(图1)。
二、甲状腺滤泡细胞特异表达抗原及相关基因表达的免疫荧光分析
1.TTF1:C+F组显示为胞核、胞浆均有表达,以胞核表达更为明显。C组显示为胞核、胞浆均有表达,但较C+F组弱,以胞核为著。F组显示为仅有胞核表达(图2)。
2.PAX8:C+F组显示为核周及胞浆内均有表达,以核周为著。C组显示为阴性。F组显示为胞浆内有表达。(图3)
3.NIS:C+F组显示为胞浆内表达,C组显示为胞浆内表达,F组显示为胞浆内表达,背景有异染(图4)。
4.TPO:C+F组显示为胞浆表达。C组显示为胞核及胞浆表达。F组显示为胞核及胞浆表达。(图5)。
5.Tg:C+F组Tg显示为胞浆表达。C组Tg显示为阴性。F组Tg显示为胞核表达(图6)。
三、RT-PCR基因转录分析法测定基因TTF1、PAX8、NIS、Tg、TPO 的表达
将BMSCs经共培+诱导素、共培及诱导素三种不同条件下诱导1周后,实时荧光定量PCR检测各组中转录因子TTF1、PAX8及标志性蛋白NIS、Tg和TPO mRNA表达。结果显示,与C+F组比较,B组、C组、F组PAX8(F= 283.07,P< 0.05)、TTF1(F= 73.36,P< 0.05)、TG(F= 134.03,P<0.05)mRNA水平下降(表2)。
讨 论

图1 倒置相差显微镜下观察培养1周时细胞形态

图2 荧光显微镜下观察培养1周后各组细胞TTF1表达情况(免疫细胞荧光染色法)
甲状腺转录因子是一类仅在甲状腺滤泡细胞中共同表达的蛋白质,与甲状腺器官胚胎发育及分化成熟密切相关,甲状腺祖细胞的存活及增长依赖于 TTF1、TTF2、PAX8和HEX的共同调节,因而TTF1、TTF2、PAX8和HEX的联合表达被视为甲状腺细胞所特有[12]。其中转录因子TTF1和PAX8在甲状腺发生中至关重要[13]。2012年Antonica等[5]研究表明PAX8和TTF1在小鼠胚胎干细胞中的瞬时表达能够驱动其向甲状腺上皮细胞谱系的分化,TTF1的超表达能够诱导TTF2的表达,即TTFs之间存在相互作用的等级层次网络,且PAX8及TTF1位于调控网络的上游[7,14-15]。相较于基因过表达的技术手段,本实验通过不同诱导条件对BMSCs进行刺激,培养1周后经细胞免疫组化检测到TTF1及PAX8的不同表达情况,以共培体系中添加诱导物质的条件下TTF1和PAX8的表达最为显著。
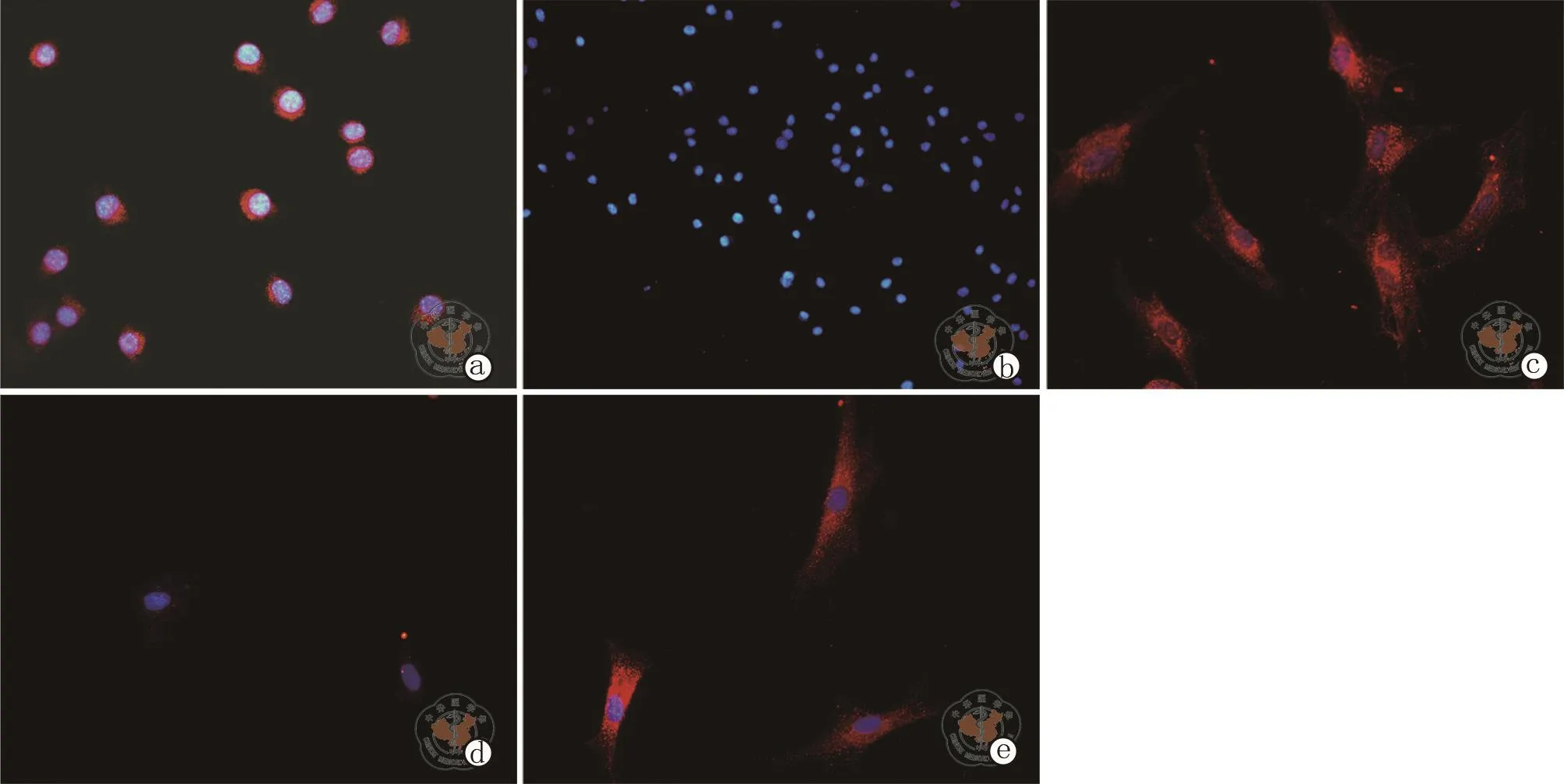
图3 免疫细胞荧光法检测培养1周后各组细胞PAX8表达情况
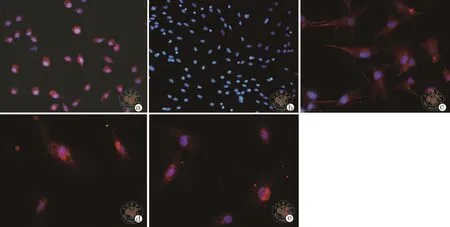
图4 免疫细胞荧光法检测培养1周后各组细胞标志性蛋白NIS表达情况
甲状腺激素的生物合成有赖于甲状腺滤泡细胞特有的标志性蛋白分子TSHR、NIS、Tg、TPO等蛋白质的正常表达[16-17]。Tg、TPO、TSHR和NIS基因的联合表达为甲状腺滤泡细胞特有[18-20]。甲状腺转录因子对TSHR、NIS、Tg、TPO的基因转录水平的调节在甲状腺生发及功能的形成及维持中是必不可少的。TTF1调节Tg、TPO、TSHR及NIS的基因转录;TTF2调控Tg和TPO的基因启动子;PAX8调节Tg、TPO和NIS的基因表达。本实验中,用细胞免疫荧光法在PAX8和TTF1表达显著的共培+诱导素组中检测到NIS、TPO和Tg的显著表达;而仅有TTF1表达的共培组未检测到Tg的表达;TTF1弱表达和PAX8表达的诱导因素组Tg弱表达。转录因子PAX8和TTF1不同的表达情况,可能是致使各实验组Tg、TPO及NIS表达不同的关键因素。
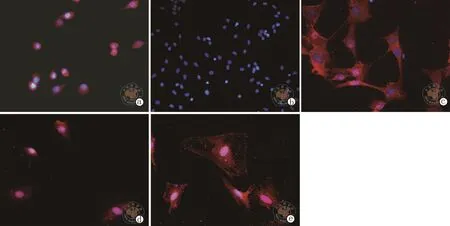
图5 免疫细胞荧光法检测培养1周后各组细胞标志性蛋白TPO表达情况

图6 免疫细胞荧光法检测培养1周后各组细胞标志性蛋白Tg表达情况
RT-PCR测定与对照组比较,TPO mRNA水平在共培组中有增高趋势;NIS mRNA水平在3组中均有增高趋势;PAX8 mRNA水平在共培+诱导素组、诱导素组中有不同程度增高趋势;TTF1 mRNA水平在共培+诱导素组、共培组中有不同程度增高趋势;Tg mRNA水平在共培+诱导素组中有明显增高趋势。整体而言,认为共培+诱导素组各甲状腺相关标识蛋白基因的变化趋势最为理想。
表2 RT-PCR检测TTF1、PAX8、NIS、Tg、TPO在各组细胞中的表达(n = 3,±s)

表2 RT-PCR检测TTF1、PAX8、NIS、Tg、TPO在各组细胞中的表达(n = 3,±s)
注:与 B 组比较,aP < 0.05;与 C+F 组比较,bP < 0.05;与 C组比较,cP < 0.05
分组 TPO NIS PAX8 TTF1 TG B 组 0.07±0.03 0.05±0.01 0.02±0.01 0.03±0.01 0.10±0.05 C+F 组 0.23±0.07 0.55±0.07a 6.21±0.04a 0.33±0.04a 15.00±2.00a C 组 0.40±0.15a 0.60±0.09a 0.54±0.31b 0.15±0.03ab 1.61±0.40b F 组 0.04±0.02c 0.70±0.07ab 3.31±0.30abc 0.08±0.02b 1.91±0.39b F值 12.33 59.12 283.07 73.36 134.03 P 值 < 0.01 < 0.01 < 0.01 < 0.01 < 0.01

