小鼠骨骼肌挫伤愈合过程中神经肌肉接头降解及再生与损伤时间的关系
孙英富 ,张孟周 ,王帅 ,董雯雯 ,陈京伟 ,郭相伸 ,温书恒 ,赵锐 ,官大威
(1.中国医科大学法医学院 法医司法鉴定中心,辽宁 沈阳 110122;2.智慧检务创新研究院 智慧司法鉴定联合实验室,辽宁 沈阳 110122)
损伤时间推断一直是法医学实践中的重点和难点之一。骨骼肌在人体分布广泛,骨骼肌损伤在法医学实践中十分常见,因此,研究骨骼肌挫伤对损伤时间推断具有重要意义。近年来,骨骼肌损伤时间推断的研究主要集中于骨骼肌损伤后炎症反应和纤维修复过程中相关生物学指标的变化。柳丹凤等[1]通过研究证明,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1)阳性细胞率的变化可用于早期损伤时间的推断。张小红等[2-3]证实,卷曲受体4和核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)蛋白在骨骼肌损伤愈合过程中呈时序性变化。本课题组前期研究[4-7]证实,多形核白细胞(polymorphonuclear leukocyte,PMN)、单个核细胞(mononuclear cell,MNC)和成纤维细胞(fibroblastic cell,FBC)改变,以及中性粒细胞和巨噬细胞比值的变化与骨骼肌损伤时间具有相关性。此外,卫星细胞中α7亚型烟碱型乙酰胆碱能受体(α7 nicotinic acetylcholine receptor,α7nAChR)、配对盒转录因子7(paired-box transcription factor 7,Pax7)和生肌决定因子(myoblast determination,MyoD)等蛋白在骨骼肌损伤愈合过程中呈时序性表达[8-9]。
骨骼肌挫伤后,继发出血、水肿、坏死等一系列炎症反应,亦可造成与骨骼肌相连接的神经损伤,而支配骨骼肌的终末神经再生可促进骨骼肌损伤的愈合[10],在骨骼肌损伤修复过程中具有重要意义。神经丝(neurofilament,NF)是神经细胞的骨架蛋白,同时参与轴突转运,在有髓鞘的轴突中含量较多、长度较长、直行、无分支、呈束状分布,是构成运动单位的主要成分之一[11]。突触囊泡蛋白(synaptophysin,Syn)是突触囊泡膜上的特异性蛋白质,是突触的特异标记物之一。乙酰胆碱受体(acetylcholine receptor,AChR)主要存在于突触后膜,并常被用于标记突触后膜。高分子量神经丝蛋白(neurofilament protein-H,NF-H)及Syn是运动神经元支配目标骨骼肌必不可少的蛋白成分。运动神经元的轴突抵达所支配的骨骼肌时失去髓鞘,其轴突反复分支,每一分支形成葡萄状膨大,与一条骨骼肌纤维接触,形成化学突触连接,连接处呈椭圆形板状膨大,即为神经肌肉接头(neuromuscular junction,NMJ),亦称运动终板。有研究[12]指出,NMJ的缺失会导致骨骼肌萎缩,不能行使其正常的生理功能。只有NMJ完全再生,骨骼肌的功能才能恢复[13]。因此,本研究通过对NF-H、Syn和AChR进行免疫荧光染色,观察小鼠骨骼肌挫伤后不同时间点NMJ的形态学变化与损伤时间的相关性,探讨其作为推断骨骼肌损伤时间指标的可行性。
1 材料与方法
1.1 主要试剂与仪器
羊抗兔NF-H多克隆抗体、羊抗兔Syn多克隆抗体(武汉三鹰生物技术有限公司),驴抗兔IgG 488荧光二抗(1∶200,美国Invitrogen公司),荧光594标记α-银环蛇毒抗体(1∶200,美国Life Technologies公司),含DAPI抗荧光淬灭封片剂(ZLI9557,北京中杉金桥生物技术有限公司)。
VT1000 S振动切片机、DMi8激光扫描共聚焦显微镜(德国Leica公司),DP22显微成像系统(日本Olympus公司)。
1.2 方法
1.2.1 骨骼肌挫伤模型及动物分组
健康雄性C57BL/6小鼠50只,12周龄,体质量22~25g,购自北京华阜康生物科技股份有限公司。实验过程中对动物的处置方法经中国医科大学实验动物福利与伦理委员会审查通过。
将小鼠分为10组,9组为实验组,1组为对照组,每组5只。参照大鼠骨骼肌急性钝挫伤模型[14],自制自由落体式钝力打击器。2%戊巴比妥钠溶液腹腔注射(30 mg/kg)麻醉小鼠,将其后肢置于伸膝、踝背曲90°位置,应用钝力打击器以3m/s的速度和压深调控杆超出封闭螺扣2mm的长度(即形变量)一次性打击小鼠左后肢距跟骨1 cm处,致骨骼肌挫伤。挫伤后予每只小鼠以消毒饲料及蒸馏水分笼饲养。对照组仅施行麻醉,不进行打击。
1.2.2 取材及制片
分别于伤后3 h、6 h、12 h、1 d、3 d、5 d、7 d、14 d、21 d麻醉小鼠,并用生理盐水灌流后取挫伤处腓肠肌,对照组小鼠取相同部位肌肉组织并等分为两部分。其中一半检材放入由磷酸盐缓冲液(phosphatebuffered saline,PBS)配制的4%多聚甲醛溶液中固定24h后用于制作石蜡切片,应用振动切片机将另一半检材制作成100μm厚度的连续切片。
1.2.3 苏木素-伊红染色
取常规石蜡切片经二甲苯脱蜡后,梯度乙醇水化,用苏木素-伊红(hematoxylin-eosin,HE)染色后梯度乙醇脱水,二甲苯透明后用中性树胶封片,在显微成像系统中进行观察。
1.2.4 免疫荧光染色
切片用PBS冲洗3次,每次15min,再用10%驴血清封闭1h,以NF-H标记神经丝,Syn标记突触前膜,AChR标记突触后膜,并以其作为一抗,4℃过夜。第2天,用PBS冲洗3次,每次5 min,然后加入驴抗兔IgG 488荧光二抗(绿色荧光)和荧光594标记α-银环蛇毒抗体(红色荧光)室温孵育2 h,封片剂封片后在共聚焦显微镜下观察。
1.3 数据分析
HE染色:显微镜下(×200)在每张切片的挫伤区及挫伤交界区(距挫伤区200 μm范围内)随机选取10个视野,观察骨骼肌愈合过程中的形态学变化。
免疫荧光染色:由于挫伤区损伤程度较重,NMJ结构被破坏显著,不易观察其再生进程,且再生进程明显滞后,而挫伤交界区骨骼肌细胞及NMJ结构相对完整,且神经再生最为活跃,因此本研究选择挫伤交界区进行NMJ观察和检测。按上述方法选择10个视野,计数NMJ数量及其结构的完整性情况。突触前膜与突触后膜成分完全重合时认为是正常的NMJ结构[15],通过计数Syn染色阳性的突触前膜个数与AChR染色阳性的突触后膜个数,以两者的比值作为评价NMJ完整性程度的指标,取值范围为0~100%,对照组中突触前膜和突触后膜的比值为100%。采用SPSS 13.0软件,应用方差分析对上述比值进行统计学处理,组间比较采用t检验,数据以±s表示,检验水准α=0.05。
2 结 果
2.1 HE染色
小鼠骨骼肌挫伤后不同时间点挫伤区的组织病理学改变见图1。伤后3h,骨骼肌局部水肿、变性,部分肌纤维断裂,肌间隙增宽,间质内可见出血;伤后6 h,肌细胞形态不清,可见多核粒细胞,偶见单核细胞;伤后12h,骨骼肌胞质进一步均质化,嗜伊红染色增强,细胞核消失,间质内炎症细胞增多,以多核粒细胞和单核细胞为主;伤后1d,骨骼肌纤维大部分胞质均质化、间质内可见大量炎症细胞浸润,以单核细胞为主,并见少量多核粒细胞;伤后3 d,间质内浸润的炎症细胞以单核细胞为主,并可见梭形成纤维细胞增生;伤后5~7 d,单核细胞数量减少,大量成纤维细胞增生,并可见胶原纤维和新生骨骼肌细胞形成;伤后14 d,挫伤区大量胶原纤维形成,坏死的骨骼肌被新生骨骼肌及胶原纤维取代;伤后21 d,肌细胞核边聚,大部分骨骼肌再生完成,挫伤区仍可见少量胶原纤维。
挫伤交界区:伤后各时间点可见不同程度的骨骼肌均质变,胞质嗜伊红染色增强,肌间隙增宽,间质内血管淤血。

图1 小鼠骨骼肌挫伤后不同时间点挫伤区的组织病理学改变(HE×200)
2.2 免疫荧光染色
正常NMJ在免疫荧光染色下呈“爪”样结构,NF-H阳性染色的神经丝末端与Syn阳性染色的突触前膜相连接,突触前膜与AChR阳性染色的突触后膜完全重合(图2A)。骨骼肌挫伤后不同时间点NMJ的荧光染色结果见图2B~J。伤后3~6h,大部分NMJ仍呈现正常结构,少数突触前膜出现崩解或部分缺失,不能与突触后膜完全重合,偶见神经丝节段性断裂;伤后12 h,突触前膜继续崩解,部分NMJ中突触前膜完全消失,可见神经丝呈节段性断裂;伤后1 d,突触前膜少量残存,呈不规则、不连续的碎片状,突触后膜较为清晰;伤后3 d,只能观察到突触后膜,几乎看不到突触前膜,无正常NMJ结构,个别突触后膜结构不规则;伤后5d,NF-H染色阳性的神经丝再次出现,数量较少,分布较分散,未见Syn染色阳性的突触素;伤后7 d,神经丝数量较多,可见分支,同时部分神经丝末端可见突触前膜再生,并与突触后膜部分重合;伤后14 d,大部分NMJ突触前膜与后膜相重合,呈正常机构,残存少量无突触前膜的NMJ;伤后21d,NMJ中突触前膜与后膜完全重合,形态与对照组大致相同,仍可见少量神经丝分支存在。
骨骼肌挫伤后,NMJ中突触前膜与后膜数量的比值开始下降,伤后3h约为80%,伤后6h约为70%,伤后12 h为50%左右,继续下降,伤后1 d降至10%左右,伤后3 d最低,在5%左右,之后该比值开始上升,伤后5d在10%左右,伤后7d可达到25%,至伤后14 d再次达到50%左右,伤后21 d可达到90%,详见表1。

图2 小鼠骨骼肌挫伤后不同时间点NMJ的荧光染色结果(×200)
表1 小鼠骨骼肌挫伤后不同时间点NMJ中突触前膜与后膜数量比值(n=5, ±s,%)
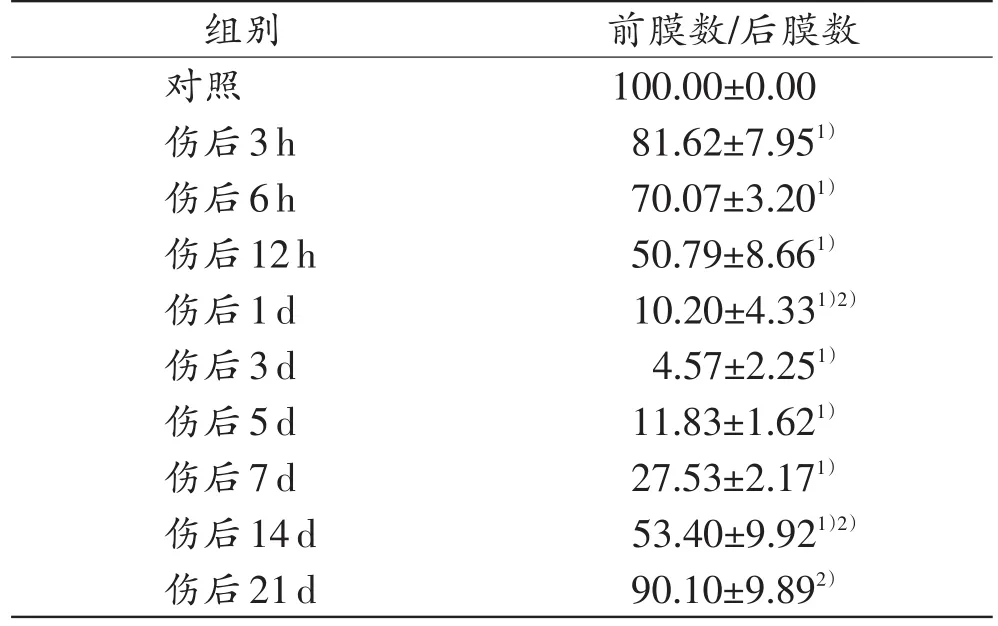
表1 小鼠骨骼肌挫伤后不同时间点NMJ中突触前膜与后膜数量比值(n=5, ±s,%)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05
组别对照伤后3h伤后6h伤后12h伤后1d伤后3d伤后5d伤后7d伤后14d伤后21d前膜数/后膜数100.00±0.00 81.62±7.951)70.07±3.201)50.79±8.661)10.20±4.331)2)4.57±2.251)11.83±1.621)27.53±2.171)53.40±9.921)2)90.10±9.892)
3 讨 论
骨骼肌挫伤致终末神经损伤后,神经轴突膜破裂,Na+和Ca2+内流导致轴突膜去极化,促进破裂处再封闭。神经细胞开始分泌细胞因子促进再生,同时损伤处及其远端由于缺乏神经元胞体营养的供应而发生沃勒变性。在此过程中,轴索中断,髓鞘降解,导致神经丝和微管的崩解,同时诱导施万细胞增殖及蛋白合成增加[16]。此外,施万细胞释放的细胞因子诱导损伤处原有的及血源性的单核细胞增殖分化,将损伤的神经、髓鞘残骸吞噬清除,形成一个适合神经生长的微环境,施万细胞增生形成细胞带(即Büngner带),引导近端轴芽沿Büngner带向损伤远端生长。再生过程大致分为两个阶段:(1)新生轴突按照原有的神经管通道生长;(2)形成NMJ再支配目标骨骼肌。轴突再生时会发出多个分支同时向损伤远端延伸,接触到骨骼肌靶点后产生接触抑制,诱导多余的分支降解,最终完成神经的再生愈合[17]。神经愈合与骨骼肌愈合同步进行,若神经愈合滞后,将导致骨骼肌萎缩及生理功能的丧失[18]。
近年来国内外涌现出大量对NMJ再生机制的研究,不同损伤模型中的再生过程如下:在骨骼肌神经毒素损伤模型中,注射蛛毒素或银环蛇毒素的肌肉中,NMJ于1d内降解完成,神经丝消失,伤后8d再生完成[19],神经毒素的反应过程较快;在坐骨神经挫压伤模型中,胫前肌中NMJ的突触前膜于伤后1周完全降解,2周可见新生突触前膜长入,6周再生完成[20];而缺血再灌注损伤模型中,不仅突触前膜崩解消失(伤后1d突触前膜降解消失,伤后7d可见神经丝再生,伤后28d再生完成),部分突触后膜也受到损伤而破碎[21]。本研究发现,小鼠骨骼肌挫伤后1 d时突触前膜成分大部分崩解,神经丝连续性被破坏,突触前膜呈碎片状并有部分缺失,伤后3d时挫伤交界区NMJ的突触前膜成分几乎全部降解,伤后7d可见突触前膜再生,伤后21 d NMJ再生基本完成。通过对NMJ突触前膜与后膜数量的比值及再生形态学所见与损伤时间的相关性分析显示:突触前膜与后膜数量的比值大于20%,且可见突触前膜崩解时,可以判定损伤时间为1d以内;当比值小于20%或比值接近0,且未检见神经丝和突触前膜结构时,可判定为伤后1~5d,或伤后3 d左右;比值大于20%,并可见神经丝再生时,可判定为伤后7d左右;比值大于50%,并可见突触前膜再生时,可判定为伤后14d左右;当比值接近100%,且可见完整NMJ及正常肌纤维结构,并伴有灶状纤维化,可推断损伤时间为21d左右。本研究结果表明,骨骼肌挫伤后,通过NMJ再生并结合骨骼肌的形态学所见更有利于损伤时间推断。
虽然本研究证明NMJ再生过程中的形态学所见有望作为推断骨骼肌损伤时间的生物学指标之一,但仍存在不足之处:一方面,本研究采用小鼠骨骼肌挫伤模型进行观察,缺乏人体检材的验证;另一方面,法医学实践中不同个体或同一个体肌肉挫伤的程度、范围等并不均一,且受体内外多种因素的共同影响。因此,在实际应用中要注重结合其他生物学指标进行全面评价与分析,综合推断损伤时间。

