基于巨噬细胞吞噬模型的阿胶品质生物评价方法构建△
刘靖,郝俊杰,刘士敬*,肖小河,牛明*
1.承德医学院,河北 承德 067000;2.中国人民解放军总医院 第五医学中心 全军中医药研究所,北京 100039
阿胶是临床常用的名贵中药[1],被誉为滋补圣品。近年来,随着阿胶产业的不断扩大,阿胶产品的质量问题也日益凸显[2]。究其原因,主要是由于阿胶成分复杂、物质基础不清[3],而现行的质量评价方法则倾向于对阿胶真伪的鉴别[4-6],质量标准与其临床功效脱节,难以反映其内在品质。因此,建立关联阿胶临床功效的质量评价方法,对于阿胶产品的质量控制具有重要意义。
现代药理研究表明,阿胶作为滋补药具有较强的免疫调节作用[7],可有效促进免疫细胞增殖,改善放化疗所引起的免疫低下状态,因此调节免疫活性可作为阿胶质量生物评价方法研究的切入点。本课题组前期针对铜皮石斛[8]、铁棍山药[9]等补益类中药,结合高内涵分析的高通量检测技术优势,构建了以体外巨噬细胞吞噬作用为基础的中药免疫调节活性评价方法,并应用于相关中药品种的质量评控。
本文在前期研究基础上,以小鼠单核巨噬细胞系(RAW264.7)吞噬大肠杆菌为评价模型,通过考察、优化相关检测条件和指标,建立了基于调节免疫活性的阿胶质量生物评价方法,该方法稳定性、重现性良好,或可为提升阿胶的质量评控能力提供参考。
1 材料
1.1 仪器
高内涵筛选分析仪(Thermo Scientific 公司,美国);CO2培养箱(三洋公司,日本);常规倒置显微镜(上海泽权仪器设备有限公司);电子天平XS-205(Mettler Toldeo公司,美国);TC10TM自动细胞计数器(Bio-Rad公司,美国);SynergH1全功能微孔板检测仪(酶标仪,BioTek公司,美国);台式低速离心机(湖南赫西仪器装备有限公司)。
1.2 试剂
小鼠(Musmusculus)巨噬细胞系RAW264.7(解放军总医院第五医学中心全军中医药研究所);绿色荧光标记大肠杆菌(GFP-E.coli,解放军军事医学科学院);高糖培养基(DMEM)、磷酸缓冲盐溶液(1×PBS)、胎牛血清(FBS)均购于HyClone公司;4%多聚甲醛、诱导剂isopropylβ-D-1-thiogalactopyranoside(IPTG)均购于Solarbio公司;胰蛋白酶、双抗试剂(100 g·L-1链霉素和100 μg·mL-1青霉素)均购于Gibco公司;lipopolysaccharide(LPS)、Hoechst染料均购于Sigma公司;LB肉汤培养基(北京奥博星生物技术公司);CCK-8检测试剂(北京鼎国昌盛生物技术有限公司);96孔板(Costar 3603、3599,Corning公司,美国);阿胶饮片(山东东阿阿胶有限公司,批号:1612031)。
2 方法
2.1 阿胶受试品制备
取阿胶样品粉碎并过65目筛,得到阿胶粉末。精密称取,用含10%胎牛血清、1%双抗的DMEM培养基制备成质量浓度为4.0 mg·mL-1的溶液,过0.22 μm无菌滤膜后,等比稀释至所需浓度。
2.2 RAW264.7细胞的培养
待细胞复苏后,用含10%胎牛血清、1%双抗的DMEM培养基在条件为含5% CO2、恒温37 ℃的细胞培养箱中孵育细胞。
2.3 细菌(GFP-E.coli)制备
将菌液以1%比例接种到15 mL LB肉汤培养基中,在37 ℃、220 r·min-1条件下摇菌过夜,再以1%比例接种到新的培养基,摇菌3.5 h后加入IPTG进行诱导,在16 ℃、160 r·min-1条件下摇菌过夜,得到GFP-E.coli。
2.4 细胞浓度与孵育时间考察
将处于对数生长期的细胞调整细胞数为5×104、8×104、1×105个/mL,分别种于9个96孔板,每一浓度3个复孔,设置检测时间为4、6、12、18、24、30、36、42、48 h时加入相应的CCK-8试剂,在含5%CO2的培养箱中37 ℃孵育30 min,最终放入波长设置为450 nm的酶标仪中检测吸光度(A)值。
2.5 阿胶样品影响细胞活力的检测
实验共分成8个组,分别为0.125、0.25、0.5、1.0、2.0、4.0 mg·mL-1组,Control组(不给药)和空白组(不接种细胞、不给药),每组设置3个复孔。取对数生长期的巨噬细胞,调整细胞数,接种于96孔板中。接种12 h后,弃去上清液,加入不同浓度的阿胶受试品继续培养24 h后,加入CCK-8试剂进行检测。酶标仪读取A值,按公式(1)计算细胞存活率。

(1)
2.6 吞噬实验方法
根据参考文献[10-12],对RAW264.7细胞吞噬GFP-E.coli的实验方法进行优化,在染色过程中用Hoechst核酸染料代替前期实验[8-9]中使用的DAPI染料,以减少操作流程和缩短实验时间,尽可能避免因实验操作引起的误差。最终明确实验方法如下:细胞培养完成后,加入固定量的GFP-E.coli和Hoechst核酸染料,放入含5% CO2、恒温37 ℃的培养箱中孵育2 h;终止孵育后,用1×PBS清洗;再用4%多聚甲醛室温固定10 min;最后用1×PBS清洗,使用高内涵筛选仪器采集荧光图像并分析。
2.7 数据收集与分析
2.7.1 高内涵检测 采用高内涵仪器进行扫描分析,20倍物镜,16个视野,设定Channel1检测波长为386 nm,检测被Hoechst核酸染料染为蓝色的细胞核;Channel2检测波长为485 nm,检测转染后的GFP-E.coli。使用仪器自带分析软件获取数据,按公式(2)计算所有细胞的整体吞噬率,按公式(3)计算单个细胞吞噬指数。其中,吞噬指数和吞噬率均与RAW264.7细胞的吞噬能力呈正相关关系。

(2)
(3)
2.7.2 统计学分析 使用SPSS22.0软件对数据进行单因素方差分析,计算其组间的统计学差异,P<0.05表示差异有统计学意义。
3 结果与分析
3.1 巨噬细胞吞噬模型构建
3.1.1 细胞密度考察与孵育时间考察 巨噬细胞RAW264.7的生长状态与细胞密度关系密切,只有达到一定密度后才会稳定生长。因此,本研究采用CCK-8试剂对不同密度时的细胞活性进行考察,结果见图1。结合显微观察,细胞密度在1×105个/mL时接种于96孔板内的生长状态最好。在此条件下,细胞在种板后4 h开始贴壁生长,贴壁细胞数目较多、形态稳定、生长迅速且不易死亡,在24 h时生长至50%左右,42 h后细胞密度处于饱和状态,分裂减缓;在密度为8×104个/mL时,细胞持续生长,细胞形态改变数目较1×105个/mL时略多;在密度为5×104个/mL时,死亡细胞较多,细胞形态也易发生改变。综合考虑实验稳定性和实验时间的因素,选择接种密度为1×105个/mL,吞噬实验需在接种后24~40 h内完成。

图1 细胞密度考察与生长曲线的测定
3.1.2 MOI值考察 以1×105个/mL的密度将细胞接种于96孔板,共设4组,每组设3个复孔,接种12 h后进行换液,再孵育24 h后加入MOI值为25、50、100、200倍的GFP-E.coli和Hoechst核酸染料,并根据前期研究,确定加菌后的孵育时间为2 h。孵育完成后,对细胞进行处理,再使用高内涵筛选仪器采集数据,经软件分析得到单个细胞吞噬指数和整体吞噬率。结果如图2所示,吞噬率随MOI值的增大而升高,在MOI为200倍时吞噬率达到40%左右,各组间差异具有统计学意义;单个细胞吞噬指数随MOI值的增大而降低,但各组间差异无统计学意义。在MOI值为25倍时,吞噬指数平均值最高,为36.14,但是误差最大(RSD≈22.54%),在50~200倍间趋于稳定(50、100、200倍时单个细胞吞噬指数平均值分别为31.38、28.85、28.46),200倍时误差最小(RSD≈5.8%)。因此,本实验选定单个细胞吞噬指数稳定、细胞吞噬比例接近半数的MOI值(200)作为固定条件之一,进行后续实验。

注:A.不同倍数MOI条件下的细胞吞噬率;B.不同倍数MOI条件下的单个细胞吞噬指数;*P<0.05,**P<0.01。图2 不同倍数MOI条件下巨噬细胞的吞噬能力分析
3.2 高内涵筛选技术检测阿胶对巨噬细胞吞噬功能的影响
3.2.1 样品对细胞活力检测 以1×105个/mL的密度将细胞接种12 h后,弃去上清液,加入上述制备的阿胶受试品,继续培养24 h后进行活力检测。根据不同浓度阿胶对巨噬细胞存活率的影响,绘制给药后巨噬细胞活力图。如图3所示,质量浓度在0.125~2.0 mg·mL-1的阿胶对细胞活力影响均为无毒性作用。在0.125、0.25、0.5、1.0 mg·mL-1时,阿胶溶液具有明显促进巨噬细胞增殖作用,并在0.25、0.5 mg·mL-1时差异具有统计学意义,细胞存活率平均值分别为110.22%、114.73.%、122.88%、108.77%;在2.0 mg·mL-1时,阿胶对巨噬细胞增殖无明显作用,与Control组几乎持平;在4.0 mg·mL-1时,与Control组相比,阿胶对巨噬细胞呈抑制作用。实验中各样品的重复性良好,RSD均<15%,符合生物评价的要求。因此选定进行阿胶吞噬实验的剂量为对巨噬细胞(RAW264.7)的无毒剂量,即0.125~2.0 mg·mL-1。
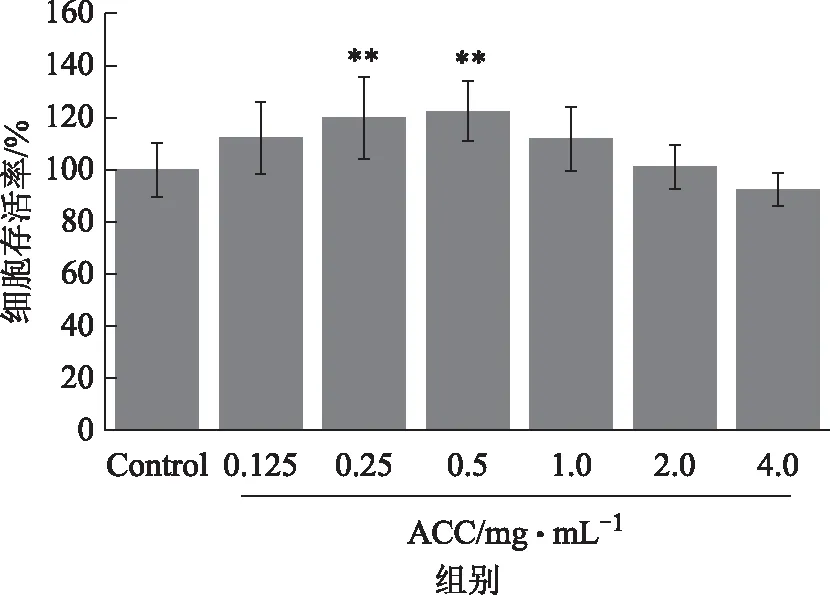
注:与Control组对比,**P<0.01。图3 给药阿胶后细胞存活率测定
3.2.2 阿胶对巨噬细胞吞噬功能的影响 实验共分成7组,分别为0.125、0.25、0.5、1.0、2.0 mg·mL-1组,阳性药LPS(250 ng·mL-1)组和Control组(不给药),每组设置3个复孔。细胞完成给药培养后加入配置好的细菌(MOI=200)和Hoechst核酸染料,孵育时间2 h后,进行清洗和固定。使用高内涵筛选仪器采集荧光图像,扫描结果见图4。
从图4的巨噬细胞吞噬表型中可见,给药阿胶后,吞噬GFP-E.coli的巨噬细胞数量发生明显变化,随着阿胶质量浓度的增加,吞噬GFP-E.coli的细胞占比与阿胶质量浓度有明显的剂量依赖性。通过图5数据分析,由图5A中各组吞噬百分率的变化可见,随着阿胶质量浓度的变化,细胞吞噬百分率增大,说明阿胶对巨噬细胞吞噬功能具有剂量依赖的促进作用,并且与Control组相比,在0.125、0.25、0.5、1.0 mg·mL-1时,阿胶具有明显促进巨噬细胞吞噬的作用,差异具有统计学意义;在2.0 mg·mL-1时,与Control组相比,阿胶对巨噬细胞吞噬能力呈现出略微抑制的作用;由图5B中各组单个细胞吞噬指数的变化可见,阿胶可能降低了单个细胞吞噬GFP-E.coli的能力,在0.125 mg·mL-1时最为显著,差异具有统计学意义,但是随着剂量的升高,单个细胞吞噬指数呈现回升的趋势。

注:蓝色荧光为巨噬细胞;绿色荧光表示GFP-E.coli。图4 阿胶不同给药浓度下巨噬细胞吞噬作用的表型图

注:A.细胞吞噬率;B.单个细胞吞噬指数;与Control组对比,*P<0.05,**P<0.01。图5 阿胶不同给药浓度下巨噬细胞的吞噬能力分析
4 讨论
阿胶作为临床常用的名贵中药,其关联的临床功效质量评价方法的缺失,是导致长期以来阿胶产品质量问题备受关注的重要原因之一。本研究针对阿胶调节免疫的药理活性,建立了基于巨噬细胞吞噬作用的阿胶质量生物评价方法。研究结果表明,阿胶具有促进巨噬细胞增殖和提高其吞噬能力的双重作用,并在阿胶质量浓度为0.125~1 mg·mL-1时呈现较好的剂量依赖关系,与现有的药理研究结论相一致[13]。并且本研究发现,阿胶两种生物活性的量效曲线略有差异,其质量浓度为0.5 mg·mL-1时对细胞的增殖效果最好,而0.25 mg·mL-1时提高吞噬的作用最强。这一结果提示,阿胶两种生物活性作用的药效物质可能有所差异,因此采用上述方法对阿胶质量进行评价时,应当同时关注增殖作用和吞噬作用两个方面。同时,针对阿胶影响巨噬细胞吞噬能力的分析表明,阿胶的作用主要表现在激活巨噬细胞吞噬活性,提高细胞的吞噬比率,而对于单个细胞吞噬能力的调节作用从整体来看并不明显;因此本研究认为,细胞增殖率和细胞整体吞噬率的变化可作为重要指标,用于阿胶质量的评价。
此外,巨噬细胞作为机体的重要免疫细胞,无论是其细胞数量的增减还是吞噬活力的变化均可能影响机体的免疫功能[14-17]。本文研究结果中,随着MOI值的升高,吞噬率不断升高,而单个细胞吞噬指数趋于平稳,提示单个细胞的吞噬能力在高倍的GFP-E.coli刺激下已达到饱和状态;因此,给药阿胶后的实验结果提示,阿胶的调节免疫作用可表现为促进细胞增殖和激活未活化的巨噬细胞以提高整体吞噬率,但是不能增强巨噬细胞自身的吞噬能力。这可能是阿胶性味平和的一种体现,与阿胶常用于治疗机体免疫力低下、免疫细胞缺乏等相关疾病的临床应用相一致[17-18],但其明确的作用机制有待进一步研究。
综上,本研究成功构建了以巨噬细胞吞噬GFP-E.coli为生物模型、以细胞增殖率和细胞整体吞噬率为评价指标的阿胶质量生物评价方法。该方法以高内涵荧光成像筛选技术为基础,具有高通量、高分辨率和多参数等优势[19-20],可快速、直观地评价药品的生物活性,实验的重现性、稳定性较好,且对样品的需求量小,适用于阿胶等药效物质不清的名贵中药质量评价。

