贵州禾来拢茎尖遗传转化体系的研究
2
(1.贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室,贵州省农业生物工程重点实验室, 贵阳 550025;2.贵州省农业科学院国家农业农村部DUS中心贵阳分中心, 贵阳 550006)
水稻(OryzasativaL.)不仅是重要的粮食作物,也是单子叶植物研究中最重要的模式作物之一。转基因技术现已成为植物分子生物学研究基因功能的重要手段[1]。农杆菌介导法具有遗传稳定性强、拷贝数较低且结合位点稳定等优势,水稻转基因植株绝大部分是利用农杆菌介导法获得的[2]。以愈伤组织作为转化受体需要对水稻苗幼胚或成熟种子在无菌条件下诱导获得胚性愈伤组织后再进行转化,这种方式需要严格的无菌环境,并且愈伤组织诱导及再分化对基因型依赖性较强,因此,不同水稻品种之间转化难易程度差异较大[3,4,5]。以植物茎尖为受体进行遗传转化,无需经过愈伤组织诱导及再分化,具有转化周期短、操作简单、转基因植物遗传稳定等特点, 已在玉米、棉花、水稻等植物中成功应用[6-8]。前期对不同水稻品种的茎尖遗传转化体系转化条件研究发现,不同水稻品种的最适条件各异,且主效因素也不一样[6,9]。
来拢是从江地区特有的贵州香禾粳糯品种,前期品质测定发现其具有优良食味品质[10],可作为水稻品种改良的一种良好材料[11],但其对稻瘟病抗性较低,需对其进行品种改良。本实验室曾经也以贵州禾来拢愈伤组织为受体,利用农杆菌侵染进行遗传转化并已获得抗除草剂、抗稻瘟病的转基因来拢植株,但转化周期过长,且转化效率较低[12,13]。因此,本研究以贵州禾来拢茎尖为材料设计正交试验,研究不同菌液侵染浓度OD600、真空处理时间、真空渗透压等因素对贵州禾来拢转化效率及植株死亡率的影响,建立高效的农杆菌介导贵州禾来拢遗传转化体系,为基因工程改良贵州禾来拢奠定基础。
1 材料与方法
1.1 材 料
植物材料为贵州禾来拢,农杆菌菌株为LBA 4404,均由贵州大学山地植物资源保护与种质创新教育部重点实验室保存并提供。pCambia-Ubi-McCHIT1遗传转化载体由西南大学裴炎教授惠赠。
1.2 方 法
1.2.1遗传转化材料的准备
将贵州禾来拢成熟种子置于10 cm×12 cm网袋中清水浸泡,37 ℃避光培养,每8 h换水1次,待种子露白后,用清水清洗干净。37 ℃避光催芽生根,待水稻胚芽鞘长至1.5~2.0 cm长时,切除茎环上部胚芽,暴露水稻的茎尖分生组织,用于农杆菌的侵染及转化。
1.2.2农杆菌的活化及培养
取出-80 ℃保存的含有pCambia-Ubi-McCHIT1载体的农杆菌LBA 4404,接种到含有50 mg·L-1卡那霉素及20 mg·L-1利福平的YEP固体培养基上,28 ℃培养箱中暗培2 d。挑取单菌落于10 mLYEP液体培养基(卡那霉素及利福平浓度分别为50 mg·L-1、20 mg·L-1)中 180 r·min-1,28 ℃振荡过夜培养。再取100μL菌液继续放入新的YEP液体培养基中震荡过夜,待菌液浓度OD600值达到0.8左右后,5 000 r·min-1离心收集菌体。
1.2.3遗传转化体系的建立
选择农杆菌菌液侵染浓度OD600(0.4、0.6、0.8、1.0、1.2)、真空处理时间(2、5、8、11、14 min)及真空渗透压(4、8、12、16、20 kPa)进行三因素五水平的正交试验设计,设计为L25(53)正交表(详见表1)。每个处理样本为30粒,并做3次重复。AAM培养基[14]重悬农杆菌菌体并稀释至相应浓度后,加入0.02%表面活性剂Silwet-L 77与100μmol·L-1乙酰丁香酮。将切除胚芽鞘的来拢种子浸泡在重悬后菌液中,使用Bio-Rad台式基因枪对其进行真空处理,调节真空处理时间与真空处理压强。处理完毕后,倒掉菌液,用吸水纸吸干后将水稻种子置于湿润的珍珠岩上,黑暗条件下28 ℃共培养3 d。
表1 遗传转化正交设计与结果

序号真空处理时间/min菌液侵染浓度OD600真空渗透压/kPa植株死亡率/%GUS基因转化率/%120.441.110.00220.6167.780.00320.883.330.004212011.111.11521.21211.112.22650.488.890.00750.62013.335.56850.81213.336.67951411.114.441051.21618.8910.001180.41213.336.671280.648.896.671380.81613.3313.331481812.228.891581.22024.4417.7816110.41618.8910.0017110.6815.5612.2218110.82028.8921.11191111221.1117.7820111.2428.8912.2221140.42033.3311.1122140.61227.7817.7823140.8435.5616.67241411644.4424.4425141.2847.7817.78
1.2.4植株死亡率及GUS组织化学检测统计
共培3 d后,恢复正常光照,待水稻幼苗自然生长5 d,统计水稻幼苗死亡数;参照Jefferson[15]的方法,剪取新萌发的幼苗叶片进行GUS组织化学检测,统计GUS染色阳性株数。计算植株死亡率和GUS基因转化率。

图1 pCambia-Ubi-McCHIT1载体结构示意图

注:A为GUS组织染色(左为贵州禾来拢野生型;右为GUS阳性植株。bar=500 μL);B为转基因植株PCR检测(M为Marker;W为贵州禾来拢野生型;P为菌液DNA;3~8为转基因植株)图2 转基因植株组织化学染色及PCR检测
植株死亡率(%)=(植株死亡株数/总侵染样本数)×100%;
GUS基因转化率(%)=(GUS染色阳性植株/总侵染样本数)×100%。
1.2.5转基因植株的PCR检测
将GUS染色阳性植株移栽至土壤中,常规肥水管理。按天根新型植物DNA提取试剂盒说明书提取来拢野生型及GUS染色阳性水稻叶片DNA,进行PCR检测。PCR的反应条件为:94 ℃,3 min;94 ℃,30 s,54 ℃,30 s,72 ℃,30 s,35次循环;72 ℃延伸7 min;4 ℃保存。GUS特异性引物:Forward primer:5′-GGTGATTGATGAAACTGCTG-3′;Reverse primer:5′-GAACATTACATTGACGCAGG-3′,产物长度为304 bp。
1.2.6数据处理
试验数据用SPSS 21.0软件及Microsoft office Excel 2016软件处理分析,多重比较选用邓肯氏法。
2 结果与分析
2.1 各因素对贵州禾来拢死亡率的影响
通过统计贵州禾来拢死亡株数,计算出正交试验中各组植株的死亡率,分析各因素对水稻死亡率的影响。结果表明,真空处理时间、菌液侵染浓度OD600、真空渗透压3个因素越大,植株死亡率最高(表1)。方差分析结果发现,真空处理时间与菌液侵染浓度对来拢的死亡率均有显著影响,真空渗透压对死亡率影响不大(表2)。极差分析发现,真空处理时间的极值(R值)最大达到30.89,菌液侵染浓度次之,最小的是真空渗透压。说明真空处理时间对植株死亡率的影响最大,真空渗透压影响最小(表3)。
表2 3个因素对植株死亡率的方差分析
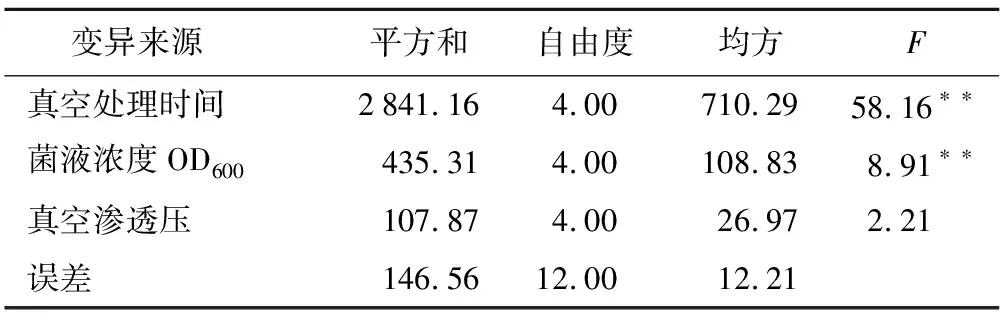
变异来源 平方和自由度均方F真空处理时间2841.164.00710.2958.16∗∗菌液浓度OD600435.314.00108.838.91∗∗真空渗透压107.874.0026.972.21误差146.5612.0012.21
表3 3个因素对植株死亡率的极差分析

同水平植株死亡率和真空处理时间菌液侵染浓度OD600真空渗透压k1j6.8915.1117.11k2j13.1114.6717.56k3j14.4418.8917.33k4j22.6720.0020.67k5j37.7826.2222.22R30.8911.565.11
2.2 各因素对贵州禾来拢遗传转化率的影响
用于遗传转化的pCambia-Ubi-McCHIT1载体具有内含子GUS报告基因,转化成功的水稻植株经过GUS组织化学染色会呈现出蓝色(如图2 A)。对GUS组织化学染色阳性植株与来拢野生型的叶片进行PCR扩增,以质粒DNA为阳性对照,来拢野生型为阴性对照。结果表明:GUS染色阳性植株与质粒DNA均能得到大小304 bp左右的条带,野生型来拢没有条带,说明外源基因已经成功转入了GUS染色阳性植株(如图2 B)。
表6 各因素不同水平对植株死亡率及GUS基因转化率的影响

因素水平 真空处理时间 菌液侵染浓度OD600 真空渗透压 植株死亡率GUS 基因转化率植株死亡率GUS 基因转化率植株死亡率GUS 基因转化率16.89d0.67e15.11c5.56c17.11b8.00b213.11c5.33d14.67c8.45b17.56b7.78b314.44c10.67c18.89b11.56a17.33b10.22a422.67b14.67b20.00b11.33a20.67a11.55a537.78a17.56a26.22a12.00a22.22a11.33a
注:表中同列不同小写字母表示p<0.01差异显著。
对GUS染色检测呈阳性的植株数目统计分析,计算得出GUS基因转化率,并对其进行极差分析与方差分析,结果表明:真空处理时间14 min,菌液侵染浓度OD6001.2,真空渗透压16 kPa植株GUS转化率最高(表1);方差分析表明,3个因素均对植株遗传转化率有显著影响(表4);3个因素的R值大小顺序为真空处理时间>菌液侵染浓度OD600>真空渗透压,说明对水稻转化率影响最大的是真空处理时间,其次为菌液侵染浓度,真空渗透压对转化率的影响最小(表5)。
表4 3个因素对GUS基因转化率的方差分析

变异来源平方和自由度均方F真空处理时间761.2004190.30025.833∗∗菌液浓度OD600122.000430.5004.140∗真空渗透压105.600423.1003.549∗误差88.400127.367
注:“*”表示p<0.05差异显著,“**”表示p<0.01差异极显著。
表5 3个因素对GUS基因转化率的极差分析

同水平GUS基因转化率和真空处理时间菌液侵染浓度OD600真空渗透压k1j0.675.568.00k2j5.338.457.78k3j10.6711.5610.22k4j14.6711.3311.55k5j17.5612.0011.33R值16.896.443.78
2.3 各因素的不同水平对植株死亡率及转化效率的综合影响
随着真空处理时间的增长,植株死亡率呈现出增加趋势。处理5~8 min时,植株的死亡率并未出现显著增加;处理时间大于8 min后,死亡率达到了20%以上,在14 min时达到最大值(为37.78%)。菌液侵染浓度OD600增大,植株死亡率也逐渐增加。当菌液浓度OD600达到1.2时,植株死亡率最大(为26.22%)。真空渗透压对植株死亡率影响较小,真空渗透压低于12 kPa时,植株死亡率无明显变化(在17%左右);高于16 kPa后,死亡率明显提高(达到20%以上)。GUS转化率与真空处理时间成正相关。真空处理时间2 min时,GUS转化率最小(仅达到0.67%);在高于8 min后,GUS转化率能达到10%以上。菌液浓度OD600越大,GUS基因转化率也越大,菌液浓度OD600为1.2时,GUS基因转化率达到最高水平(为12%)。对真空渗透压与GUS基因转化率结果分析发现,渗透压压强低于8 kPa时,GUS基因转化率均处于10%以下;大于12 kPa时,GUS转化率达到10%以上,真空渗透压16 kPa时基因转化率最大(为11.55%)(表6)。
综合各因素对植株死亡率及转化效率的影响,认为:真空处理11 min,菌液侵染浓度OD6000.8,真空渗透压16 kPa是农杆菌介导贵州禾来拢茎尖遗传转化的最优参数。
3 讨 论
研究表明,在农杆菌介导的遗传转化中,外植体类型、菌液浓度、真空渗透压以及真空处理时间等因素对植株的转化效率及死亡率有密切的影响[16-18]。菌液浓度作为影响农杆菌转化效率的关键因素之一,其最适浓度会随着材料及方法的不同而发生很大的变化[19]。以植物愈伤组织为转化受体的最适菌液浓度较低,在0.5左右;以茎尖为转化受体的最适菌液浓度偏高,可以达到0.9以上[20,21]。张笑寒等认为,粳型黑糯米“平塘黑糯”与贵州禾“黎平杂边禾“进行茎尖遗传转化体系构建中发现,菌液浓度与遗传转化率呈正相关[9];黄仁权等研究表明,菌液浓度对黎平杂边禾死亡率影响较大但对平塘黑糯的影响不大,推测是由于水稻种类不同导致的[6]。本研究中贵州禾来拢与黎平杂边禾的结果类似,菌液浓度对死亡率及转化率均有显著影响。本实验室在前期研究发现:黑糯具有较白糯更强的抗逆性,可能是由于黑糯含有花青素等抗氧化性较强的物质,对生物和非生物胁迫的耐性都强。因此我们推测,黑糯米中由于含有花青素等物质,对农杆菌浓度的耐受性较高;白糯米对菌液浓度更敏感。
作为辅助农杆菌浸染植物的方法,真空渗透处理也会对植株的遗传效率产生影响[22]。处理压强过高、处理时间过长都会增大植株死亡率;处理压强过低及处理时间过短,则会让导入受体的农杆菌数量过少,降低基因的转化率。真空处理时间是影响贵州禾来拢死亡率及转化率的最关键因素,处理时间越长,来拢的死亡率与转化率均越高。真空渗透压压强对来拢死亡率影响较小,以16 kPa为分界点,渗透压压强大于16 kPa后植株死亡率显著提高到20%以上。来拢转化率则以真空渗透压12 kPa为分界点,高于12 kPa转化率明显升高。说明贵州禾来拢对真空处理具有一定适应力,短时间的高渗透压对来拢的影响并不大,但长时间的处理会对来拢造成十分严重的影响。

