调控肿瘤缺氧诱导因子的锰模拟酶及其纳米RNA复合物研究进展
方秀林,杜夏,陈秋云*,高静
(1. 江苏大学化学化工学院,江苏 镇江 212013;2. 江苏大学药学院,江苏 镇江 212013)
锰是人体内一种微量元素,也是锰超氧化物歧化酶(MnSOD)、锰过氧化氢酶(Mn catalase)等多种酶的活性中心金属离子,参与机体多种功能的维持。MnSOD和锰过氧化氢酶等锰酶结构模拟物及其化学性能相继被报道[1],但锰酶模拟物在缺氧调控领域的运用报道较少。近年来,随着靶向型抗肿瘤金属药物的发展,金属酶模拟物及其生物活性引起人们的重视。小分子锰酶模拟物集小分子抑制剂、酶的功能模拟、线粒体功能的调控及金属离子成像特性为一体,是一种多效应金属药物。许多实体瘤均存在缺氧的微环境,干预肿瘤缺氧的微环境成为肿瘤诊断与治疗药物开发的途径之一。本文就锰酶模拟物对肿瘤缺氧信号的调控情况及纳米酶-siRNA复合物协同干预肿瘤缺氧信号的研究进展作一综述,以期为缺氧肿瘤治疗药物的研究提供参考。
1 缺氧诱导因子与肿瘤
1.1 缺氧诱导因子
缺氧是实体瘤的显著特征,肿瘤细胞快速增殖形成大的实体瘤肿块,导致这些肿块周围的血管阻塞和压缩,异常的血管往往不能正常工作,导致向中心肿瘤区域供氧不足[1]。缺氧环境可刺激肿瘤血管的生成,目前认为缺氧诱导因子(HIF)在该过程中发挥至关重要的作用,HIF-1的激活是这种缺氧微环境中肿瘤细胞常采用的存活途径,目的是适应低氧压力条件[2]。活化的HIF-1可通过转录激活100多个下游基因,调节肿瘤生存和进展所需的重要生物学过程[3],高表达的HIF也是肿瘤放化疗产生耐药性的一个不良预后标志物,其中涉及肿瘤细胞的葡萄糖代谢,肿瘤细胞增殖、迁移和血管生成,所以,HIF在肿瘤细胞中的激活是协调肿瘤适应缺氧环境的主要机制之一[4]。
1.2 缺氧诱导因子与肿瘤能量代谢
在快速生长的肿瘤组织中,缺氧微环境下HIF-1的高表达可促使肿瘤细胞将葡萄糖代谢从更有效的氧化磷酸化转变为低效的糖酵解途径,以便维持它们的能量生产,这就是Warburg效应[5],故低氧环境下的肿瘤细胞倾向于消耗更多的葡萄糖以满足其能量需求。HIF-1通过诱导参与糖酵解途径的酶和葡萄糖转运体(GLUT)的过表达来介导这种代谢转化,具体表现为肿瘤细胞中葡萄糖转运蛋白(GLUT1、GLUT3)和糖酵解酶[人果糖二磷酸醛缩酶A(ALDOA)]、重组人烯醇化酶1(ENO1)、甘油醛-3-磷酸脱氢酶(GAPDH)、己糖激酶1(HK1)、己糖激酶2(HK2)、肝脏磷酸果糖激酶(PFKL)、磷酸甘油酸激酶1(PGK1)、丙酮酸激酶M2(PKM2)和乳酸脱氢酶A(LDH-A)的高表达,可以提高糖酵解效率,并产生大量乳酸,形成酸性的肿瘤微环境,从而进一步促进肿瘤的转移[6]。另有研究显示,HIF-1还可通过增加丙酮酸脱氢酶激酶1(PDK1)的表达来抑制线粒体氧化代谢[7]。因此,HIF-1的积极表达可调控肿瘤细胞的代谢重编程,以利于肿瘤细胞适应低氧应激[8]。
1.3 缺氧诱导因子与免疫调节
肿瘤的免疫逃逸是肿瘤的十大特点之一,据文献报道这种肿瘤的恶性进展与其缺氧的微环境息息相关。缺氧可以通过改变先天性和适应性免疫细胞的功能或通过增加肿瘤细胞对免疫效应的细胞溶解活性来对抗机体的免疫应答[9]。程序性死亡受体1(PD-1)是一种重要的免疫抑制分子,其在肿瘤细胞中极为活跃,PD-1与其配体(PD-L1)的结合会启动T细胞的程序性死亡,使肿瘤细胞获得免疫逃逸,同时肿瘤细胞在缺氧状态下高表达HIF及其下游通路蛋白,调节肿瘤细胞免疫应答,从而逃避免疫系统的识别攻击[10]。研究表明,缺氧条件下,HIF-1与PD-L1高度共表达,且呈正相关,PD-L1是HIF-1的直接靶基因[11]。另有研究认为,由于正常细胞中HIF-1表达受HIF-1脯氨酸羟化酶(PHD)的调控,因此设计人工小分子PHD抑制肿瘤进程中的免疫逃逸或抑制肿瘤HIF的表达是肿瘤治疗的新途径[12]。
2 酶模拟物及其对缺氧信号的调控
2.1 脯氨酸羟化酶模拟物
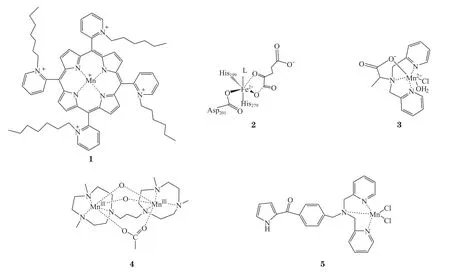
锰作为人体必需的微量元素之一,主要分布在线粒体丰富的脑、肝、胰腺及肾组织,是过氧化氢酶等多种酶的活性中心或辅助因子,具有较好的生物化学效应。由于肿瘤细胞线粒体膜电位高于正常细胞,金属配合物能通过线粒体膜电位诱导的被动富集作用进入肿瘤细胞的线粒体[13]。线粒体是参与锰配合物诱导肿瘤细胞凋亡的重要细胞器[14]。Miriyala等[15]和Panchatcharam等[16]报道,锰卟啉配合物(化合物1)能穿过线粒体膜进入线粒体,在线粒体内起MnSOD酶的作用,调节线粒体氧化还原环境,诱导肿瘤细胞的凋亡。HIF-1α能被PHD降解,其中PHD属于活性中心为二价铁离子的非血红素氧化酶。陈秋云研究团队用锰替代PHD结构活性中心二价铁(化合物2),制备了其结构模拟物(化合物3),结果表明化合物3能与转铁蛋白结合进入转铁蛋白高表达的肿瘤细胞[17-18]。肿瘤细胞中的转铁蛋白高于正常细胞,因此锰配合物对于肿瘤细胞具有较好的识别能力,除了减弱肿瘤细胞的线粒体的功能外,还具有活性氧(reactive oxygen species,ROS)信号传导的自噬细胞死亡的功能[19];当ROS被清除时,抑制剂诱导的自噬受到阻碍[20]。另外,线粒体中过量产生的ROS可以诱导细胞凋亡和自噬蛋白质的释放[21]。Pialoux等[22]报道一定量ROS负责稳定HIF-1α,而低剂量的外源性H2O2可上调HIF-1α的表达。Chen等[23]发现化合物3和三氮环十二烷配体的过氧化氢酶模拟物(化合物4)进行短期预处理能阻止H2O2诱导的神经细胞凋亡。此外,Kaewpila等[24]的研究结果显示:锰超氧化物歧化酶能抑制低氧诱导的HIF-1α、干预抗凋亡蛋白(Bcl-2)和神经保护性HIF-1α下游基因[血管内皮生长因子(VEGF)和促红细胞生成素(EPO)]的表达。上述文献报道的结果说明用小分子锰酶模拟物干预HIF-1α,可触发线肿瘤细胞粒体无氧糖酵解转变为氧化磷酸化来调节能量代谢,这为靶向癌症代谢开启了一个治疗窗口。
2.2 锰酶模拟物对肿瘤代谢的调控
肿瘤细胞在氧气充足的情况下仍然选择糖酵解的代谢方式为瘤体供能,即有氧糖酵解[25]。肿瘤有氧糖酵解可导致丙酮酸进入线粒体,致三羧酸循环代谢被抑制,同时,LDH-A表达增多,从而促进丙酮酸进入糖酵解途径转化为乳酸,导致一个酸性的微环境出现而使肿瘤细胞更具有侵袭性[26-27]。LDH-A是HIF-1α调控并影响肿瘤糖酵解途径中高度活化的酶[28]。陈秋云研究团队将具有乳酸脱氢酶识别基团(吡咯甲酮基)与二吡啶甲基胺锰配合物共价偶联制备成锰配合物(化合物5),其具有调节肿瘤细胞线粒体膜电位与线粒体钙吸收等特性,还可以抑制LDH-A的表达,从而减少乳酸的生成,降低HepG-2细胞中HIF-1α和GLUT1的表达,减弱肿瘤细胞的有氧糖酵解[29]。另外,线粒体代谢中脂肪酸合酶(FASN)是脂肪酸代谢的关键酶,负责将丙二酸单酰辅酶A和乙酰辅酶A转变成脂肪酸。与正常细胞外源性摄取脂肪酸相比,肿瘤细胞偏好于依赖FASN从头合成脂肪酸,FASN成为开发调节肿瘤能量药物的靶点之一[30]。有机小分子脂肪酸合成酶抑制剂已有较多报道[31],金属药物用于脂肪酶抑制报道较少。Wang等[32]研究了化合物5与FASN的结合作用及其对乳腺癌细胞中的FASN表达量的影响,结果表明化合物5可以与FASN结合,降低乳腺癌细胞中FASN的表达量,调节糖酵解和脂肪酸代谢的交互机制,从而影响乳腺癌细胞的生长。综上所述,锰配合物可通过抑制乳酸的生成来调节氧化磷酸化与糖酵解之间的平衡,从而改变肿瘤微环境,通过干扰脂肪酸的合成来调控肿瘤细胞线粒体代谢。
3 纳米锰缺氧抑制剂
为提高肿瘤细胞对金属模拟酶的吸收,近年来,纳米酶模拟物成为研究的热点。Attar等[33]报道了金属纳米模拟酶及其在生物医学方面运用的研究进展。肿瘤细胞中过氧化氢的浓度高于正常细胞,过氧化氢响应的抗肿瘤化合物具有肿瘤细胞内过氧化氢激活的抗肿瘤效应,可提高对肿瘤的抑制作用,并且减少对其他非靶向部位的毒副作用,降低抗肿瘤配合物的副作用,肿瘤靶向RGD肽(精氨酰-甘氨酰-天冬氨酸)修饰纳米过氧化氢酶模拟物可提高纳米酶模拟物在肿瘤细胞的吸收[34]。近期,胍胺修饰的纳米硅酸锰被用于缺氧肿瘤细胞内谷胱甘肽(GSH)及过氧化物酶4的抑制,从而通过ROS及GSH途径诱导肿瘤细胞铁死亡(ferroptosis)[35]。由于氧化锰为酸响应的Mn2+释放体,因此,以氧化锰为外壳、磁性碳化铁为核包裹葡萄糖氧化酶(GOD)可作为Mn2+、O2和GOD的输送体,从而调节肿瘤的微环境[36]。Musetti等[37]发现,铁蛋白纳米笼(ferritin nanocages,FTns)能富集在转铁蛋白受体1(TfR1)高表达的缺氧肿瘤细胞,也能作用于T-细胞免疫球蛋白黏蛋白分子-2(TIM-2),抑制HIF-1α的表达,通过HIF-1α及ROS等发挥的多种效应实现对肿瘤的抑制作用。另有研究显示,近红外光激活的纳米锰复合物可利用光和水产生单线态氧,弥补肿瘤缺氧环境中光动力学治疗(PDT)试剂不能有效产生单线态氧的缺陷,这类光活性锰复合物是光响应及过氧化氢激活的纳米HIF-1α抑制剂[38]。为提高金属配合物靶向性,降低其非特异性吸收,在牛血清白蛋白(BSA)包裹的锰配合物的外壳上通过共价键修饰引入肿瘤细胞高表达的GLUT-1核酸适配体,可以提高纳米颗粒对肿瘤的识别,因而GLUT-1与BSA修饰的纳米锰配合物具有肿瘤靶向性吸收、光驱动释放氧与热量的功能,该纳米颗粒能抑制GLUT-1与HIF-1α的表达,通过线粒体途径干扰肿瘤的能量代谢,实现肿瘤的抑制效应[39]。此外,以PtCo作为氧化酶模拟物、MnO2为过氧化氢酶模拟物能获得缺氧响应的纳米金属药物MnO2@PtCo,其不仅能缓解缺氧,还可通过ROS途径抑制肿瘤的生长[40]。最近,有研究认为可提高细胞内氧压或运用修饰的MnO2纳米酶缓解缺氧并作为ROS产生源,从而诱导肿瘤细胞凋亡[41-42]。然而,目前纳米氧化酶的体内毒性与生物效应有待进一步研究。
4 纳米磁性RNA输送体
长期以来通过化学试剂诱导细胞凋亡,从而引起HIF-1α的下调,利用基因干预HIF-1α是近年来研究的热点之一。HIF-1α主要存在于细胞核中,通过干预存在线粒体中的少量HIF-1α来探索肿瘤的能量代谢调控是该研究的新途径。由于DNA分子上磷酸基团及碱基上N、O与金属离子具有较强的结合能力,因此金属DNA纳米球可用于神经生长因子siRNA的输送,干预胰腺癌的生长[43]。陈秋云研究团队运用富含鸟嘌呤-腺嘌呤-鸟嘌呤(GAG)碱基序列的核酸与Fe(Ⅱ)、Mn(Ⅱ)配位组装制备了线粒体靶向siRNA输送体,该输送体能通过电荷作用与碱基配对双效作用负载siRNA到线粒体,干扰HIF-1α的表达,实现了缺氧乳腺癌的基因治疗[44]。由于HIF-1α能够被miRNA调节,Yang等[45]通过miRNA对HIF-1α表达的抑制来控制肿瘤的生长,这也是肿瘤缺氧基因治疗的有效途径。综上所述,金属配位诱导组装制备的纳米金属核酸具有药物输送、基因输送及生物相溶性好等特点,是具有良好发展前景的多效应缺氧调控纳米药物。
5 结论与展望
目前,有关氧化酶模拟性能的锰配合物及纳米氧化酶模拟物的结构与性能已进行了深入的研究[46-47],锰酶模拟物具有多模态成像、线粒体途径调节肿瘤缺氧信号的功能,尤其是纳米有机金属锰药物有望借助多模分子影像技术用于磁共振成像(MRI)影像监测治疗。锰配合物及纳米复合物在细胞及动物水平实现了对缺氧肿瘤的调控,但化合物的作用机制尚未阐明。根据缺氧肿瘤生物标志物,设计生物分子激活的纳米酶是开发低毒性纳米药物的有效途径,此外,集化学治疗与基因输送为一体的锰酶模拟物是具有良好发展前景的多效应缺氧调控纳米药物。

