2018年江苏省药品注册分析报告
王宗敏,刘玥
(江苏省药品监督管理局,江苏 南京 210008)
2018年,江苏省药品监督管理局(以下简称省局)积极落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院办公厅《关于改革完善仿制药供应保障及使用政策的意见》,深入推进药品审评审批制度改革各项措施,鼓励药品研发创新,助推医药产业高质量发展,从源头保障药品的质量与安全。现对2018年江苏省药品注册受理审批及注册管理工作情况作汇总分析。
1 药品注册情况分析
1.1 药品注册受理
2018年江苏省辖区内企业向国家药品监督管理局(以下简称国家局)申报药品注册申请(包括申报临床、生产、国家局审批的补充申请)共724件(按受理号计),居全国第1(见图1)[1]。省局受理的注册申请共计2 138件,其中省局审批的药品补充申请220件、省局备案的补充申请523件,药品再注册申请399件,医疗机构制剂(含再注册、调剂、委托配制等)147件,省局行政许可受理中心受理研究用对照药品一次性进口849件(见图2)。
自2015年药品审评审批制度改革以来,江苏省药品注册申报更加趋于理性,品种结构更加优化,药物创新紧跟国际药品研究前沿技术,能力水平显著提升。2018年江苏省企业申报的药品注册申请中,化药新药申请122件,占全国化药新药申请总数(372件)的32.8%,居全国第1,比2017年增长26.2%(见图3)[2]。
化药新药的适应证主要集中在癌症、感染性疾病、血液系统疾病、消化系统疾病、内分泌系统疾病等。江苏豪森药业申报的甲磺酸氟马替尼为国内首个报产的尼罗替尼分子结构优化之后的第2代融合蛋白酪氨酸激酶抑制剂(Bcr-Abl TKI),拟用于费城染色体阳性的慢性髓性白血病患者治疗,对肝肾功能、胰腺等器官的功能损伤明显下降。
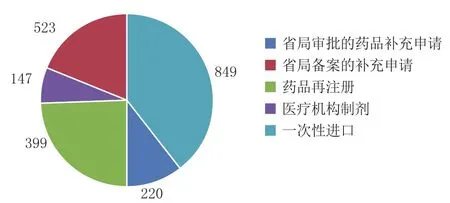
图 2 2018年江苏省受理药品注册申请的结构分布Figure 2 Categories of drug registration applications in Jiangsu province in 2018

图 3 2018年各省(市)申报化药新药注册情况Figure 3 Registration of new chemical drugs in different provinces(cities) in 2018
恒瑞医药申报的注射用甲苯磺酸瑞马唑仑是瑞马唑仑的改盐化合物,相比瑞马唑仑具有更高的稳定性,因其毒性低、临床疗效佳作为特优药品获国家局药品审评中心优先审评。
在化药申报企业中,恒瑞医药无论从受理号还是品种计,申报量均居全国第1,其次为正大天晴药业集团
(见图4、图5)[2]。两家企业化药创新能力强,实力雄厚。

图 4 2018年全国药企化药申报数量情况(按受理号计)Figure 4 Number of chemical drug registration by pharmaceutical enterprises in China(according to Acceptance No.)

图 5 2018年全国药企化药申报数量情况(按品种计)Figure 5 Number of chemical drug registration by pharmaceutical enterprises in China(according to drug category)
2018年江苏省企业申报生物制品申请40件,占全国(263件)申报生物制品申请总数的15.2%,比去年增长52%(见图6)[2]。
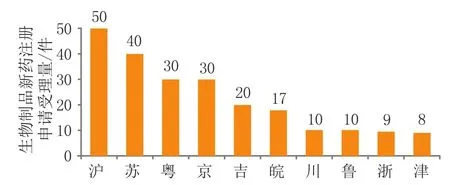
图 6 2018年各省(市)申报生物制品新药注册情况Figure 6 Registration application of new biological products in different provinces(cities) in 2018
江苏省生物制品起步虽晚,但增长较快。2018年申报量已跃居全国第2,研发范围覆盖国内外热门靶点。2018年仍以申报临床试验为主,如恒瑞医药申报的SHR-1222注射液是一款靶向硬骨素(sclerostin)的单抗药物,用于治疗骨质疏松症,全球尚无同靶点药物上市;信达生物制药申报的IBI101是具有自主知识产权的肿瘤坏死因子受体超家族成员4(TNFRSF4/OX40)激动剂,拟用于治疗多种实体肿瘤疾病;信达生物制药申报的IBI318为针对程序性死亡受体1(PD-1)及肿瘤相关抗原(TAA)的一个未披露靶点的重组全人源抗程序性双特异性抗体,有望为患者提供全新的临床解决方案;东曜药业申报的自主研发的抗体偶联药物注射用TAA013拟用于治疗表皮生长因子受体2(HER2)阳性乳腺癌患者,国内目前尚无治疗该肿瘤的抗体偶联药物上市。2018年申报生产的品种明显多于2017年,其中3个PD-1/PD-L1品种为国内最先申报上市的产品,分别为信达生物制药申报的信迪利单抗注射液、苏州众合生物申报的特瑞普利单抗注射液及恒瑞医药申报的注射用卡瑞利珠单抗,其中信迪利单抗注射液和特瑞普利单抗注射液已于2018年获批上市;除此之外,江苏吴中医药申报的1类创新药重组人血管内皮抑素注射液、信达生物制药申报的生物类似药阿达木单抗注射液均在审评中,可望近期获批上市。
在生物制品申报企业中,信达生物制药申报品种数量居全国第2,恒瑞医药申报量居全国并列第3(见图7)[2]。信达生物制药申报品种以治疗用生物制品1类为主,涵盖OX40、整合素相关蛋白(IAP/CD47)、血管内皮生长因子(VEGF)、PD-1等抗肿瘤靶点。恒瑞医药申报品种均为治疗用生物制品1类,适应证包括肿瘤、骨质疏松症、高胆固醇血症。1类生物制品新药申请中,恒瑞医药申报量居全国第1,信达生物居全国第2(见表1)[2],彰显了江苏省生物制品的研发创新能力。

图 7 2018年全国药企生物制品申报数量情况(按品种计)Figure 7 Number of biological product registration bypharmaceutical enterprises in China(according to drug category)

表 1 2018年全国药企1类生物药申报数量情况Table 1 Number of class 1 biological product registration by pharmaceutical enterprises in China
1.2 药品注册检验
2018年省局共发出药品注册检验通知432次,江苏省食品药品监督检验研究院(以下简称省院)完成药品注册检验1 905批(含药品辅料12批),占全年检验工作量的16%,相比2017年注册检验量有所上升;全年共受理进口药抽检119批次,完成抽样检验417件,占全年工作量的4%。2018年对药品注册检验发出不合格报告4份,其中药品检验不合格项目主要有释放度、粒径、细菌内毒素等;对进口药品抽样检验未发出不合格报告;注册复核检验发现的问题主要是标准书写不规范、方法学验证资料不完整、检验项目设置不合理或限度不合适、方法重现性或耐用性差等。
一致性评价复核工作方面,省院分别于2018年4月和7月接受了厄贝沙坦片和利福平胶囊(共3个规格)的一致性评价复核工作,均在规定时间内完成复核。对国家局一致性评价办公室指定的10个品种(14个规格)进行复核检验,已完成6个。复核内容包括:按核定的药品标准全项目检验、样品与参比制剂进行溶出曲线对比、有关物质检查方法复核等。
1.3 药品技术审评
2018年,省局认证审评中心接收药品生产技术转让申报资料14个品种,全年完成技术转让审评63个品种,完成数较去年增加近50%,其中上报省局32个(17个批准、15个不批准),全年有11个品种获得国家局批准。接收药品补充申请技术审评资料69个品种,其中51个品种为申请改变国内生产药品的有效期,18个为变更直接接触药品的包装材料;完成并上报省局59个品种(其中建议批准31个,建议不批准15个,申请单位主动提出撤回申请11个,退省局2个),申报数量和技术审评完成数量均为2017年的2倍。接收江苏云阳药业盐酸普萘洛尔片、美洛昔康片等10个品种的上市许可持有人(MAH)申请资料技术审评,完成技术审评并上报省局9个品种。
1.4 药品注册审批
1.4.1 批准情况
2018年江苏省共收到国家局药品类批复件514件(按受理号计),获批419件,批准率为81%,比2017年高9个百分点(见表2)。另有复审件6件,其中批准1件,批准率为17%。
批准件中,药品注册申请批准件215件,批准率为81%,其中批准临床试验141件,占66%,批准生产上市74件,占34%,批生产上市占比比2017年高2.2倍;药品补充申请批准件204件,批准率为82%(见表3)。
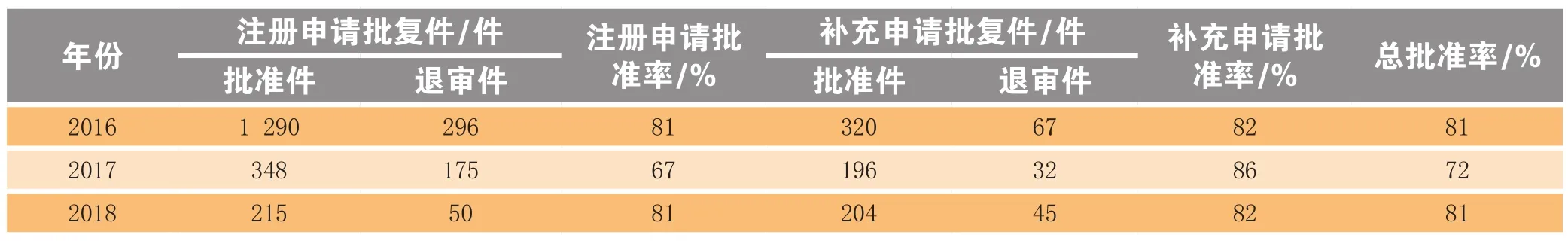
表 2 2016—2018年江苏省药品注册批准情况Table 2 Approval of drug registration application in Jiangsu province in 2016-2018
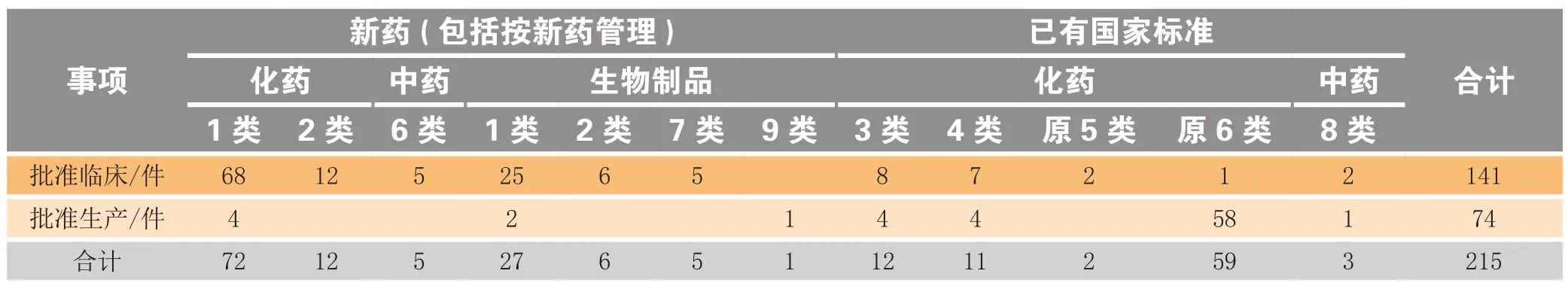
表 3 2018年江苏省各类药品注册申请批准情况Table 3 Approval of different classes of drug registration applications in Jiangsu province in 2018
从批准的类别来看,2018年江苏省获批上市74个药品(以药品批准文号计,下同),占全国总数(896个)的8.3%;其中创新药6个品种,7个批准文号,仿制药67个批准文号。获批品种涉及的适应证领域为:病毒感染、癌症、内分泌系统疾病、神经系统疾病、皮肤五官科疾病等。2018年江苏省获批临床试验药品有141个,占全国总数(1 077个)的13%,其中批临床创新药93个(见图8)。
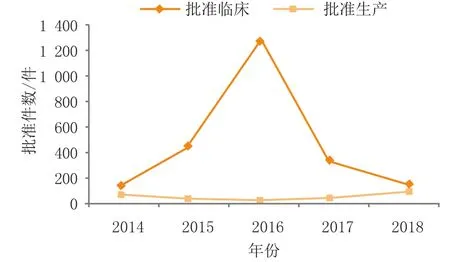
图 8 2014—2018年江苏省获准临床试验和生产的注册批件数Figure 8 Number of drugs with approval document on clinical trial or drug manufacturing license in Jiangsu province in 2014-2018
从批准的品种来看,近5年江苏省新药研发保持良好态势,获批新药均超过仿制药(见图9)。2018年一批具有重要临床价值的创新药获批上市,并实现了生物制品多年来零的突破。江苏省自2000年以来,批准上市创新药按通用名计共20个,按批准文号计共73个。近年来,江苏省研发创新能力不断提升,创新成果显著。2018年,国家局批准上市创新药有48个,除38个进口创新药外,10个国产创新药中有6个落户江苏[1],分别为:南京前沿生物的国内首个长效抗艾滋病新药注射用艾博卫泰、正大天晴的用于治疗晚期非小细胞肺癌的盐酸安罗替尼胶囊、恒瑞医药的用于治疗晚期或转移性乳腺癌的马来酸吡咯替尼片和用于治疗放化疗相关中性粒细胞减少症的硫培非格司亭注射液、苏州众合生物的用于治疗黑色素瘤的特瑞普利单抗注射液、信达生物的用于治疗霍奇金淋巴瘤的信迪利单抗注射液。其中,特瑞普利单抗注射液和信迪利单抗注射液为国内最先获批的PD-1/PD-L1类单抗产品。

图9 2014—2018年江苏省新药和仿制药批准情况Figure 9 Approval of new drugs and generics in Jiangsu province in 2014-2018
江苏省生物制品研发生产呈现厚积薄发态势,目前已有11个PD1/PD-L1类抗肿瘤生物药获批临床,苏州盛迪亚申报的卡瑞利珠单抗注射液和金迪克生物申报的流感病毒裂解疫苗(四价)已通过国家局生产现场检查,即将获批上市,这些均将填补国内市场空白。
1.4.2 退审情况
1.4.2.1 注册申请国家局退审 2018年江苏省共收到国家局药品注册申请退审件50件,其中企业自撤的有7件,因技术性原因退审的有43件。因技术性问题退审的主要原因有:1)产品临床试验不足以支持对疫苗免疫程序的改变以及联合疫苗按所申请免疫程序接种后的有效性和安全性;2)减免临床试验的改剂型品种没有与原剂型进行药效或毒理对比试验,研究资料存在重大缺陷;3)仿制药申报品种与原研对比存在明显种族敏感性差异,缺乏桥接国外安全有效性数据的基础,现有数据缺乏合理性;4)企业研究结果与中检院检验结果在晶型、HPLC鉴别、紫外鉴别方面不一致等。
1.4.2.2 补充申请国家局退审 2018年江苏省共收到国家局补充申请退审件45件,其中企业自撤25件,因技术研究不充分退审20件。因技术性问题退审的主要原因有:1)产品所用关联辅料未获得进口注册证,无合法来源的辅料;2)申报的新增规格较少使用,已上市规格可满足临床使用,申请理由不充足;3)未提供联合用药的非临床药代或安全性研究资料,非临床研究资料不能支持开展临床联合用药的安全性;4)杂质研究和控制不符合《化学药物杂质研究的技术指导原则》技术要求,对灭菌工艺的筛选研究和验证不完善,不能充分支持变更后灭菌工艺选择的合理性等。
1.4.2.3 复审件国家局退审 2018年江苏省共收到国家局复审退审件5件,维持原判原因有:1)杂质研究不充分,稳定性考察项目不全面;2)所用参比制剂无法被认定为原研产品;3)产品的主要成分存在多种规格,申请人未进行筛选,产品重要质量指标低于原研产品等。
1.4.2.4 补充申请省局退审 省局认证审评中心不批准补充申请的主要问题有:1)影响因素试验、加速和长期稳定性研究未对关键项目进行考察;2)商业化生产3批批量与注册申报样品批量相差较大,提供的注册申报样品的长期试验结果不能反映商业化生产产品申报有效期的质量和稳定性;3)申请人未提供是否存在过度包装问题的补充资料,变更申请立题不合理,申报包材供应商检验报告存在可靠性问题;4)中药注射液申请延长有效期,其质量标准控制项目较少且水平较低,不足以评价产品质量和稳定性等。
2 药品注册管理重点工作
2.1 全力推进仿制药质量和疗效一致性评价
为加快推进一致性评价工作,省局支持中国药科大学建设一致性评价技术平台,委托其举办一致性评价系列技术培训班,为企业提供技术、政策方面沟通交流平台,全年举办4期培训,共计1 600余人。协调相关部门落实鼓励措施和配套扶持政策。截至2018年底,江苏省有93家企业共451个批准文号启动了一致性评价工作,其中71个批准文号已完成一致性评价研究并被正式受理,有20个品规(按批准文号计)通过了一致性评价,占全国总量(92个品规)的21.7%。
2.2 持续做好药品上市许可持有人制度试点工作
深入南京江北高新区、栖霞生命科创园等产业集中区进行政策宣贯,引导企业优化资源配置、调整产业布局。会同中国药学会、中国科协企业创新服务中心、江苏省科学技术协会、无锡市人民政府举办“太湖(马山)生命与健康论坛”,从多角度对MAH制度进行解读。做好MAH试点申请事项的受理、审查,探索建立基于MAH制度下新的监管制度、机制和模式。截至2018年底,江苏省各类MAH试点品种申请223件,居10个试点省(市)前列,申请生产140件,申请临床83件,涉及申请人80家,已有49件申请获批,涉及457个品规。
2.3 强化药物研究监管
协调召开江苏省毒理学会药物毒理与安全性评价第二次学术研讨会,推进新版《药物非临床研究质量管理规范》实施。会同卫健委、省科技厅等部门加强药物临床试验机构建设,鼓励药物临床试验机构积极参与创新药临床试验和仿制药一致性评价研究工作。主动探索新制度下监管与服务相结合的模式,组织召开医药创新生态系统构建研讨会和伦理委员会协作审查研讨会,完善临床试验机构顶层设计理念,把准区域伦理委员会建设方向,规范生物等效性研究要求和临床试验行为。截至2018年底,江苏省药物临床试验机构由46家增至58家,生物等效性(BE)试验机构由11家增至24家,分别增长了26%和118%,有效缓解临床试验资源紧张局面。
2.4 加强药品注册日常管理
全年开展注册现场检查397次,其中省局组织现场检查95次(研制现场核查90次,生产现场检查5次);省局认证审评中心结合技术审评开展现场核查21次;委托市局开展药品生产现场检查121次;配合国家局做好辖区内注册核查工作,派出观察员149人次;另外派出检查员参加国家局检查11人次。全年举办了一致性评价、临床试验、药品注册管理等5期培训班,对监管人员和企业开展业务培训。全面完成首批医院制剂品种标准提高工作,整理、核对212个制剂品种质量标准,其中化学药制剂92个、中药制剂120个,汇编成《江苏省医疗机构制剂规程》第一分册并交付印刷。印发《江苏省增补品种中药饮片炮制规范制定工作程序》,规范江苏省中药饮片炮制规范的制定。有序扩大中药配方颗粒生产试点工作,先行将江苏康缘药业股份有限公司作为试点单位,明确中药配方颗粒质量标准研究技术要求及申报资料要求。印发《内部工作文件及管理制度汇编》,健全工作机制,完善制度保障。
2019年,江苏省局将贯彻落实国家局相关改革政策和江苏省出台的《关于深化审评审批制度改革鼓励药品医疗器械创新的实施意见》(苏办〔2018〕43号)及《关于改革完善仿制药供应保障及使用政策的实施意见》(苏政办发〔2018〕62号),推动各项措施落实到位;结合机构改革要求,不断转变政府管理职能,调整药品注册管理方式;持续提高药品、医院制剂的质量标准,加快药品注册信息化建设,为加强日常监管奠定基础。

