出芽短梗霉新菌株RM1603产普鲁兰多糖条件优化及多糖分析
沈琦,张殿鹏,郝雅荞,3,罗翔莲,3,杨佳瑶,魏步云,李欧,赵洪新
1.浙江理工大学 生命科学学院,浙江省植物与次生代谢重点实验室,浙江 杭州 310018;2.北京市农林科学院 植物保护环境保护研究所,北京 100097;3.沈阳师范大学 生命科学学院,辽宁 沈阳 110034
出芽短梗霉(Aureobasidium pullulans)又称黑酵母,隶属于半知菌类短梗霉属,是具有细胞和菌丝2种形态,生活史极为复杂的类酵母型真菌,广泛存在于水、土壤、深海底泥、植物表面等自然环境中[1]。不同来源的出芽短梗霉生长过程中可产普鲁兰多糖、黑色素、重油等具有重要经济价值的代谢产物,特别是普鲁兰多糖是应有极为广泛,极具开发价值的微生物多糖。
出芽短梗霉产生的普鲁兰多糖是类似葡聚糖、黄原胶的胞外、黏质水溶、非离子线性多糖,是一种特殊的微生物胞外多糖,分子式为其基本结构为由α-1,4糖苷键连接的麦芽三糖重复单位,经α-1,6糖苷键聚合而成的直链状多糖,相对分子质量为 4.8×104~2.2×106,分子大小由菌株、培养条件等多种因素决定[2-4]。普鲁兰多糖具有结构灵活、可塑性、成膜性、黏结性、耐热性、耐酸碱性等特性,在食品、石油、化工、医药行业,特别是药物载体、靶向治疗、医学成像、组织工程、血浆置换、疫苗、分子伴侣活性等新兴领域有特殊的应用,是性能优良的天然生物材料[5-7]。又因普鲁兰多糖无毒无害,对人体无副作用,2006年被确定为新增的4种食品添加剂之一[8]。
Bernier首次报道了产糖芽霉菌(Pullularia pullulans),即出芽短梗霉代谢过程中可产特殊的胞外黏质多糖,因而关于普鲁兰多糖的研究受到广泛关注[9]。经过几十年的努力,对约100株不同来源的出芽短梗霉从菌株筛选、产糖条件、发酵工艺、诱变育种、基因工程改造等方面做了大量工作,取得了丰富的研究成果[10-11]。但是不同菌株的产糖能力差别巨大,原始菌通常为20 g/L左右,极少数达60 g/L以上,且多数以专利的形式被一些公司占有,所以寻找和开发产糖高、副产物少的新菌株,一直受研究人员的高度关注。
本研究的出发菌株RM1603是实验室从太湖近岸植物根际土壤中分离得到的一株可产胞外多糖的类真菌,分子鉴定确定其分类归属为出芽短梗霉。该菌在200 r/min、28℃培养60 h的条件下,胞外粗多糖产量达32.91 g/L,与目前报道的100多株出芽短梗霉菌相比,RM1603具有明显的产糖优势,是一株极具开发潜力的产糖新菌株。本研究在单因素确定最佳氮源、碳源及无机盐的基础上,利用正交试验探究RM1603最佳发酵产糖条件,通过薄层层析和红外光谱确定了多糖结构,为进一步提高RM1603的产糖能力奠定了理论基础。
1 材料与方法
1.1 材料
出芽短梗霉RM1603于2015年分离于太湖近岸植物根际土壤,由浙江理工大学微生物实验室保存。
蔗糖、酵母浸粉、玉米浆、麦芽浸粉、ZnSO4、(NH4)2SO4、K2HPO4、KH2PO4、KCl购于国药集团化学试剂有限公司;NaCl、蛋白胨、胰蛋白胨、无水乙醇购于上海生物工程有限公司。
变温摇床(苏州市培英实验设备有限公司,HYG-B);721紫外分光光度计(上海仪电分析仪器有限公司);离心机(赛默飞世尔科技中国有限公司,SL16R);分析天平(奥豪斯仪器上海有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);傅立叶红外光谱仪(Thermo公司)。
1.2 单因素实验
在培养基A基础上,碳源为蔗糖,以ZnSO4、KCl、KH2PO4、蛋白胨、玉米浆、胰蛋白胨、麦芽浸粉为单因素条件,配制相应发酵培养基,测定发酵过程中粗多糖的产量[12-13]。
每种培养基设3组生物学重复,150 mL三角瓶中装50 mL培养基,200 r/min、28℃培养60 h后取20 mL培养物,2000 r/min离心20 min,取上清液10 mL,加入2倍体积的无水酒精,充分振荡,4℃醇沉12 h(过夜),离心,弃上清液,收集沉淀,80℃烘干(恒重)称重,得粗多糖质量,以粗多糖质量为依据,选出最佳培养基成分。
1.3 正交试验
在单因素实验结果的基础上,确定发酵培养基优化正交试验因素水平(表1)、最佳发酵工艺条件正交试验因素水平(表2),由此设计正交试验组,进行发酵实验。
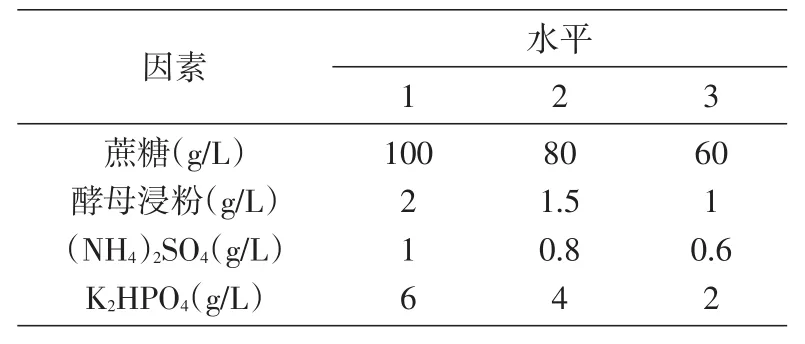
表1 发酵培养基优化正交试验因素水平表
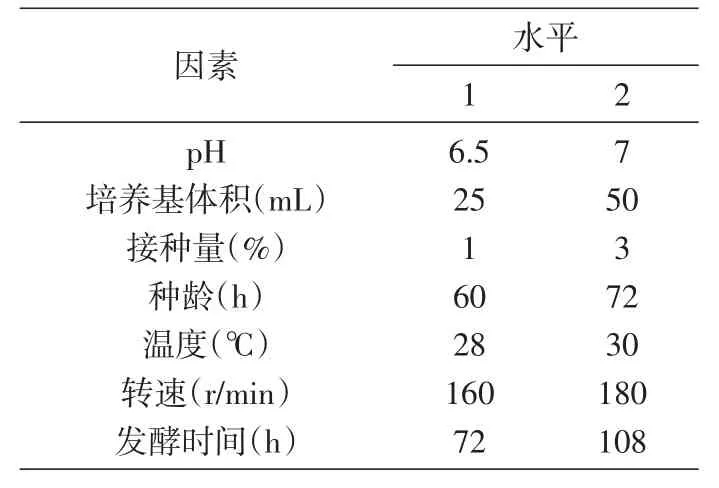
表2 发酵工艺条件优化正交试验因素水平表
1.4 产糖曲线
根据正交试验结果,RM1603菌株在最佳发酵培养基B、最佳发酵条件下,以发酵时间为变量,从发酵24 h开始至180 h为止,每12 h为一个取样点测量普鲁兰多糖质量,绘制粗多糖产量变化曲线,确定RM1603产糖最佳发酵时间,进一步优化发酵条件。
1.5 多糖结构分析
1.5.1 多糖的分离纯化 称取1 g粗多糖,溶于蒸馏水,定容至25 mL,为粗多糖溶液。溶液中加5 mL氯仿异戊醇试剂,充分振荡,4000 r/min离心20 min,静止2 min,取上清,此步骤重复操作3次,得到不含蛋白杂质的上清液,即为多糖溶液。向多糖溶液中加入4倍体积的无水乙醇,4℃静置8 h后12 000 r/min离心10 min,沉淀为多糖。利用DEAE纤维素柱层析及Sephadex G-100凝胶柱层析法对多糖进一步分离纯化。
1.5.2 薄层层析分析 称10 g硅胶干粉,加入0.02 mol/L的NaAC溶液 25 mL,充分搅拌混匀,平铺在玻璃板上,振敲使其均匀,自然晾干,制成硅胶板,置于干燥器中待用[14]。
将0.05 g/mL的普鲁兰多糖标准液和粗提多糖样品溶液各分成2份,每份3 mL,各取一份添加普鲁兰酶0.06 mL,室温酶解8 h。将普鲁兰多糖标准液、多糖样品液、普鲁兰多糖标准酶解液、多糖样品酶解液分别点样于硅胶层析板上,在展开剂中层析,待液体层析至硅胶板顶部后取出吹干,喷硫酸显色剂,吹干后于110℃烘箱烘烤,观察显色反应。
1.5.3 红外光谱测定[15]取KBr,分别按50∶3和12∶1与纯化所得多糖和普鲁兰多糖充分研磨、混匀,在20 MPa压力下压片,将KBr空白片(不含样品)放入傅立叶红外光谱仪采集参比背景光谱,然后对待测样品进行图谱采集。
2 结果
2.1 单因素实验
为了确定单因素氮源对RM1603产多糖的影响,选择了酵母浸粉、蛋白胨、玉米浆、胰蛋白胨、麦芽浸粉分别作为惟一氮源,观察出芽短梗霉菌发酵所得粗多糖产量。由图1可知,以酵母浸粉为氮源的粗多糖产量显著高于其他氮源实验组,多糖产量最高达34.55±1.01 g/L,玉米浆和麦芽浸粉次之,蛋白胨和胰蛋白胨作为主要氮源的实验组产糖最低,由此表明RM1603菌株产糖发酵的最佳氮源为酵母浸粉。
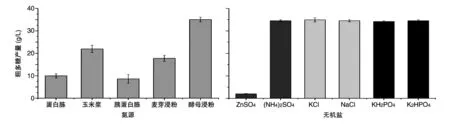
图1 不同单因素(氮源、无机盐)对RM1603粗多糖产量的影响
2.2 正交试验
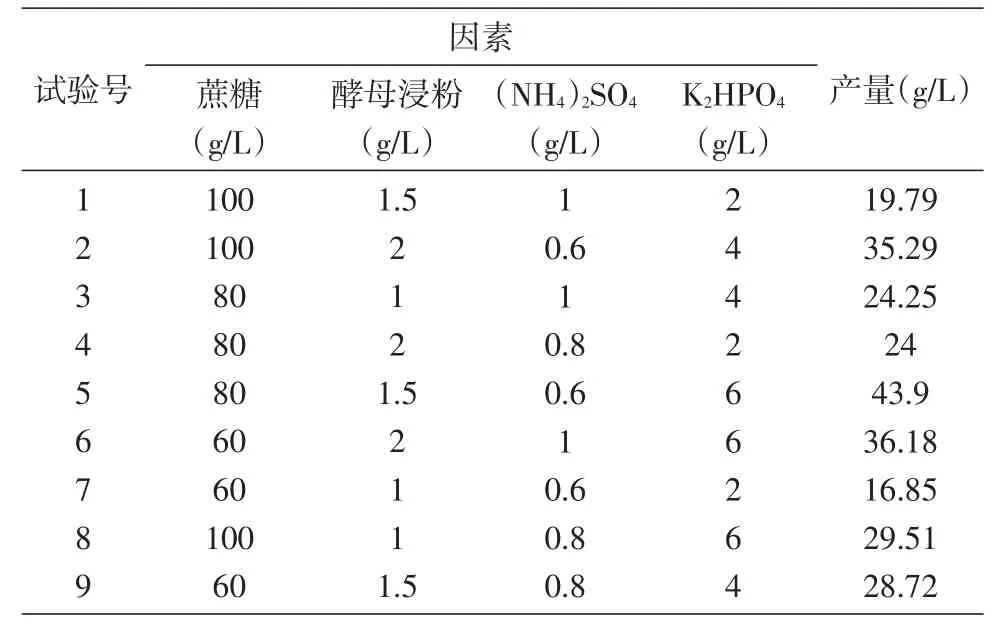
表3 发酵培养基优化正交试验及结果
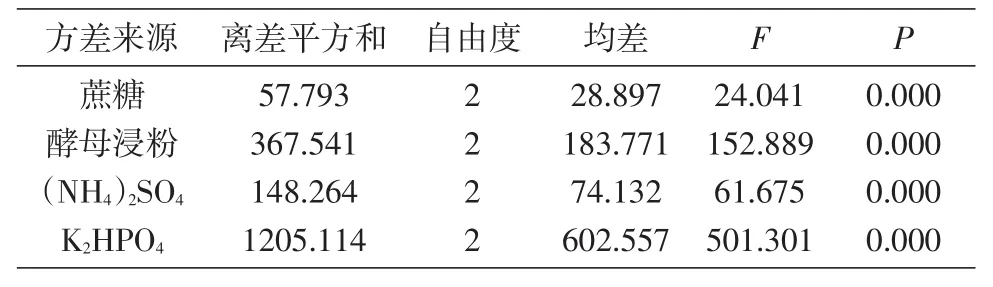
表4 发酵培养基优化正交试验结果方差分析
根据表1设计培养基优化正交试验组,如表3所示进行9组发酵培养[16],试验结果见表3、4。由方差分析结果可知,影响多糖产量的因素依次为K2HPO4>酵母浸粉>(NH4)2SO4>蔗糖;4 个因素均对多糖产量有显著影响,优化结果为蔗糖80 g/L、酵母浸粉 2 g/Lg/L。以此为基础龄60 h、pH6.5、28℃、180 r/min培养72 h,出芽短梗霉菌RM1603多糖产量为43.9 g/L。
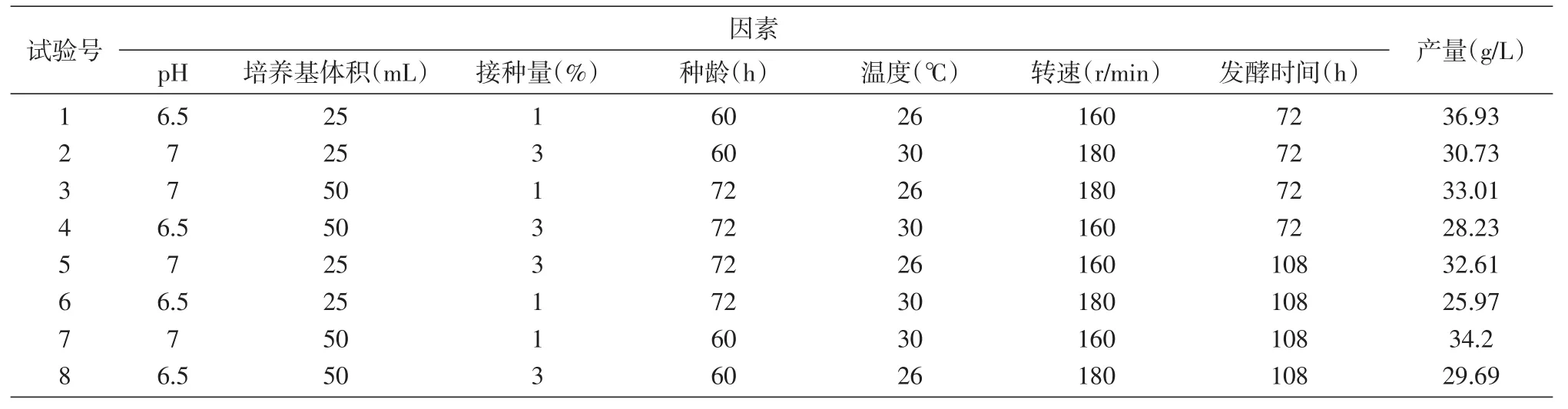
表5 发酵工艺条件优化正交因素水平及结果
根据表2设计发酵工艺条件优化正交试验组,如表5所示进行8组发酵培养,试验结果见表5、6。由方差分析结果可知,影响多糖产量的因素依次为温度>种龄>pH>转速>接种量>发酵时间>培养基体积,其中pH、培养基体积、种龄、温度、转速均对多糖产量有显著影响。因此,最佳发酵条件为pH7、培养基体积25 mL、接种量1%、种龄60 h、温度28℃、转速160 r/min培养72 h。
综上,整合最佳培养基与最佳发酵工艺条件后设7次重复,发酵产量分别为48.52、47.98、48.64、47.34、48.44、47.38 g/L,均值48.05 g/L。
2.3 产糖曲线
在180 h内,自24 h开始,每12 h的粗多糖产量变化如图2所示。96 h时发酵进入平稳期,此时粗多糖产量最高为65.213±0.08 g/L;132 h后粗多糖产量呈下降趋势,可能由于发酵液中碳源不足,导致RM1603利用了产出的普鲁兰糖。
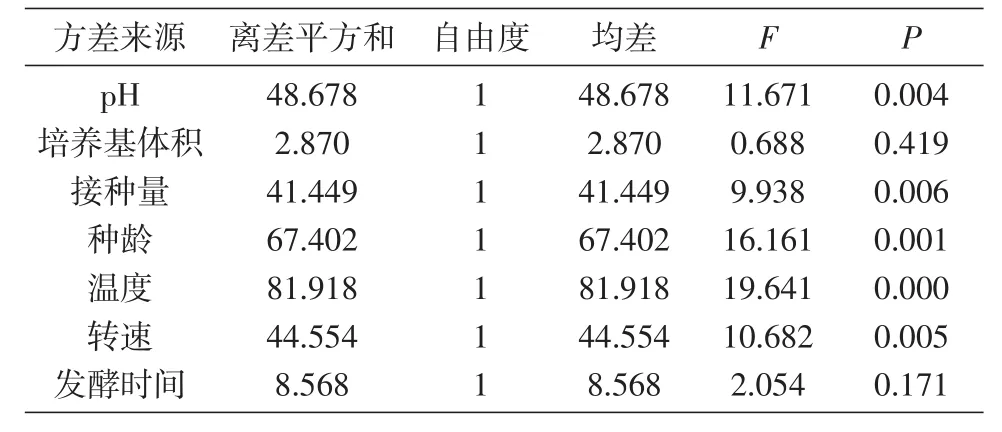
表6 发酵工艺条件优化正交试验结果方差分析
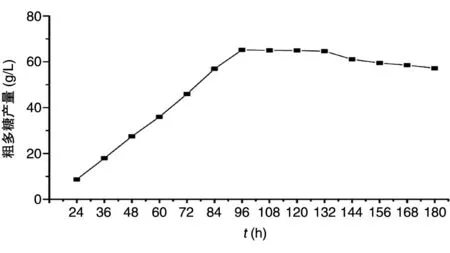
图2 出芽短梗霉RM1603的产糖曲线
2.4 多糖鉴定
2.4.1 薄层层析 以涂布于支持板上的支持物为固定相,以合适的溶剂为流动相,对混合样品多糖进行分离、鉴定和定量[14]。由于普鲁兰酶特异性水解普鲁兰多糖中的α-1,6糖苷键,对其他糖苷键无作用,因此普鲁兰多糖在特异性酶的作用下水解成麦芽三糖。普鲁兰多糖分子较大,留在起点,酶解后产生的麦芽三糖分子较小(图3A)。图中标准品与样品位置基本一致,两者酶解后产物位置基本一致,说明普鲁兰多糖标准品酶解液与多糖样品酶解液中都含麦芽三糖,由此推断该多糖为普鲁兰多糖。
2.4.2 红外光谱分析 多糖类化合物结构中的一些特殊功能基团可以呈现特殊的红外吸收光谱特征,无论是醛糖、吡喃糖环或呋喃糖环的构象和糖苷键构型,还是糖脂、多糖、糖肽、糖蛋白的结构和构象等,均可通过红外吸收光谱进行检测,因此红外光谱法是研究多糖化合物的重要方法[15]。红外光谱图见 3B,3000 cm-1和 1350~1400 cm-1处为糖类物质的特征吸收峰,普鲁兰多糖标准品的特征峰为1200~1030 cm-1处的υc=0峰和930~900 cm-1处的D-吡喃葡萄糖环振动峰。多糖样品出现的特征峰与其基本一致,由此证实该多糖为普鲁兰多糖[4]。
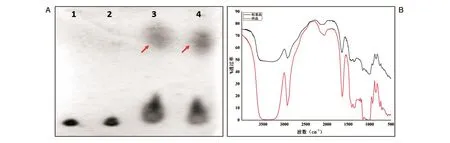
图3 多糖结构分析
3 讨论
优化发酵培养基组成和发酵工艺条件是提高普鲁兰多糖产量、降低生产成本的主要途径,也是挖掘菌株生产能力、开发其价值的重要手段。我们在确定氮源和无机盐单因素对RM1603产糖影响的基础上,采取正交试验分析确定优化后的高产糖培养基和最佳发酵条件,使得RM1603的多糖产量从28.91提高至65.213 g/L,提高了约2.3倍,与文献报道的100多株出芽短梗霉的普鲁兰糖产量相比,处于十分靠前的位置[7]。通常出芽短梗霉在发酵产胞外多糖过程中会产生一定量的黑色素,对普鲁兰多糖的产量和提取都有一定影响[5]。然而RM1603菌株在最佳发酵时间96 h内,表观未见黑色素产生,发酵液仍然呈乳白色,随着发酵时间的延长,发酵液颜色渐变为淡黄色,132 h后发酵液由淡黄色渐变为深黄色,且其黏稠度明显降低,可能与普鲁兰多糖代谢、重油代谢及黑色素代谢等存在偶联关系[18];薄层层析、红外光谱分析检测RM1603菌株所产多糖的结构,与标准普鲁兰多糖对比结果一致,这与文献报道普鲁兰多糖结果相似[8,14],RM1603所产胞外多糖为普鲁兰多糖。因此,RM1603具有较强的产多糖能力,发酵性状优良,是一株极具开发价值的出芽短梗霉新菌株。本研究也为从自然界中筛选高产普鲁兰多糖新菌株提供了参考。

