Fe(VI)/CaO2双氧化体系降解水环境中的DMP
朱峥嵘,王明新,张金永,叶 倩,周 杰
Fe(VI)/CaO2双氧化体系降解水环境中的DMP
朱峥嵘,王明新*,张金永,叶 倩,周 杰
(常州大学环境与安全工程学院,常州 213164)
研究了高铁酸盐(Fe(VI))/过氧化钙(CaO2)联合处理对邻苯二甲酸二甲酯(DMP)的降解性能及机理,分析了共存离子的影响.基于响应面方法中的Box-Behnken实验设计进行了多因素实验,采用二次多项式和逐步回归法拟合了DMP去除率与Fe(VI)投加量、CaO2投加量和反应时间之间的关系,对实验条件进行了优化分析.结果表明,在初始pH值为中性条件下,Fe(VI)/CaO2可以有效去除DMP,降解过程符合准一级动力学模型.当Fe(VI)/CaO2/DMP物质的量比为1.1/4.4/1时,模型预测DMP最大降解率为95.57%,和验证实验得出的降解率90.14%相近,表明该响应面模型具有较好的模拟和预测能力.HCO3-和Mg2+对DMP的降解有一定抑制作用.自由基清除实验结果显示,羟基自由基(HO·)和超氧自由基(O2-·)对DMP的降解具有重要贡献,表明Fe(VI)和CaO2可形成类芬顿试剂协同降解污染物.DMP的主要降解途径包括酯基水解、侧链氧化和苯环的羟基化;主要降解产物为邻苯二甲酸单甲酯,2,5-二羟基苯甲酸,间苯二甲酸,草酸等.
高铁酸盐;过氧化钙;邻苯二甲酸二甲酯;响应面法;降解机制
邻苯二甲酸酯(PAEs)是一种广泛使用的增塑剂,主要用于提高塑料的可塑性和柔韧性[1-3].PAEs具有潜在的内分泌干扰效应,对内分泌系统的激素活性有一定的抑制作用[4-5].邻苯二甲酸二甲酯(DMP)是最常见的一种PAEs,水环境中的半衰期约为3.2a[6].据报道,在各类水体、土壤和大气中均检测到DMP[7-8].DMP易在环境中累积和富集,对人类健康和生态系统造成了潜在的威胁[9],已引起越来越广泛的关注.
生物降解法可以有效地去除水环境中的DMP[10],但降解速率较慢,且在实际应用中受到诸多环境因素,如温度、溶解氧和pH值的限制.化学氧化技术具有反应速率高、能够有效地去除大多数有机污染物等特点,大量应用于污染场地的修复[11-12].其中,芬顿和类芬顿反应的高氧化性能受到广泛关注.芬顿反应通过Fe2+催化过氧化氢(H2O2)产生羟基自由基(HO·)氧化污染物,HO·具有极强的氧化性,可以氧化多种有机和无机污染物[13-14].然而,在地下环境中液体H2O2的不稳定性使得Fenton反应在污染场地修复中的应用受到限制[15].研究表明,过氧化钙(CaO2)可以作为H2O2的固体来源,1g CaO2最多可以生成 0.47g H2O2,具有较强的氧化能力[16]. CaO2是一种环境友好型氧化剂,在污染物降解过程中不会对环境造成污染,而且还能刺激微生物生长,从而提高生物修复效率.Qian等[17]在研究石油烃类污染物时发现,pH6时,CaO2可以在3d内有效去除甲苯及其中间体.Qian等[18]研究表明,CaO2在5d内可完全降解2,4-二氯苯酚,主要的降解产物为苯酚,2-氯酚和4-氯酚.Arienzo[19]在研究CaO2降解水和土壤中的2,4,6-三硝基甲苯时发现,CaO2对TNT污染土壤的原位修复具有良好的效果.
在过去10a中,基于CaO2的类芬顿技术广泛应用于地下水修复[20],但也存在一些问题,如单独使用CaO2去除难降解有机污染物的速度相对较慢、Fe(Ⅱ)和Fe(Ⅲ)在循环转化过程中容易累积形成氢氧化物,导致降解速率下降等.因此许多学者在类芬顿反应体系中利用零价铁、针铁矿、赤铁矿等作为替代铁源[21-25],或者通过添加柠檬酸、草酸、谷氨酸等螯合剂螯合Fe(Ⅱ)和Fe(Ⅲ),避免其在中性或碱性条件下沉淀[26-28].高铁酸钾(Fe(VI))是一种高效的绿色氧化剂,集絮凝、氧化、消毒杀菌作用为一体,在氧化过程中生成的氢氧化铁通常为纳米级颗粒,具有较好的絮凝作用,可同时吸附多种有机污染物,广泛应用于有机污染物的去除[29].Yang等[30]研究发现,Fe(VI)在弱碱性条件下可以有效去除羟基化的二苯甲酮衍生物二苯酮-3,主要的降解产物为4-甲氧基二苯甲酮和4-甲氧基苯甲酰阳离子.Chen等[31]研究表明,pH为8.0时,Fe(VI)可在240秒内快速去除五氯二苯基硫化物.
Fe(VI)具有较高的反应速率,CaO2则是缓释氧化剂,两者在水溶液中均呈碱性,可以较好共存.构建Fe(VI)/CaO2双氧化体系,在发挥各自氧化效能的同时,可充分利用Fe(VI)分解产生的Fe(Ⅱ)或Fe(Ⅲ)催化CaO2分解产生的H2O2,形成类芬顿试剂,进一步提高其降解能力.因此,本研究以DMP为目标污染物,研究Fe(VI)和CaO2单独和联合处理对DMP的降解性能及机理,通过响应面法优化实验设计,确定最佳反应条件;拟合降解动力学模型,鉴别主要活性物质;确定降解产物,推断降解路径,旨在为DMP污染水环境的修复提供参考.
1 材料和方法
1.1 实验试剂
分析纯DMP,硝酸钠,硫酸钠,碳酸氢钠,氯化镁,氢氧化钠,氯化钾,亚硫酸钠,异丙醇,硫酸,盐酸,乙酸,乙酸钠,邻菲罗啉,盐酸羟胺和硫酸亚铁铵购自Sinopharm Chemical Reagents公司(中国上海).Fe(VI)购自MACKLIN Reagent公司(中国上海).甲醇和乙腈(HPLC级)购自Merck(Darmstadt,Germany)公司.CaO2、甲基叔丁基醚(GC级),GC衍生化试剂六甲基二硅氮烷和三甲基氯硅烷购自Aladdin Reagent公司(中国上海).实验用水由Milli-Q水纯化系统制取超纯水.
1.2 实验设计
Fe(VI)与CaO2联合处理实验在恒温振荡器中进行.在100mL反应溶液中加入不同剂量的Fe(VI)和CaO2,反应开始后动态取样检测.取1.00mL DMP样品到含有200μL亚硫酸钠(0.10mol/L)的色谱小瓶中,用于HPLC检测.在Fe(VI)和CaO2不同投加量下分别测量水溶液中二价和三价铁离子,pH值和h的变化.二价和三价铁离子采用邻二氮菲分光光度法测量.
自由基清除实验:在100mL反应溶液中加入Fe(VI)/CaO2/DMP物质的量比为2/5/1的Fe(VI)和CaO2作为对照,另外2组实验中分别再加入一定剂量的异丙醇和苯醌,反应开始后动态取样检测DMP.
所有样品使用0.45μm滤膜过滤,取2次平行样平均值作为当前DMP浓度,以计算反应速率.
1.3 响应面法实验设计

表1 实验自变量因素的编码水平
采用Box-Behnken模型设计正交实验[32],选取Fe(VI)投加量(1)、CaO2投加量(2)和反应时间(3)为3个主要因素,并以+1,0,-1分别代表自变量的高、中、低3因素水平,响应值为DMP的降解率.实验设计结果如表1所示.
1.4 鉴定降解产物
Fe(VI)和CaO2联合处理时投加量物质的量比2/2、2/5、5/2、0/5,反应12h.取1.0mL样品通过真空冷冻干燥浓缩,残余物溶于4mL甲基叔丁基醚(MTBE)中,然后在70℃下用0.2mL六甲基二硅氮烷和0.1mL三甲基氯硅烷衍生化30min,经0.45μm滤膜过滤后进样检测[33].GC/MS用于分析中间产物.
1.5 分析方法
DMP采用高效液相色谱仪(LC-20AT,日本岛津公司)分析.色谱柱:C18反相柱(SinChrom ODS-BP (5μm,4.6mm×250mm)).流动相:水/乙腈=25/75(体积比),流速:1.0mL/min.进样体积:20μL,检测波长: 225nm.
降解产物用Thermo Trace 1300GC-MS检测,色谱柱:TG-5MS.采用GC-MS系统(TSQ Quantum XLS Ultra TM,Thermo Scientific,USA)分析数据[21].载气:氮气;流速:1mL/min.进样口温度:280℃.升温程序:在80℃下保持3min,以30℃/min升温至120℃,再以18℃/min升温至140℃,再以30℃/min升温至210℃,再以30℃/min升温至250℃,最后在250℃保持1min.
2 结果与讨论
2.1 Fe(VI)和CaO2联合降解DMP的影响因素
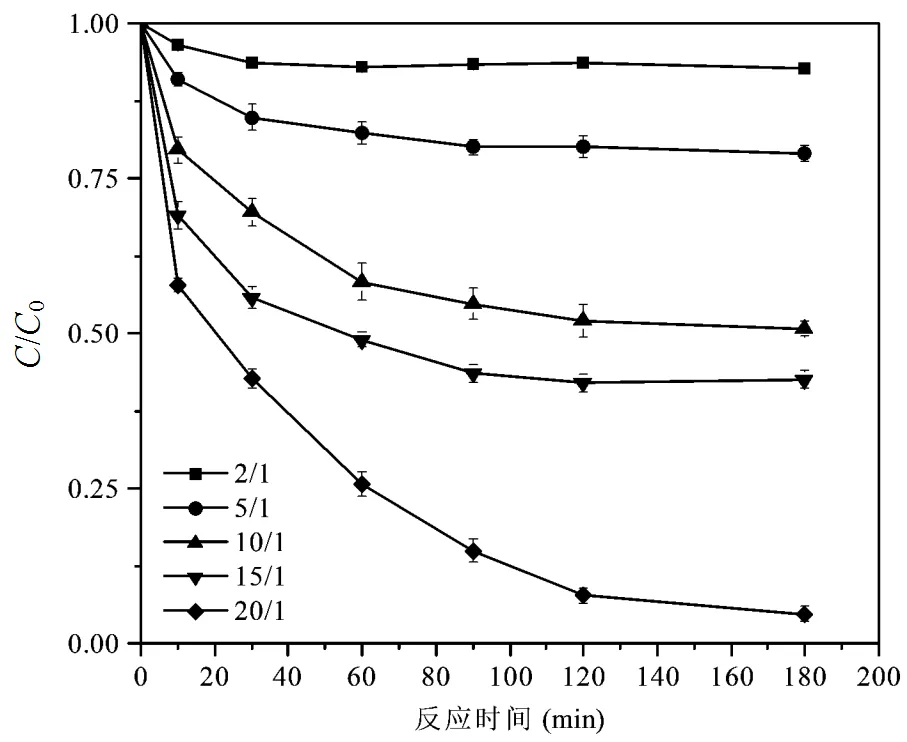
图1 单独Fe(VI)对DMP的去除
2.1.1 Fe(VI)和CaO2单独处理对DMP的降解效果 图1显示了DMP降解效率随反应时间和Fe(VI)投加量的变化,反应结束时间为3h.当Fe(VI)的投加量(Fe(VI):DMP的物质的量比)从2:1增加到20:1时,反应开始10min到90min时,DMP的去除效率从7.1%增加到74.3%.单独CaO2对DMP的降解效果如图2所示,反应结束时间为12h.随着CaO2投加量(CaO2:DMP的物质的量比)从2:1增加到5:1时,反应结束后DMP的去除效率从49.2%增加到83.7%.随着CaO2投加量的进一步增加,DMP得到进一步去除.表明单一Fe(VI)体系或者单一CaO2体系可以有效地去除DMP,但是需要消耗大量的氧化剂以及反应时间.
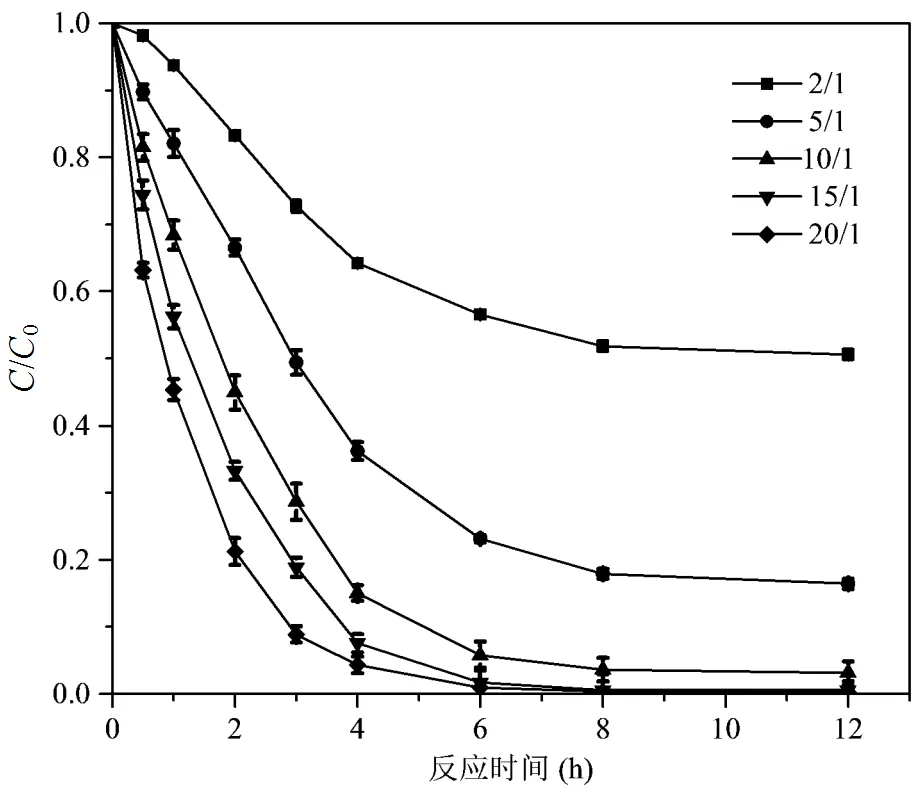
图2 单独CaO2对DMP的去除
2.1.2 Fe(VI)和CaO2联合对DMP的降解效果 不同投加量的Fe(VI)和CaO2对DMP的降解效果如图3所示, 反应结束时间为12h.就单独Fe(VI)投加量(Fe(VI):DMP的物质的量比)为2:1而言,反应结束后DMP的去除率为7.3%;单独CaO2投加量(CaO2: DMP的物质的量比)分别为2:1和5:1时,反应结束后DMP的去除率分别为49.2%和83.7%;而Fe(VI)和CaO2联合降解DMP(Fe(VI)/CaO2/DMP的物质的量比为2/5/1)时,DMP的去除率为99.5%.表明单独Fe(VI)体系中,低剂量的Fe(VI)无法有效去除DMP;单独CaO2体系中,CaO2通过分解产生H2O2破坏DMP分子的化学键,而H2O2的氧化还原电位为1.77V较低,导致无法完全去除污染物及其中间体;此外,CaO2产生的超氧自由基存活时间短和CaO2本身的缓释性进一步限制了对DMP的降解效率. Fe(VI)和CaO2在降解DMP过程中存在协同效应,CaO2分解释放的H2O2与Fe(VI)的还原产物Fe(II)和Fe(III)迅速反应,生成氧化还原电位较高的羟基自由基,可以提高污染物的去除率.DMP的快速降解主要发生时前6h,在接下来的6h内反应速率较慢.推测当Fe(VI)和CaO2投加到反应溶液中,首先发生剧烈的氧化反应,在这一过程中,Fe(VI)被还原成Fe(II)和Fe(III),同时CaO2分解产生H2O2形成芬顿反应,进一步降解污染物.但是,随着反应的继续进行,溶液中Ca(OH)2逐渐累积,Fe(II)和Fe(III)形成氢氧化物沉淀,Fe(II)和Fe(III)再循环受到抑制,从而减缓了反应速率.

图3 Fe(VI)和CaO2联合处理对DMP的降解效果
在不同的Fe(VI)和CaO2投加量条件下,拟合了DMP的降解动力学曲线.DMP的降解遵循准一级动力学模型,实验数据具有良好线性拟合(2=0.99),准一级速率常数(app)计算方法如下:
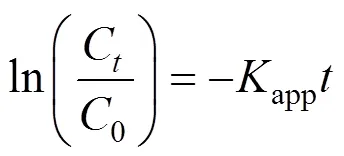
式中:C是时刻(min)的DMP浓度,0是DMP初始浓度,app是准一级动力学常数,是反应时间.
如图4所示,当Fe(VI)投加量(Fe(VI):DMP的物质的量比)为5:1,CaO2投加量(CaO2:DMP的物质的量比)从0.5:1逐渐增加到5:1时,app从0.05369h-1增加到0.21063h-1.随着CaO2投加量的增加,DMP的去除率和反应速率显著增加.提高CaO2的用量可以产生更多的H2O2,从而提高芬顿反应的效率,加快污染物的降解.当CaO2投加量(CaO2:DMP的物质的量比)为2:1,Fe(VI)投加量(Fe(VI):DMP的物质的量比)从2:1逐渐增加到5:1时,app从0.06821h-1增加到0.12267h-1;当CaO2投加量(CaO2:DMP的物质的量比)为5:1,Fe(VI)投加量(Fe(VI):DMP的物质的量比)从2:1逐渐增加到5:1时,app从0.19432h-1增加到0.21063h-1.CaO2投加量较低时,随着Fe(VI)投加量的增加,DMP的去除率和反应速率大幅上升,提高Fe(VI)的用量可以加快催化H2O2从而反应速率; CaO2投加量较高时,继续增加Fe(VI)的用量对反应速率的影响不大,可能是因为CaO2浓度高时,反应体系的pH值较高,Fe(VI)易产生Fe (OH)3,从而影响Fe(II)和Fe(III)的循环转化,导致反应速率变化不大.
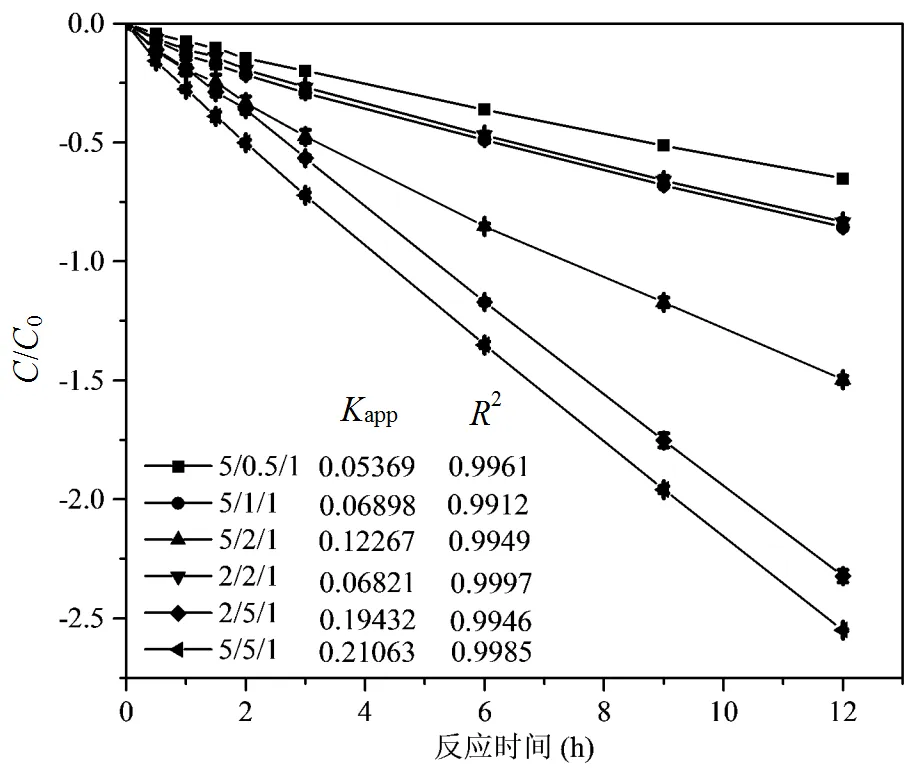
图4 Fe(VI)和CaO2联合降解DMP动力学
2.2 响应面分析
2.2.1 模型拟合 采用3因素3水平实验设计, Box-Behnken响应面优化实验设计实验结果和预测值见表2.
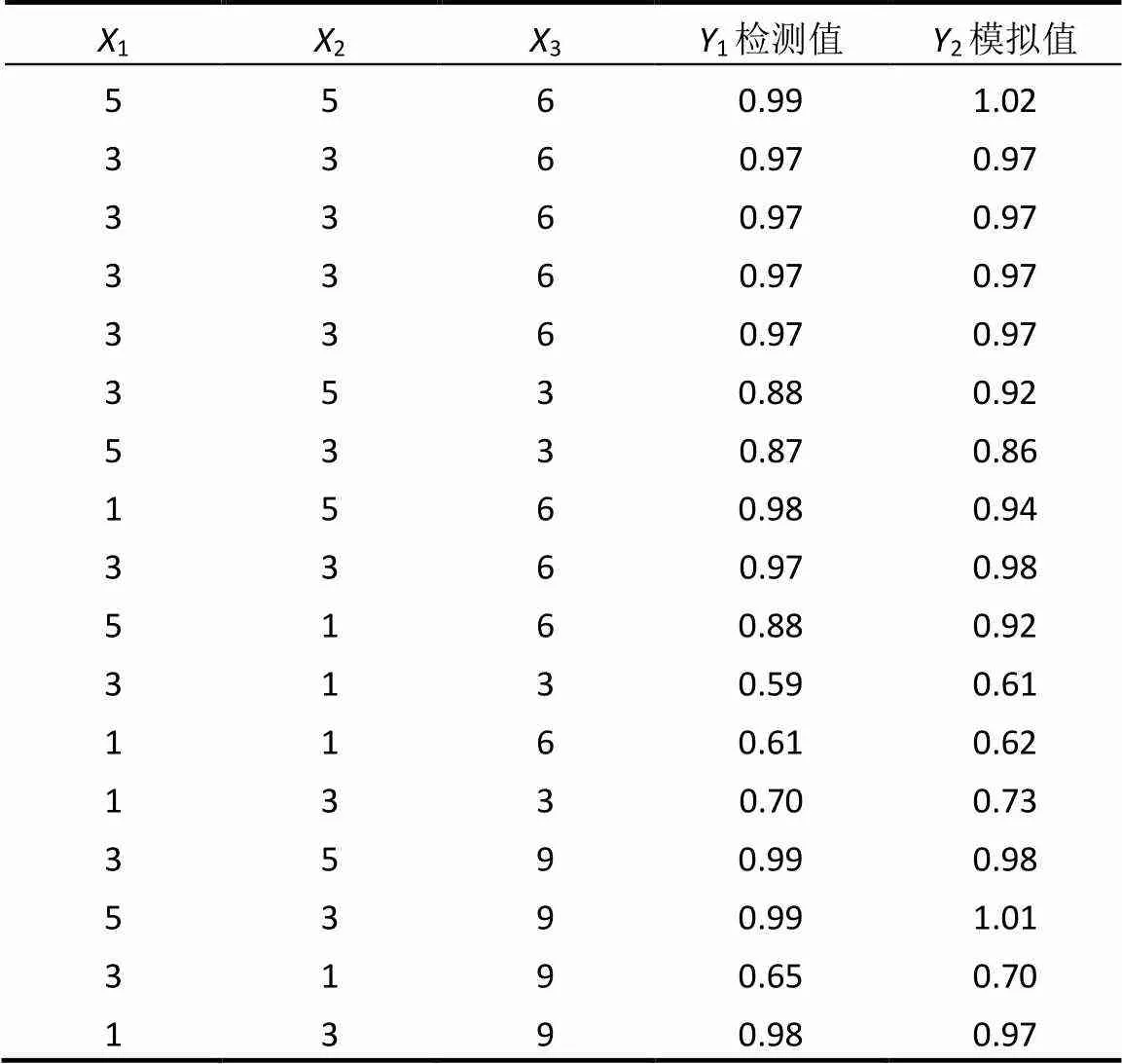
表2 RSM实验设计与结果
采用软件Design-Experts8.0.5对拟合结果进行方差分析,利用值对每个因素进行显著性检测,值<0.05说明回归模型显著[34-35].拟合得到如式(2)所示的二次多项式模型:
=-0.254+0.1101+0.2622+0.1493-0.01612-
6.450×10-313+2.353×10-323+1.083×10-312-
0.026×10-322-9.496×10-332(2)
式中:为响应值,代表DMP的降解率,1、2、3分代表Fe(VI)投加量、CaO2投加量和反应时间.式中正项系数表示增加此因素值会提高响应值;反之,负项系数表示增加此因素值会降低响应值[32].模型决定系数2为0.9679,证明独立变量之间的相关性较好,该模型可用于实际预测.3个因素的值均小于0.05,表明这3个因素对响应值影响极为显著; AB、AC、BC的值均小于0.05,表明其两两因素的交互作用显著.
为获得DMP去除率最大值的优化条件,设定优化目标为去除率最高,约束条件为Fe(VI)投加量、CaO2投加量和反应时间在本实验设定的取值范围内,得到的最优反应条件为:Fe(VI)/CaO2/DMP(物质的量比)为1.1/4.4/1时,模型预测的污染物降解率为95.57%,和实验得出的降解率94.14%数值接近,表明拟合方程具有较高的精确度.
2.2.2 响应曲面分析 图5显示了Fe(VI)投加量和CaO2投加量两个因素的交互影响.对应的等高线图呈现椭圆形趋势,说明两个因素存在交互效应[34].响应值随着Fe(VI)和CaO2投加量的增加而增加.在投加量较小时,等高线斜率较高、响应值变化较大.当继续增加投加量时,等高线逐渐变平.这说明在反映初始阶段,污染物浓度较高,氧化剂与污染物接触效率高,降解速率较快.Fe(VI)在氧化目标污染物时自身分解产生Fe(II)和Fe(III),进一步活化CaO2产生的H2O2生成HO·,而且HO·可以进一步与H2O2反应产生O2-·,从而提高了降解效率.
HO·+H2O2→HO2·+ H2O (3)
HO2·«O2-·+H+(4)
图6显示了Fe(VI)投加量和反应时间2个因素的交互影响.对应的等高线图呈现椭圆形,说明两个因素交互效应明显.当Fe(VI)投加量一定时,随着反应时间的增加,响应值先增高后趋于平缓并有降低趋势.Fe(VI)在降解污染物过程中,Fe(III)易形成氢氧化物沉淀,Fe(II)和Fe(III)的再生循环受到限制.同时,Fe(II)也会捕捉反应溶液中的HO·使活性物质降低(方程(5)),从而抑制降解速率[34].
HO·+ Fe2+→Fe3++ HO-(5)
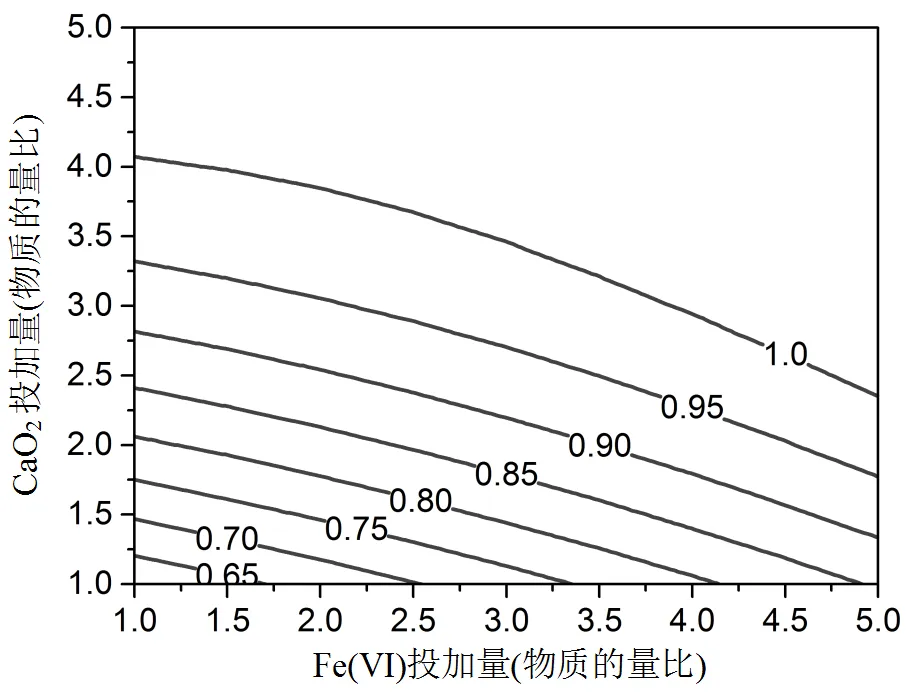
图5 Fe(VI)和CaO2投加量对DMP去除率的影响
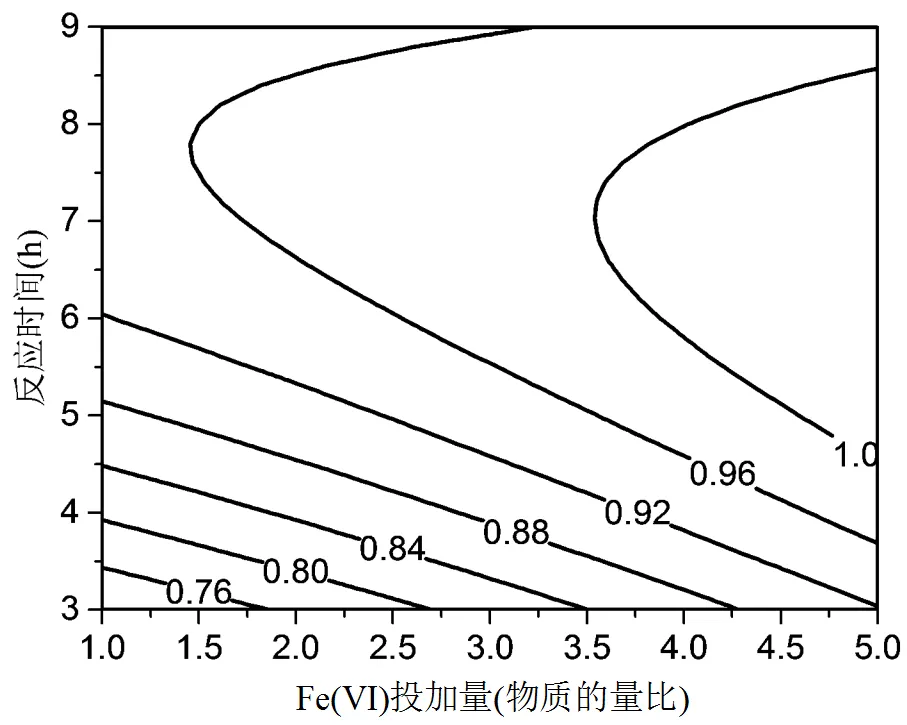
图6 Fe(VI)投加量和反应时间对DMP去除率的影响
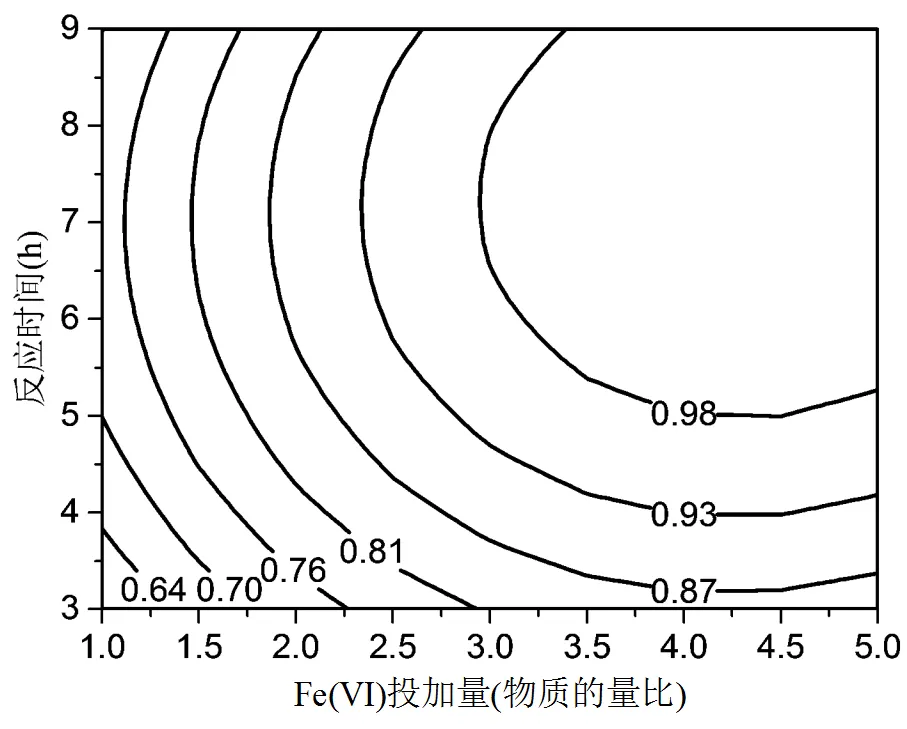
图7 CaO2投加量和反应时间对DMP去除率的影响
图7显示了CaO2投加量和反应时间的交互作用.对应的等高线图呈现椭圆形,说明两个因素交互效应明显.响应值随着CaO2投加量的增加而增加,并随着时间的延长趋于平缓.CaO2在释放H2O2过程中生成Ca(OH)2,在碱性体系中,H2O2的释放速率降低而O2的释放速率上升,导致整个反应体系的降解速率下降[36].此外,随着反应时间的推进,溶液中H2O2也会捕捉HO·并与之反应[37].因此,过量投加CaO2和延长反应时间对于进一步提高DMP降解速率的作用较小.
2.3 自由基对DMP降解的影响
如前所述,Fe(VI)/CaO2双氧化体系中可能产生的自由基主要是HO·和O2-,实验采用异丙醇和苯醌作为探针化合物特异性结合HO·和O2-.Tang等[36]研究Fe(II)/CaO2体系降解四氯化碳的结果表明,O2-·在污染物降解过程中占主导作用.Lewis等[20]在利用螯合剂改性芬顿试剂降解三氯乙烯(TCE)过程中,发现HO·是主要的功能自由基.Zhang等[38]在研究异丙醇对HO·的掩蔽作用时发现,向反应溶液添加30mmol/L的异丙醇时,TCE的降解受到大幅度抑制.如图8所示,向反应溶液中添加异丙醇和苯醌后,DMP的降解速率受到抑制,且在Fe(VI)/CaO2双氧化体系降解DMP的过程中,HO·的贡献大于O2-·.
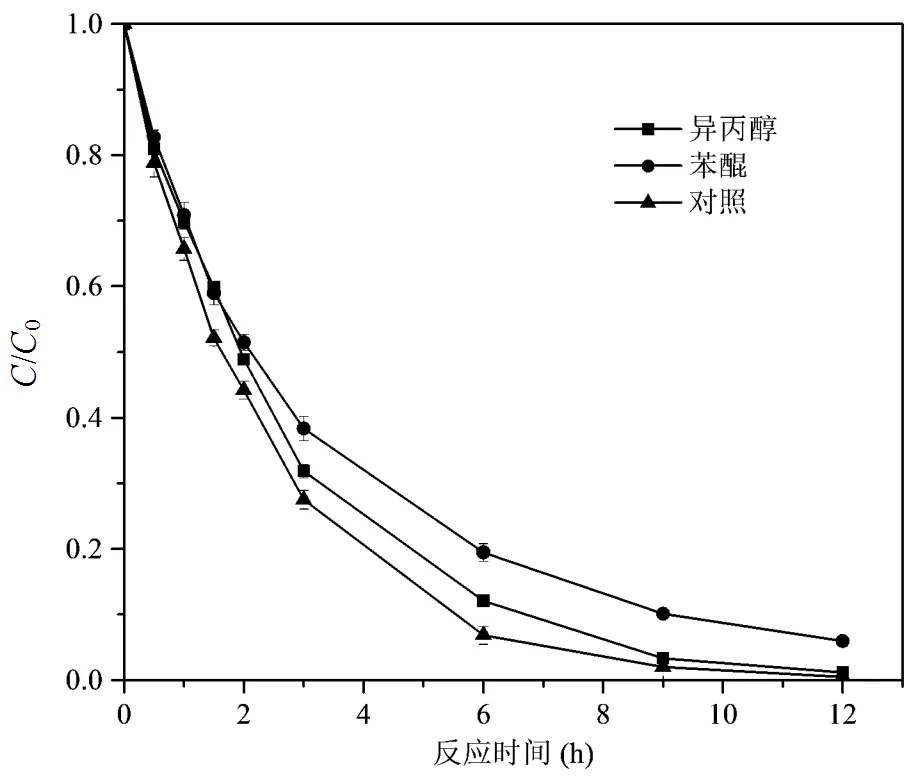
图8 自由基对DMP降解的影响
2.4 共存离子对DMP降解的影响
在天然地下水中,DMP的去除效率会受到一些金属离子和无机阴离子的影响.K+,Mg2+,HCO3-, SO42-和 NO3-离子对DMP去除效果的影响如图9所示.其中,Mg2+和HCO3-离子的抑制作用较为明显;K+,SO42-和 NO3-离子表现出轻微的促进作用.
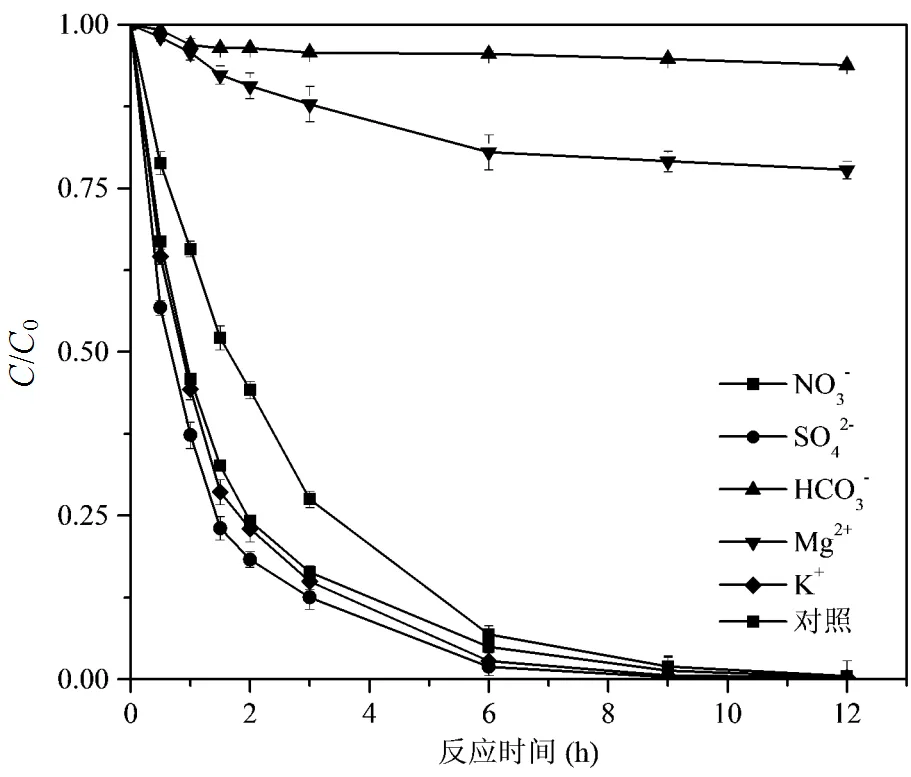
图9 共存离子对DMP降解的影响
HCO3-离子是地下最常见的一种离子,不同地区水环境中的HCO3-离子含量从几十到几百´10-6,它对HO×具有一定的猝灭作用(方程(6~8))[39].Mg2+在反应溶液中易形成氢氧化物附着在Fe(VI)表面,从而抑制降解速率(方程(9)).添加K+可以加速DMP的去质子化,从而促进DMP的降解.水环境中的NO3-离子含量在10-5~10-3mg/L,在有机物降解过程中可以充当光敏剂促进反应速率[40].Qian等[18]在研究纳米级CaO2降解2,4-二氯苯酚时也发现向反应溶液中添加适量的SO42-可以促进自由基对目标污染物的降解,这与本实验结论相一致.
HO· + HCO3-→CO3·-+ H2O (6)
O2-· + O2-·→HO2-+ CO3·-(7)
CO3·-+ O2-·→CO32-+ O2(8)
Mg2++ 2HO·→2OH-+ Mg2+→Mg(OH)2(9)
2.5 DMP降解过程中铁离子、pH值及Eh变化
Fe(VI)/CaO2/DMP物质的量比为2/5/1条件下,DMP降解过程中铁离子浓度的变化如图10所示;pH值及Eh变化如图11所示.
随着反应时间的增加,Fe2+的含量先上升后下降,Fe3+的含量缓慢增加后趋于稳定.随着反应不断进行,溶液中H2O2含量增加,Fe(VI)被还原成Fe2+和Fe3+.Fe2+不断催化H2O2产生HO•,自身被氧化为Fe3+,由于溶液呈碱性,Fe3+容易沉淀形成纳米级絮状Fe(OH)3.
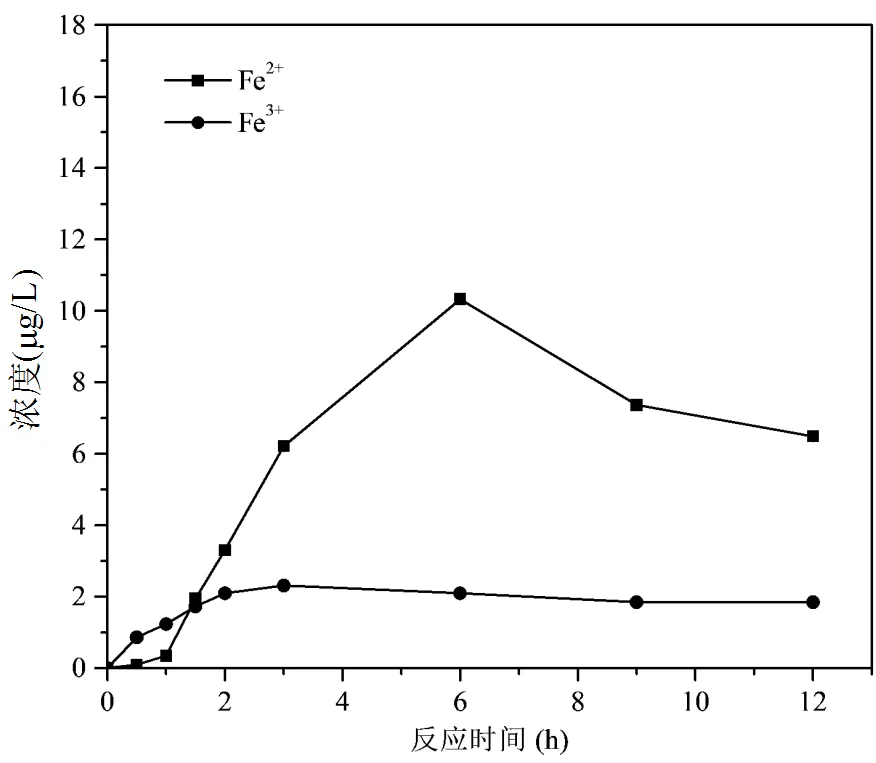
图10 DMP降解过程中铁离子浓度变化
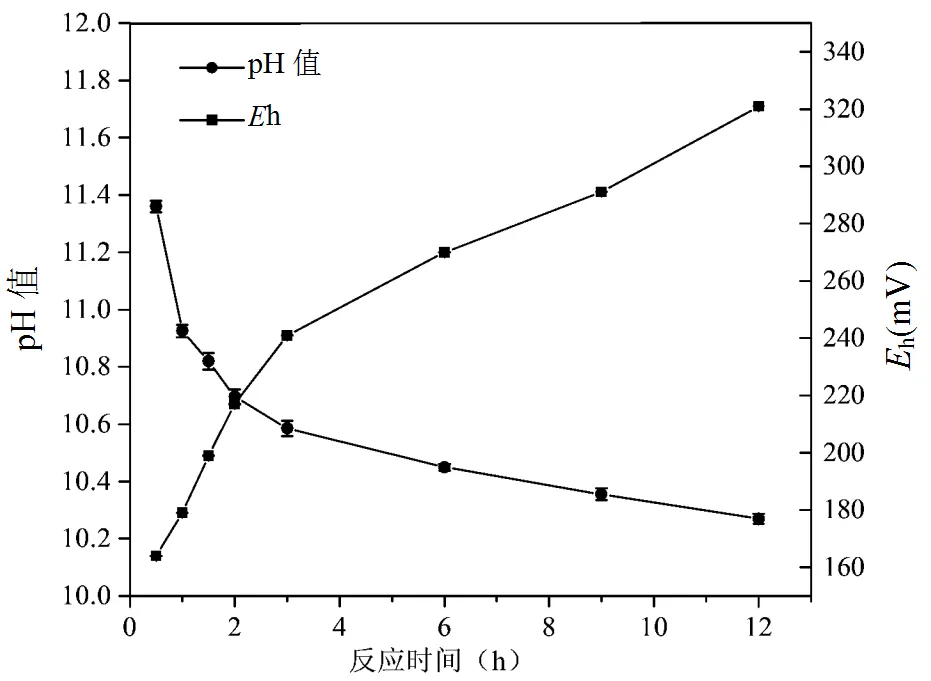
图11 DMP降解过程中pH值及Eh变化
图11显示,溶液pH值随着反应时间的增加逐渐降低,这归因于DMP的几种中间产物,包括邻苯二甲酸、间苯二甲酸和草酸等.h则随着反应的推进呈上升趋势,但由于受pH值的影响,相对较低[41].
2.6 中间产物和降解途径
通过GC/MS分析,检测到的主要中间产物包括邻苯二甲酸单甲酯,2,5-二羟基苯甲酸,间苯二甲酸和草酸等.图12为不同氧化剂投加量下DMP的主要中间产物的演变.随着氧化剂投加量的增加,DMP逐渐被降解为毒性较低的小分子,最终被氧化成二氧化碳和水.
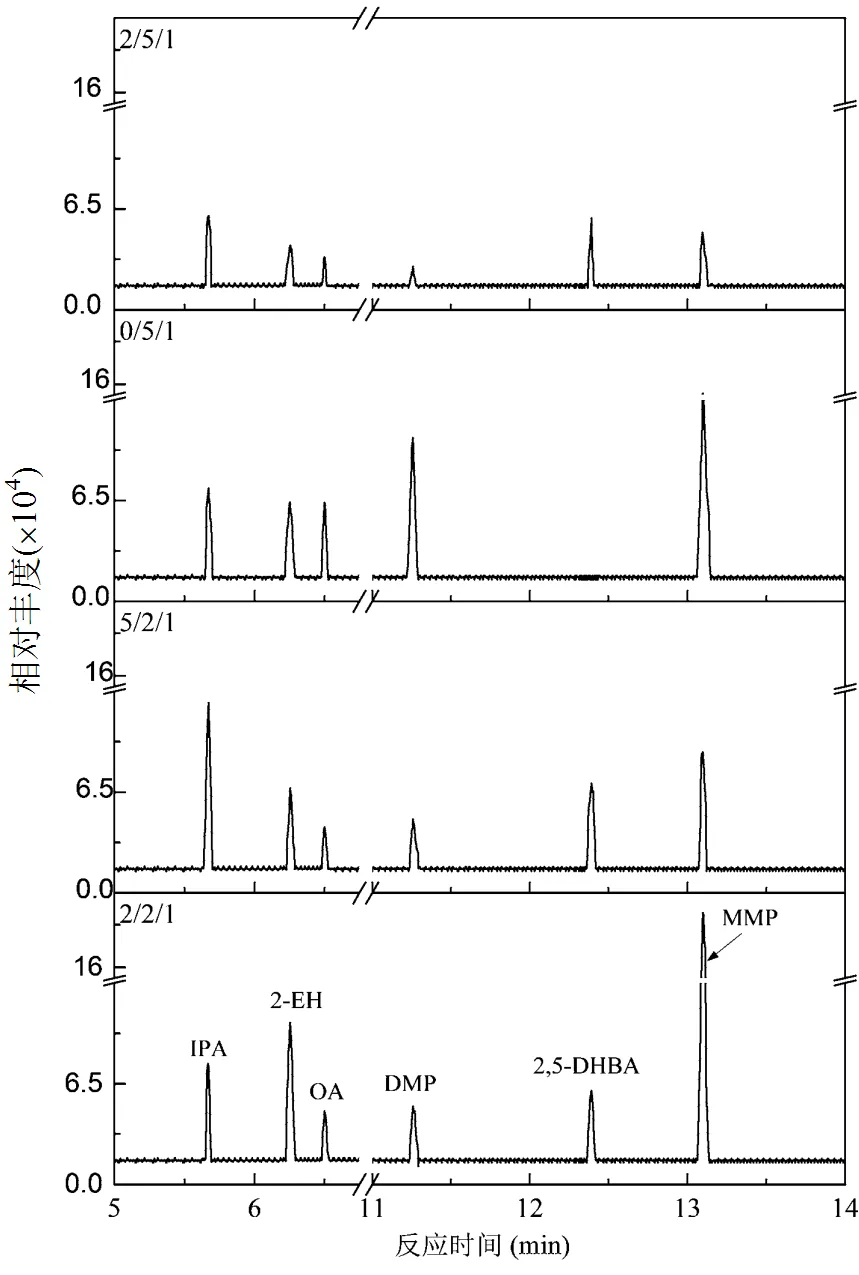
图12 不同氧化剂投加量下DMP的降解产物变化
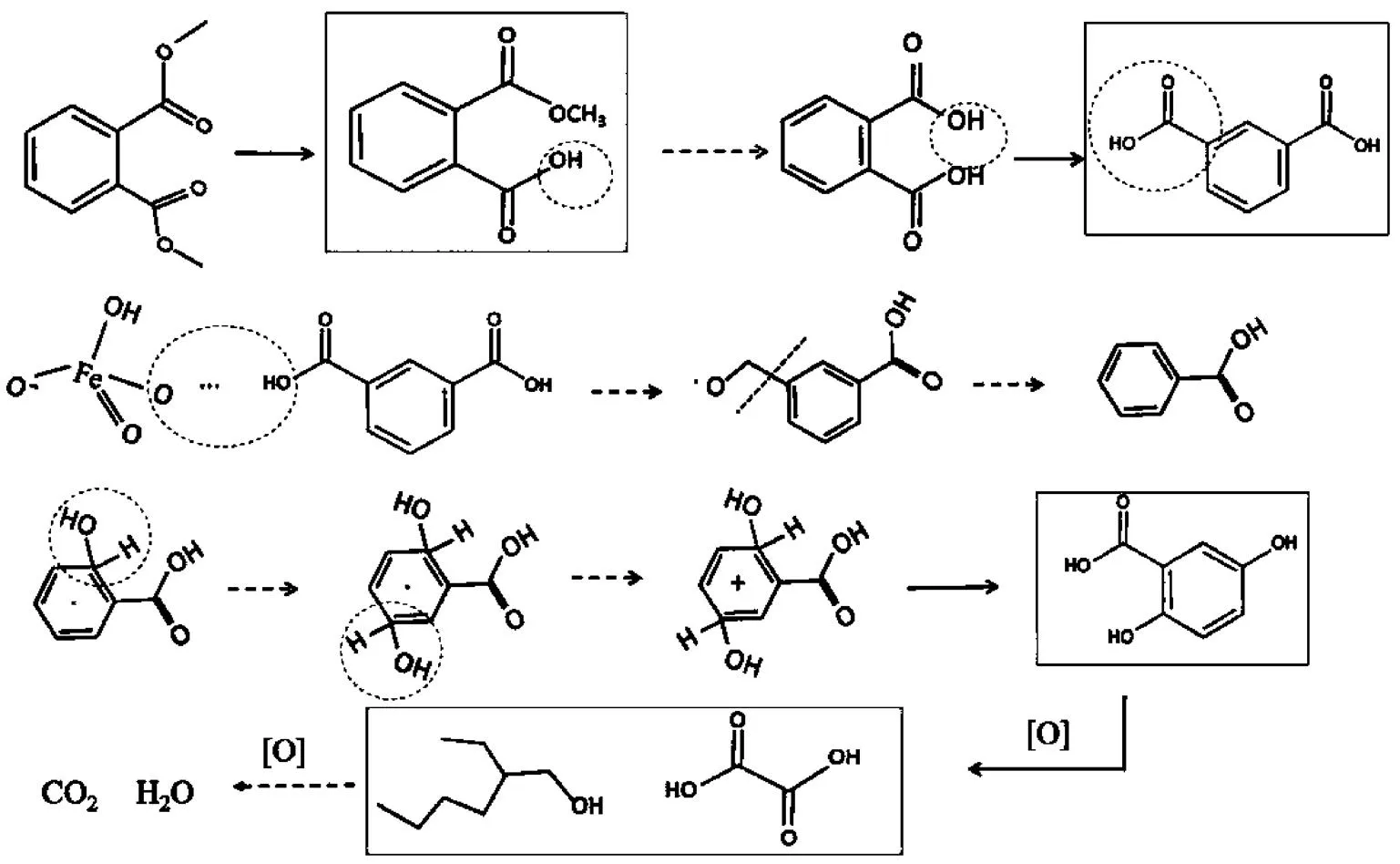
图13 Fe(VI)/CaO2体系中DMP降解路径推测
基于产物鉴定和自由基清扫实验,提出了DMP可能的降解路径,包括酯基水解、Fe(VI)的亲电氧化效应及单电子耦合机制、自由基(HO·和O2-·)攻击苯环和碳链.如图13所示,首先,DMP在碱性溶液中先水解生成邻苯二甲酸单甲酯(MMP),进一步水解生成邻苯二甲酸并异构化成形式更稳定的间苯二甲酸(IPA);然后,Fe(VI)通过缔合反应与活化的间苯二甲酸形成氢键,经历电子转移过程破坏碳氧键生成中间体苯甲酸;进一步,反应溶液中的HO·和O2-·继续攻击羧基邻位和间位的碳原子发生加成反应,生成中间体2,5-二羟基苯甲酸(2,5-DHBA);Fe(VI)和2种自由基按照上述方式继续攻击苯环和碳链,进一步降解成小分子有机物,最终矿化成CO2和H2O.
3 结论
3.1 Fe(VI)/CaO2体系在氧化污染物的同时形成类芬顿试剂联合降解污染物,并且联合降解效果优于单独降解效果.
3.2 DMP的去除效果取决于Fe(VI)投加量、CaO2投加量、反应时间和共存离子等因素.DMP的降解符合准一级动力学模型.通过响应面法优化降解参数,最优投加量Fe(VI)/CaO2/DMP物质的量比为1.1/ 4.4/1、溶液初始pH为中性条件下,DMP去除率达到90%以上.
3.3 基于自由基清扫实验和中间产物鉴定,提出可能的降解机制包括酯基水解、Fe(VI)的亲电氧化效应及单电子耦合机制、自由基(HO·和O2-·)攻击苯环和碳链.在中性pH值和室温下,Fe(VI)/CaO2体系对DMP污染水环境具有很大的修复潜力.
[1] 李 彬,吴 山,梁金明,等.中山市农业区域土壤-农产品中邻苯二甲酸酯(PAEs)污染特征 [J]. 环境科学, 2015,36(6):2283-2291. Li B, Wu S, Liang J M, et al. Characteristics of phthalic Acid esters in agricultural soils and products in areas of Zhongshan City, outh China [J]. Environmental Science, 2015,36(6):2283-2291.
[2] Chao W L, Lin C M, Shiung I I, et al. Degradation of di-butyl- phthalate by soil bacteria [J]. Chemosphere, 2006,63(8):1377-1383.
[3] 贺 涛,白小舰,陈 隽,等.饮用水源地塑化剂类污染物环境健康风险评估[J]. 中国环境科学, 2013,33(S1):26-31. He T, Bai X J, Chen J, et al. Environmental health risk assessment of plasticizer contaminants in drinking water source [J]. China Environmental Science, 2013,33(S1):26-31.
[4] Benjamin S, Masai E, Kamimura N, et al. Phthalates impact human health: Epidemiological evidences and plausible mechanism of action [J]. Journal of Hazardous Materials, 2017,340:360-383.
[5] 王夫美,陈 丽,焦 姣,等.住宅室内降尘中邻苯二甲酸酯污染特征及暴露评价 [J]. 中国环境科学, 2012,32(5):780-786. Wang F M, Chen L J J, et al. Pollution characteristics of phthalate esters derived from household dust and exposure assessment [J]. China Environmental Science, 2012,32(5):780-786.
[6] Huygh J, Clotman K, Malarvannan G, et al. Considerable exposure to the endocrine disrupting chemicals phthalates and bisphenol-A in intensive care unit (ICU) patients [J]. Environment International, 2015, 81:64-72.
[7] 杜 娴,罗固源,许晓毅.长江重庆段两江水相、间隙水和沉积物中邻苯二甲酸酯的分布与分配[J]. 环境科学学报, 2013,33(2):557-562. Du X, Luo G Y, Xu X X, et al. Distribution and partition of phthalate esters in water phase,ore water andsediments from Chongqing section of the Yangtze River [J]. Acta Scientiae Circumstantiae.
[8] Zhang T, Huang Z, Chen X, et al. Degradation behavior of dimethyl phthalate in an anaerobic/anoxic/oxic system [J]. Journal of Environmental Management, 2016,184:281-288.
[9] Shi J, Li F, Yin D, et al. Sorption and degradation of phthalate esters by a novel functional hyper-cross-linked polymer [J]. Chemosphere, 2017,171:149-157.
[10] Zhang J, Zhang C, Zhu Y, et al. Biodegradation of seven phthalate esters by Bacillus mojavensis B1811 [J]. International Biodeterioration & Biodegradation, 2018,132:200-207.
[11] Usman M, Hanna K, Faure P. Remediation of oil-contaminated harbor sediments by chemical oxidation [J]. Science of The Total Environment, 2018,634:1100-1107.
[12] Watts R J, Ahmad M, Hohner A K, et al. Persulfate activation by glucose for in situ chemical oxidation [J]. Water Research, 2018,133: 247-254.
[13] Vorontsov A V. Advancing Fenton and photo-Fenton water treatment through the catalyst design [J]. Journal of Hazardous Materials, 2018.
[14] Liu X, Zhou Y, Zhang J, et al. Insight into electro-Fenton and photo- Fenton for the degradation of antibiotics: Mechanism study and research gaps [J]. Chemical Engineering Journal, 2018,347:379-397.
[15] Quadrado R F N, Fajardo A R. Fast decolorization of azo methyl orange via heterogeneous Fenton and Fenton-like reactions using alginate-Fe2+/Fe3+films as catalysts [J]. Carbohydrate Polymers, 2017,177:443-450.
[16] Xue Y, Rajic L, Chen L, et al. Electrolytic control of hydrogen peroxide release from calcium peroxide in aqueous solution [J]. Electrochemistry Communications, 2018,93:81-85.
[17] Qian Y, Zhou X, Zhang Y, et al. Performance and properties of nanoscale calcium peroxide for toluene removal [J]. Chemosphere, 2013,91(5):717-723.
[18] Qian Y, Zhang J, Zhang Y, et al. Degradation of 2,4-dichlorophenol by nanoscale calcium peroxide: Implication for groundwater remediation [J]. Separation and Purification Technology, 2016,166:222-229.
[19] Arienzo M. Degradation of 2,4,6-trinitrotoluene in water and soil slurry utilizing a calcium peroxide compound [J]. Chemosphere, 2000, 40(4):331-337.
[20] Lewis S, Lynch A, Bachas L, et al. Chelate-Modified Fenton Reaction for the Degradation of Trichloroethylene in Aqueous and Two-Phase Systems [J]. Environmental engineering science, 2009,26(4):849-859.
[21] Zhu Z, Chen Y, Gu Y, et al. Catalytic degradation of recalcitrant pollutants by Fenton-like process using polyacrylonitrile-supported iron (II) phthalocyanine nanofibers: Intermediates and pathway [J]. Water Research, 2016,93:296-305.
[22] Jho E H, Singhal N, Turner S. Fenton degradation of tetrachloroethene and hexachloroethane in Fe(II) catalyzed systems [J]. Journal of Hazardous Materials, 2010,184(1):234-240.
[23] Zhang X, Gu X, Lu S, et al. Application of calcium peroxide activated with Fe(II)-EDDS complex in trichloroethylene degradation [J]. Chemosphere, 2016,160:1-6.
[24] Xue Y, Gu X, Lu S, et al. The destruction of benzene by calcium peroxide activated with Fe(II) in water [J]. Chemical Engineering Journal, 2016,302:187-193.
[25] Yehia F Z, Kandile N G, Badawi A M, et al. Glutamic Acid Modified Fenton System for Degradation of BTEX Contamination [J]. Clean– Soil, Air, Water, 2012,40(7):692-697.
[26] Teel A L, Warberg C R, Atkinson D A, et al. Comparison of mineral and soluble iron Fenton's catalysts for the treatment of trichloroethylene [J]. Water Research, 2001,35(4):977-984.
[27] Fu X, Gu X, Lu S, et al. Enhanced degradation of benzene in aqueous solution by sodium percarbonate activated with chelated-Fe(II) [J]. Chemical Engineering Journal, 2016,285:180-188.
[28] Zhou Y, Fang X, Wang T, et al. Chelating agents enhanced CaO2oxidation of bisphenol A catalyzed by Fe3+and reuse of ferric sludge as a source of catalyst [J]. Chemical Engineering Journal, 2017,313: 638-645.
[29] Anquandah GaK, Sharma V K, Knight D A, et al. Oxidation of trimethoprim by ferrate(VI): kinetics, products, and antibacterial activity [J]. Environmental science & technology, 2011,45(24):10575- 10581.
[30] Yang B, Ying G G. Oxidation of benzophenone-3during water treatment with ferrate(VI) [J]. Water Research, 2013,47(7):2458-2466.
[31] Chen J, Xu X, Zeng X, et al. Ferrate(VI) oxidation of polychlorinated diphenyl sulfides: Kinetics, degradation, and oxidized products [J]. Water Research, 2018,143:1-9.
[32] Jiang W, Joens J A, Dionysiou D D, et al. Optimization of photocatalytic performance of TiO2coated glass microspheres using response surface methodology and the application for degradation of dimethyl phthalate [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2013,262:7-13.
[33] Du E, Feng X X, Guo Y Q, et al. Dimethyl phthalate degradation by UV/H2O2: combination of experimental methods and quantum chemical calculation [Z]. 2014.
[34] 殷雪妍,张 艾,刘亚男.过氧化钙去除水中糖皮质激素的响应面分析 [J]. 中国环境科学, 2018,38(2):608-615. Yin X Y, Zhang A, Liu Y N, et al. Response surface analysis of glucocorticoid removal by calcium peroxide [J]. China Environmental Science, 2018,38(2):608-615.
[35] 贺强礼,刘文斌,杨海君,等.1株对叔丁基邻苯二酚降解菌的筛选鉴定及响应面法优化其降解 [J]. 环境科学, 2015,36(7):2695-2706. He Q L, Liu W B, Yang H J, et al. Isolation, identification of a p-tert-butylcatechol-degradaing strains and optimization for its degradation by response surface methodology [J]. Environmental Science, 2015,36(7):2695-2706.
[36] Tang P, Jiang W, Lyu S, et al. Ethanol enhanced carbon tetrachloride degradation in Fe(II) activated calcium peroxide system [J]. Separation and Purification Technology, 2018,205:105-112.
[37] Wang H, Zhao Y, Su Y, et al. Fenton-like degradation of 2,4- dichlorophenol using calcium peroxide particles: performance and mechanisms [J]. RSC Advances, 2017,7(8):4563-4571.
[38] Zhang X, Gu X, Lu S, et al. Application of ascorbic acid to enhance trichloroethene degradation by Fe(III)-activated calcium peroxide [J]. Chemical Engineering Journal, 2017,325:188-198.
[39] Liao C H, Kang S F, Wu F A. Hydroxyl radical scavenging role of chloride and bicarbonate ions in the H2O2/UV process [J]. Chemosphere, 2001,44(5):1193-1200.
[40] Verma S, Nakamura S, Sillanpää M. Application of UV-C LED activated PMS for the degradation of anatoxin-a [J]. Chemical Engineering Journal, 2016,284:122-129.
[41] Sharma V K. Potassium ferrate (VI): an environmentally friendly oxidant [J]. Advances in Environmental Research, 2002,6(2):143-156.
Degradation performance of dimethyl phthalate from aqueous environment by dual oxidant of ferrate/calcium peroxide.
ZHU Zheng-rong, WANG Ming-xin*, ZHANG Jin-yong, YE Qian, ZHOU Jie
(School of Environmental & Safety Engineering, Changzhou University, Changzhou 213164, China)., 2019,39(7):2838~2846
The degradation efficiency and mechanism of ferrite (Fe(VI))/calcium oxide (CaO2) combined treatment on dimethyl phthalate (DMP) were studied. Multi-factor experiments were carried out based on the Box-Behnken experimental design in Response Surface Method. Relationships between the removal rate of DMP and Fe(VI)dosage, CaO2dosage and reaction time were fitted by quadratic polynomial and stepwise regression method, and the experimental conditions were optimized. DMP could be effectively removed by Fe(VI)/CaO2under neutral pH conditions, and the degradation process conformed to the pseudo-second-order kinetic model. The maximum degradation rate of DMP predicted by the model reached 95.57% when the molar ratio of Fe(VI)/CaO2/DMP was 1.1/4.4/1, which was close to 90.14% obtained by verification experiments, indicating that the model possessed a good simulation and predictive performance. HCO3-and Mg(Ⅱ) inhibited the degradation of DMP to a certain extent. The results of free radical scavenging experiments revealed that hydroxyl radical (HO·) and superoxide radical (O2-·) made significant contributions to the degradation of DMP, demonstrating that Fe(VI)and CaO2could form Fenton-like reagents to synergistically degrade pollutants. The main degradation pathways of DMP included hydrolysis of ester group, oxidation of side chain and hydroxylation of benzene ring. The main degradation products were monomethyl phthalate, 2,5-dihydroxybenzoic acid, isophthalic acid, oxalic acid, etc.
ferrate;calcium peroxide;dimethyl phthalate;response surface method;degradation mechanisms
X703
A
1000-6923(2019)07-2838-09
朱峥嵘(1994-),女,江苏南通人,常州大学环境与安全工程学院硕士研究生,主要研究水环境中邻苯二甲酸酯污染物的去除.发表论文2篇.
2018-11-05
国家自然科学基金资助项目(41772240,41641032)
* 责任作者, 教授, wmxcau@163.com

