木犀草素对黑素瘤B16细胞系生长、转移及血管生成拟态形成的抑制作用研究
平晓芳 崔锡梅 陈伟 邢卫斌
天津市第五中心医院皮肤科 300450
肿瘤血管生成对促进肿瘤的生长转移至关重要。研究发现,内皮依赖性血管并不是黑素瘤血液供应的唯一来源[1],1999年 Maniotis 首次提出侵袭性葡萄膜黑素瘤细胞在特定情况下模拟血管内皮细胞形成一种功能上类似于正常血管的管道,可以与常规的内皮血管相通连,构成网状的血液输送循环,从而为肿瘤提供必要的营养支持,这一过程被定义为血管生成拟态(vasculogenic mimicry,VM)[2]。目前已证实,包括黑素瘤在内的多种恶性肿瘤中均存在VM[3-4],并且其阳性率与肿瘤级别及患者的预后密切相关[5]。VM 的形成机制目前尚不完全清楚,可能与血管内皮生长因子(VEGF)及基质金属蛋白酶(MMP)[6]高表达有关。木犀草素是一种天然黄酮类化合物,具有抗肿瘤[7]、抗炎、抗氧化[8]、抗菌、降尿酸等多种药理作用。研究表明,木犀草素体外可剂量依赖性抑制乳腺癌和前列腺癌的脂肪酸合成酶活性,进而抗肿瘤细胞增长并促其凋亡[9]。木犀草素还可抑制卵巢癌细胞的侵袭运动能力,可能与抑制MMP-9 分泌及下调细胞外信号调节激酶2 的表达有关。本研究旨在探究木犀草素对黑素瘤的进展及VM形成的影响,为黑素瘤的治疗提供新思路。
材料与方法
一、实验材料
B16小鼠黑素瘤细胞系(南京凯基生物科技发展有限公司),木犀草素[纯度98%,成都普思生物科技有限公司,CR 级,溶于二甲基亚砜(DMSO)],1640 培养基、胎牛血清(FBS)(北京钮因华信科技发展有限公司),噻唑蓝(MTT)(上海克拉玛尔公司);Matrigel基质(美国BD公司),兔抗鼠血管内皮钙黏蛋白(VE-Cad)、MMP-2、MMP-9 单抗(美国Abcam 公司),兔抗鼠CD31、血管内皮生长因子受体 1(VEGFR1)、VEGFR2 单抗(美国 Affinity 公司)。实验小鼠(C57)购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],动物实验许可证号:No.11400700314508。
二、方法
1.细胞增殖实验:取正常培养的B16 细胞,以5 000 个/100 μl 铺于 96 孔板中,24 h 后加木犀草素,溶剂为0.1%二甲基亚砜,药物浓度设为0(对照组)、0.5、1、2、4、6、8、10、20、40 μmol/L,每个浓度6个复孔,加药24 h后,每孔加入5 × MTT 25 μl,37 ℃孵育4 h,酶标仪于562 nm处测吸光度(A值)。细胞增殖活性抑制率 =[(A对照组-A给药组)/A对照组]×100%,计算IC50值。结果显示,木犀草素对B16细胞的 IC50 值为 23.84 μmol/L(R= 0.92),后续体外实验中木犀草素低、中、高剂量分别采用2.5、5、10 μmol/L。
2.细胞培养及分组:B16 细胞用含10% FBS、1%青链霉素双抗的1640 培养基在37 ℃、5% CO2培养箱中培养,培养2 代后分为4 组,对照组正常培养,木犀草素低、中、高剂量组另加入2.5、5、10 μmol/L 木犀草素,培养48 h 收集细胞用于以下实验。
3.划痕实验:将4 组B16 细胞接种于24 孔板,待细胞密度达到90%时,弃原培养基,磷酸盐缓冲液(PBS)洗3次,在细胞表面划痕,PBS清洗脱落细胞,换为含1%FBS的1640培养基,显微镜下观察,依次记录0、24、48 h 划痕宽度并随机选取视野拍照,实验重复3 次。以相对划痕宽度衡量迁移能力,相对划痕宽度=划痕宽度/原始宽度,相对划痕宽度越小迁移能力越强。
4.侵袭实验:将Matrigel 胶和1640培养基按照体积比 1∶2 混匀,取 100 μl 铺至 Transwell 小室表面,置于37 ℃、5%CO2培养箱中凝固1 h;取无血清培养基悬起的各组B16细胞200 μl(约5×105个/ml)加至上室中,下室加入含20% FBS 的1640 培养基300 μl,37 ℃、5%CO2培养箱培养24 h,穿过的细胞用预冷的多聚甲醛固定,结晶紫染色,各组随机拍照,并记录穿过细胞数目,实验重复3次。
5.管道形成实验:将Matrigel 胶和1640培养基按照体积比1∶2混匀,铺至6孔板中,凝固1 h;用含10% FBS 的 1640 培养基悬起各组细胞,取 2 ml 加至6孔板中(约4 × 105个/ml),37 ℃、5%CO2培养箱培养24 h,显微镜(×10)下观察管道形成情况,记录各组管道数量,并随机选取视野拍照,实验重复3次。
6.细胞免疫荧光:将对照组和木犀草素高剂量组 B16 细胞悬液 500 μl(约 1.5 × 105个/ml)接种于24 孔板的爬片上,细胞贴壁后,PBS 洗 3 次,固定、封闭后,加入 VE-Cad(1∶200)、VEGFR1(1∶300)、VEGFR2(1∶300)、MMP-2(1∶200)、MMP-9(1∶200)抗体,室温30 min后置4 ℃过夜,弃一抗,PBS清洗,加入相应PBS 稀释的荧光二抗(1∶200),避光孵育1 h,用带甘油的4′,6-二脒基-2-苯基吲哚染核封片,荧光显微镜(×60)下观察并拍照,荧光强度用ImageJ定量分析,实验重复3次。
7.黑素瘤形成实验:6 ~ 8 周龄雌性、体重23 ~25 g的SPF级C57小鼠12只,分为对照组和木犀草素低、中、高剂量组,每组3只,适应性饲养1周后将B16黑素瘤细胞悬液注射于小鼠左侧背部皮下,约2×106个细胞/只,1 周后于皮下触及肿瘤,开始给药。木犀草素高、中、低剂量组每天分别给予40、20、10 mg/kg(超纯水配置)木犀草素0.1 ml 灌胃,对照组给予0.1 ml 超纯水,隔天观察小鼠状态,记录小鼠体重及瘤体积,肿瘤体积=(长径× 短径)2/2。给药至荷瘤第28 天时处死全部实验动物,解剖取小鼠肺及肿瘤组织,切片后HE染色,观察肺转移情况,计算各组肺相对转移面积(相对于肿瘤组织),相对转移面积为同一显微镜4 倍视野下转移灶的测量值。
8.肿瘤组织免疫组化[10]及CD31-过碘酸希夫(PAS)双染[11]:参照相应文献进行免疫组化和双染实验。最后,显微镜下观察拍照,10倍镜下随机选取5 个视野分别计数VM,取均值。VM 判定标准:CD31阴性,PAS染色阳性,肿瘤细胞排列成管壁结构,管腔中央有红细胞存在[11-12]。对照组及木犀草素高剂量组肿瘤组织另做VE-Cad、VEGFR1、VEGFR2、MMP-2、MMP-9免疫组化染色,计算染色指数。染色指数=染色面积×染色强度[10]。
9.肿瘤组织内木犀草素浓度检测:肿瘤组织按1∶3质量比加入去离子水,匀浆,1 700×g4 ℃离心10 min,取上清液 100 μl,加入 10 μl IS 工作液和500 μl 甲醇,涡旋3 min,沉淀蛋白,4 ℃、4 000 ×g离心沉淀,取上清液20 μl 进样分析。用质谱法分析木犀草素浓度。
三、统计学方法
结 果
一、体外实验
1.木犀草素对B16细胞迁移能力的影响:见图1。对照组和低、中、高剂量木犀草素组细胞在48 h时相对痕宽度差异有统计学意义(F= 34.51,P<0.001),木犀草素各组细胞迁移能力均低于对照组(t值分别为5.83、9.25、12.72,均P< 0.05),中、高剂量组均低于低剂量组(t值分别为2.61、5.23,均P<0.05),高剂量组低于中剂量组(t=2.61,P< 0.05)。
2.木犀草素对B16细胞侵袭能力的影响:见表1、图2。对照组和低、中、高剂量木犀草素组穿过小室膜的细胞数量差异有统计学意义(P<0.001),木犀草素各组侵袭能力均低于对照组(t值分别为14.21、24.66、30.82,均P< 0.01),其中木犀草素中、高剂量组均低于低剂量组(t值分别为9.13、13.21,均P< 0.001),高剂量组低于中剂量组(t= 4.10,P< 0.05)。
3.木犀草素对B16细胞管道生成能力的影响:见表1、图2。对照组和低、中、高剂量组细胞的管道形成数量差异有统计学意义(P<0.001),低、中、高剂量组均低于对照组(t值分别为4.91、7.51、11.78,均P< 0.01),中、高剂量组均低于低剂量组(t值分别为2.27、5.52,均P< 0.05),高剂量组低于中剂量组(t=3.24,P< 0.01)。
表1 体外实验中不同浓度木犀草素对B16细胞侵袭能力、管道生成能力的影响(±s)

表1 体外实验中不同浓度木犀草素对B16细胞侵袭能力、管道生成能力的影响(±s)
注:n=3
组别对照组低剂量组中剂量组高剂量组F值P值侵袭能力(细胞数)281.00±8.79 169.00±15.35 92.00±14.79 57.00±13.72 275.30<0.001管道生成能力(管道数)20.00±2.768 11.00±1.279 7.00±1.865 2.00±1.324 48.61<0.001
4.木犀草素对B16细胞VM相关标志物表达水平的影响:细胞水平的免疫荧光实验显示,木犀草素高剂量组VE-Cad、VEGFR1、VEGFR2、MMP-2、MMP-9蛋白表达水平均低于对照组(图3),差异均有统计学意义(t值分别为6.97、11.64、5.74、10.87、5.14,均P< 0.05)。
二、体内实验


图1 木犀草素对B16细胞迁移能力的影响 低、中、高剂量木犀草素组在24、48 h时的迁移能力均低于对照组。1A:各组细胞相对划痕宽度随时间变化情况;1B:显微镜下观察各组划痕愈合情况
1.木犀草素对黑素皮下移植瘤模型小鼠体重及肿瘤生长的影响:第28 天时木犀草素给药组和对照组小鼠体重较实验开始时均有下降,4组小鼠体重(g)差异有统计学意义(F=23.93,P< 0.001),对照组低于各木犀草素给药组(t值分别为6.30、18.42、13.19,均P< 0.01),中、高剂量组均高于低剂量组(t值分别为7.26、11.51,均P< 0.01),高剂量组高于中剂量组(t= 4.23,P< 0.05)。见图4。肿瘤生长的第28天,对照组、低剂量组、中剂量组、高剂量组肿瘤终体积差异有统计学意义(F=28.76,P<0.001),低、中、高剂量木犀草素组肿瘤体积均小于对照组(t值分别为 3.86、7.11、13.06,均P<0.01),中、高剂量组均低于低剂量组(t值分别为3.94、10.54,均P< 0.01),高剂量组低于中剂量组(t=6.59,P< 0.05)。见图5。
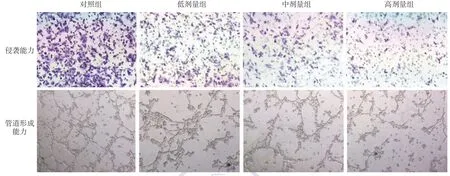
图2 木犀草素对B16细胞侵袭能力及管道形成能力的影响

图3 木犀草素对B16细胞血管内皮钙黏蛋白(VE-Cad)、血管内皮生长因子受体(VEGFR)1、VEGFR2、基质金属蛋白酶(MMP)2、MMP9蛋白表达水平的影响 高剂量组均低于对照组(P <0.05)

图4 木犀草素对黑素瘤皮下移植瘤小鼠体重的影响 低、中、高剂量组小鼠体重均高于对照组
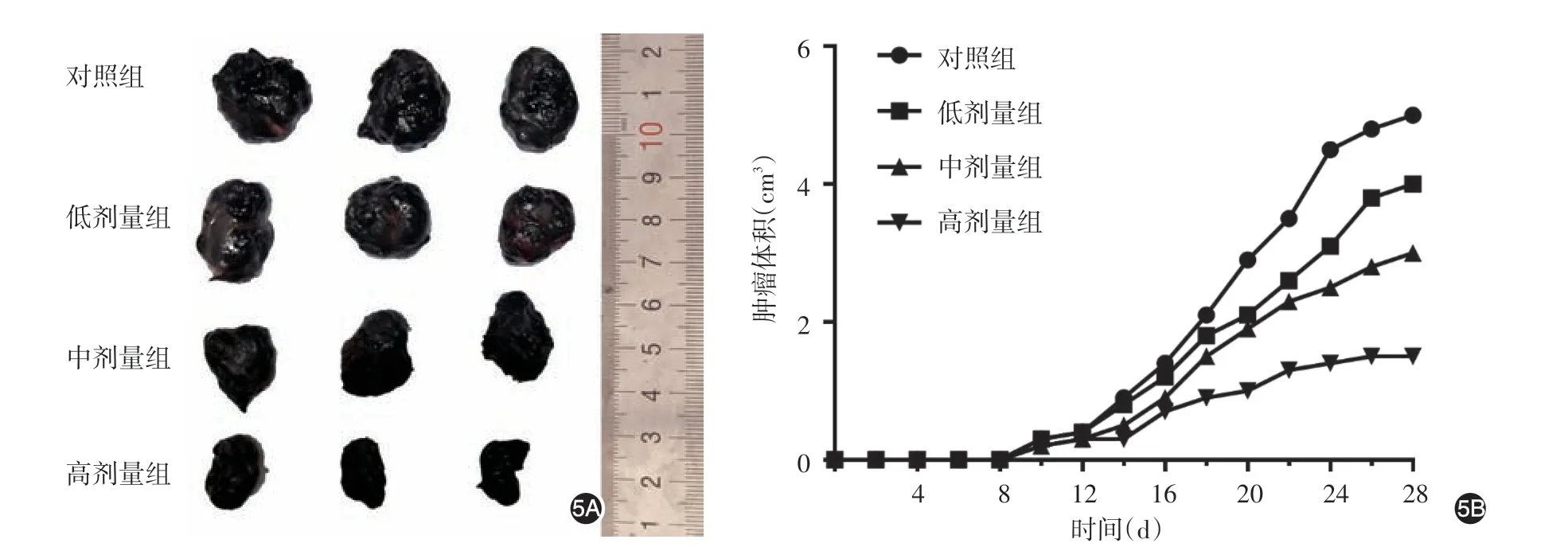
图5 木犀草素对黑素瘤皮下移植瘤生长的影响 5A:第28天时各组移植瘤体积对比;5B:各组移植瘤体积随时间变化情况
表2 体内实验中不同剂量木犀草素对小鼠黑素瘤皮下移植瘤血管生成拟态(VM)形成数量、肺转移灶面积的影响及肿瘤组织中木犀草素的含量(±s)

表2 体内实验中不同剂量木犀草素对小鼠黑素瘤皮下移植瘤血管生成拟态(VM)形成数量、肺转移灶面积的影响及肿瘤组织中木犀草素的含量(±s)
注:n=3
组别对照组低剂量组中剂量组高剂量组F值P值VM形成数量(个)5.00±0.81 4.00±0.80 2.00±0.57 1.00±0.50 48.61<0.001肺转移灶面积(cm2)10.67±0.78 8.33±0.58 5.32±0.54 3.60±0.82 54379<0.001木犀草素含量(μg/g)-0.060±0.010 0.075±0.005 0.113±0.032 5.88 0.04

图6 木犀草素对黑素瘤皮下移植瘤小鼠血管生成拟态形成能力的影响 箭头处为血管生成拟态(CD31-PAS双染×10)

图7 木犀草素对黑素瘤皮下移植瘤小鼠肺转移的影响 低、中、高剂量组肺转移面积均低于对照组。图中比例尺单位为200 μm
2.木犀草素对皮下移植瘤小鼠VM 形成能力的影响:CD31-PAS双染结果显示,对照组和低、中、高剂量组VM 形成数量(表2)差异有统计学意义(P<0.001),对照组VM 形成数量高于各木犀草素组(t值分别为2.61、5.00、7.83,均P< 0.01),中、高剂量组均低于低剂量组(t值分别为2.89、5.77,均P< 0.05),高剂量组低于中剂量组(t= 2.887,P<0.05)。见图6。
3.木犀草素对黑素瘤皮下移植瘤小鼠肺转移的影响:木犀草素组和对照组小鼠均存在肺转移,4 组肺转移灶面积差异有统计学意义(F= 54.79,P< 0.001),各木犀草素组均低于对照组(t值分别为4.00、8.50、9.80,均P< 0.05)。见表2、图7。
4.木犀草素对小鼠黑素瘤皮下移植瘤组织中VM相关标志物表达水平的影响:免疫组化染色结果显示,VE-Cad、VEGFR1、VEGFR2、MMP-2、MMP-9主要表达于肿瘤细胞的细胞质,木犀草素高剂量组VE-Cad、VEGFR1、VEGFR2、MMP-2、MMP-9蛋白表达水平均低于对照组,差异有统计学意义(t值分别为 14.55、12.34、13.98、13.98、14.79,均P< 0.05)。见图8。

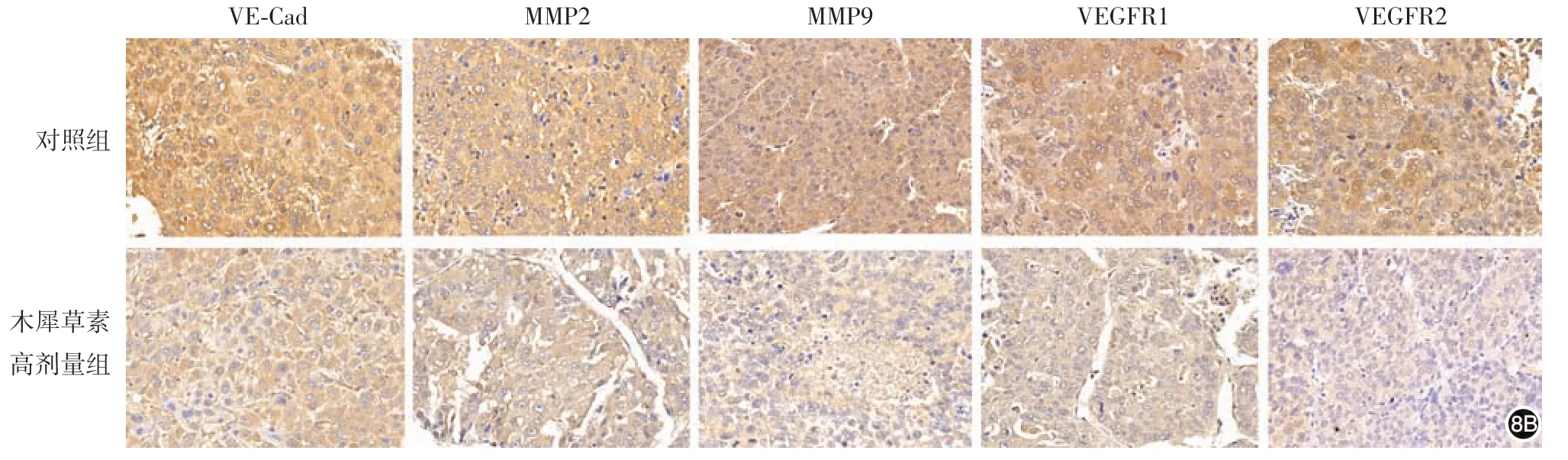
图8 木犀草素对小鼠黑素瘤皮下移植瘤组织中血管内皮钙黏蛋白(VE-Cad)、血管内皮生长因子受体(VEGFR)1、VEGFR2、基质金属蛋白酶(MMP)2、MMP9表达水平的影响(免疫组化×20) 8A:对照组和高剂量各蛋白表达水平柱状图,a:P <0.05;8B:免疫组化观察两组各蛋白表达水平
5.肿瘤组织内木犀草素含量测定:质谱结果显示,木犀草素低、中、高剂量组肿瘤组织内木犀草素含量差异有统计学意义(P=0.04)。
讨 论
黑素瘤是一种高转移、高侵袭性的恶性肿瘤。VM 最初在侵袭性黑素瘤中被发现,随后研究不断证实多种肿瘤中均存在这种与经典肿瘤血管生成方式不同的模式,并与预后密切相关[13-14],其机制尚未明确,主要认为与肿瘤细胞的可塑性相关[15]。肿瘤细胞可表达多种与内皮细胞相关的基因,如VEGF、MMP等。MMP可通过促进细胞外基质重塑促进肿瘤VM 形成;VEGF 除了促进内皮依赖性血管生成外,也可以促进VM 形成;VE-Cad 是很多VM 调控因子的关键蛋白[16]。木犀草素是一种具有代表性的天然黄酮,除了抑制肿瘤增殖外[16],还可通过抑制MMP活性来抑制肿瘤的浸润转移。木犀草素可抑制肿瘤内皮依赖性血管生成能力[17]。
本研究在体外和体内分别探究了木犀草素对黑素瘤的恶性演进能力的影响,进一步验证了既往报道的木犀草素对黑素瘤细胞增殖能力的抑制作用。此外,我们发现,木犀草素在体外可抑制黑素瘤B16细胞的迁移与侵袭,在体内可控制小鼠肿瘤肺转移,且体内、体外均能抑制VM 形成。可抑制VM 标志物MMP 及血管生成相关蛋白VEGF、VE-cadherin 的表达,提示木犀草素可能通过抑制这些蛋白的表达抑制黑素瘤细胞VM形成,进而抑制肿瘤恶性演进。
本研究显示,木犀草素可以通过抑制细胞外基质重塑和血管生成相关蛋白的表达抑制黑素瘤VM形成,进而抑制小鼠黑素移植瘤的生长和肺转移。此外,我们发现,给予木犀草素后,荷瘤小鼠的体重较实验开始时均有所下降,但比对照组的下降的幅度小,提示木犀草素对机体的毒副作用较小,未来有望被开发为特异性靶向VM 的治疗黑素瘤的药物。
利益冲突所有作者均声明不存在利益冲突

