花花柴脂肪酸合成相关基因KcFabZ的克隆及分析
王 磊 王彦芹
(塔里木大学生命科学学院,新疆阿拉尔843300)
脂肪酸作为生物体基本组成成分之一,不仅是细胞膜脂的主要成分,还是重要的能源物质。植物脂肪酸生物合成的过程复杂,需要多种酶共同协调作用来完成,植物脂肪酸合成酶FAS属于Ⅱ脂肪酸合成酶系[1],由β-酮脂酰-ACP合酶(FabH)、β-酮脂酰-ACP还原酶(FabG)、β-羟脂酰-ACP脱水酶(FabZ)、烯脂酰-ACP还原酶(FabI)构成。FabZ是植物脂肪酸生物合成途径中碳链延伸循环步骤的主要脱水酶[2],能有效地催化短链β-羟基酰基-ACP和长链饱和及不饱和β-羟基酰基-ACP脱水,对于底物的催化活性随着链的增长,催化活性降低,催化活性与链长成反比[3];最早在幽门螺杆菌(Helicobacter pylori)菌株SS1(HpfabZ)中克隆了fabZ基因,并通过插入扩增的fabZ片段产生重组表达质粒,纯化后的HpFabZ在40℃下显示出最高的酶活性,在90℃时,HpFabZ仍然表现出近50%的活性,推测HpFabZ六聚体的形成使与其热稳定性相关[4];刘丽等[5]克隆了陆地棉(Gossypium hirsutum Linn)脂肪酸碳链延长酶β-酮脂酰-ACP还原酶(FabG)并构建了超表达载体转化棉花,对其抗寒性进行研究,结果表明,转基因株系的相对电导率和脯氨酸含量积累明显高于对照,而丙二醛含量低于对照,在不同胁迫时间与对照表现出显著或极显著差异,过表达的转基因株系的抗寒性有所提高。温度胁迫已是全球植物环境限制因素之一,也是造成植物细胞损伤的重要原因之一[6]。高温胁迫会导致植物叶片和幼茎的焦化、叶片脱落和衰老,更严重的还会引起根系生长受到抑制、果实发育停止、脱落等现象[7],甚至造成植株死亡[8]。在植物生长和繁殖期间,温度的极端变化会破坏适当生长所需的分子间相互作用,尤其对夏季开花植物,高温还会导致植物散粉受阻、无法受精等,从而影响种子发育和结实[9]。
花花柴(Karelinia capsia)属菊科(Asteraceae)、花花柴属(Karelinia),多年生草本植物,广泛生长在我国新疆、甘肃、青海等地,在新疆南疆沙漠区广泛分布。花花柴叶片肉质化[10],根系庞大,枝叶节点可再生,对环境有极强的适应性,具有广谱抗逆性[11]。花花柴幼苗在高温40℃处理后,其叶片的相对电导率和MDA含量随着胁迫时间延长呈现先升高后降低的趋势,保护酶系统的活性也随着处理时间的延长而逐渐升高[12],但花花柴对高温的响应机制尚不明确。基于本实验室前期对花花柴高温处理下的转录组测序结果的研究,发现脂肪酸生物合成途径FabZ基因差异表达。本研究通过PCR技术克隆了花花柴的FabZ基因,并分析在高温处理下的基因表达模式,将有助于进一步探索FabZ基因的调控作用,以及深入理解花花柴的抗逆机理。
1 材料与方法
1.1 材料
实验材料来源于塔克拉玛干沙漠,鉴定人:塔里木大学植物学教师张玲。
选取饱满的花花柴种子种于营养土:蛭石(2:1)的花盆中,在25℃、相对湿度50%,光周期为16 h光照/8 h黑暗条件下生长,待长至18~20片叶片时转入恒温培养箱中,分别在40 ℃高温处理0 h、0.5 h、2 h、4 h、8 h、16 h、24 h时取样,于-80 ℃冰箱保存备用。
植物总RNA提取试剂盒TransZol Plant购自北京全式金科技有限公司;第一链合成试剂盒Prime-Script RT reagent Kit with gDNA Eraser(Perfect Real Time)购自TAKARA公司。引物合成及常规测序由北京六合华大基因科技股份有限公司完成。
1.2 方法
1.2.1 RNA提取及cDNA合成
利用TransZol Plant(全式金)试剂盒提取样品叶片总RNA,并用1%琼脂糖凝胶电泳检测RNA的完整性,利用紫外分光光度计检测RNA的质量和浓度,反转录参照PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)(TAKARA)试剂盒,荧光定量PCR参照Bestar SybrGreen qPCR Mastermix(DBI)试剂盒。
1.2.3 花花柴FabZ基因的克隆
根据花花柴转录组测序结果中功能注释为FabZ的序列设计引物(见表1),以0 h处理花花柴cDNA为模板,利用RT-PCR法进行基因克隆。反应体系采用Super Mix(恒朝)取1 μLcDNA反应液作为模板,PCR反应程序如下:94 ℃ 4 min,94 ℃ 30 s,58 ℃ 30 s,72℃ 1 min,72℃ 8 min,30 cycle。胶回收参照(全式金)连接载体pMD19-T(TAKARA),转化大肠杆菌DH5α感受态,蓝白斑筛选后,挑取单菌落进行扩大培养,对PCR检测为阳性的克隆送样由广州艾基生物技术有限公司进行测序。
1.2.4 花花柴FabZ蛋白质的生物信息学分析
基因编码蛋白的生物信息学分析,利用MEGA6.0构建基因的系统进化树,分析其近缘物种件的同源性,获得相关的进化信息;运用clustal X多序列比对软件进行比对;借助在线分析软件ProtParam(http://web.expasy.rog/protparam/)对基因编码蛋白进行理化性质分析;利用TMred(http://ch.embnet.org/software/TMPRED_form/htm)和 ProtScale工具(http://web.expasy.org)分析基因的跨膜区域及疏水结构域;通过NCBI的CDD(Conserved domain database)数据库对基因的功能结构域进行分析鉴定;登录在线软件SOPMA对基因的二级结构进行预测;利用在线分析软件Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page)和SWISS-MODEL进行基因的三级结构分析并进行建模;利用MEME在线分析软件对基因的Motif进行预测,利用Cell-PLoc 2.0进行亚细胞定位。
1.2.5 FabZ表达模式分析
利用Bestar SybrGreen qPCR Mastermix(DBI)试剂盒,根据操作指南操作配置,以处理0 h、0.5 h、2 h、4 h、8 h、16 h、24 h 处理的花花柴cDNA为模板,PCR反应和荧光信号检测在(伯乐CFX96)荧光定量PCR仪上进行,程序:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,72℃30 s,30 cycle,每个样设置3个平行,重复2次试验,以18s为内参基因对目的基因进行定量分析,引物参照(表1)。
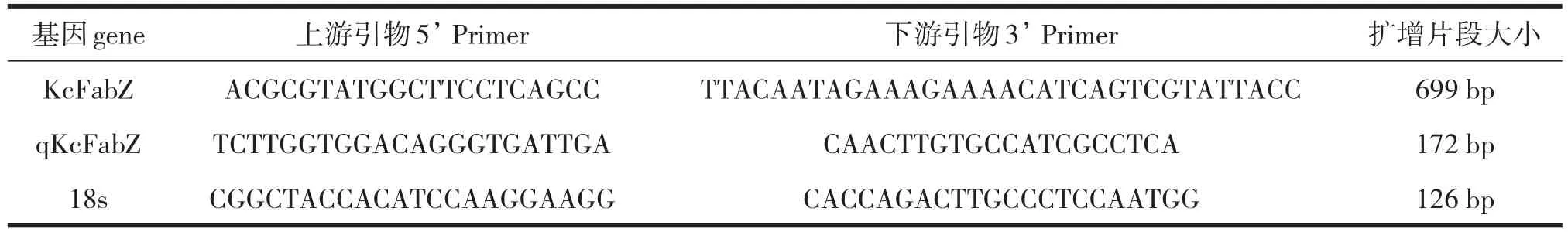
表1 引物序列
2 结果与分析
2.1 花花柴FabZ基因克隆及序列分析
利用设计的FabZ引物,以花花柴的全长cDNA为模板,扩增基因长度为699 bp的序列,包括完整的CDS,编码232个氨基酸(图1),将基因命名为KcFabZ。在对KcFabZ的开放阅读框理化分析中发现,KcFabZ的正电荷残基数20,负电荷残基数23,理论pI为9.00,该蛋白呈碱性,其分子量为25 474.65 D,总平均亲水值为0.139,脂质指数为89.87。

图1 KcFabZ基因的全长序列以及翻译出的氨基酸序列
2.2 FabZ蛋白质生物信息学分析
对KcFabZ蛋白做进一步分析。根据对KcFabZ基因编码蛋白进行跨膜区域和疏水性分析可知,Kc-FabZ基因编码蛋白不存在跨膜区域。利用SWISS软件对该蛋白质进行二级结构预测,结果显示,KcFabZ蛋白主要以β折叠(25.86%)、无规则卷曲(50.00%)为主,占75.86%。通过Phyre2软件和SWISS-Modle对KcFabZ蛋白3D结构进行预测 (图2a、图2b),KcFabZ蛋白在结构上具有典型的α+β‘hot_dog'折叠模式。在对各物种FabZ基因100条序列的Motif分析中可以看出,KcFabZ蛋白在大部分氨基酸位都高度保守(图2c)。

图2 KcFabZ保守结构域3D结构和Motif注:aKcFabZ单体结构图;bKcFabZ六聚体结构图;cKcFabZMotif
用MEGA6等多序列比对软件对花花柴及一些其他物种的FabZ基因编码蛋白序列进行比对(图4a),并构建进化树(图3),KcFabZ基因进化树分析结果显示,花花柴与莴苣亲缘关系较近。利用NCBICDD分析基因蛋白质的保守结构域,KcFabZ基因具有典型的α+β‘hot_dog'折叠结构,为表现为hot_dog超家族功能基因,有催化活性、代谢等功能(图4b),KcFabZ基因亚细胞定位在叶绿体中。

图3 KcFabZ与其他植物同源氨基酸的系统进化树

图4 KcFabZ的保守结构域和功能域分析注:aKcFabZ保守结构域;bKcFabZ功能域
2.3 荧光定量PCR分析
荧光定量PCR分析表明,KcFabZ在高温胁迫的各个时间段均有表达(图5),KcFabZ在高温胁迫下处于上升趋势,在8 h时表达量约是对照的20倍,在16 h后,表达量下降。说明高温胁迫能够诱导KcFabZ基因的表达。

图5 KcFabZ基因在不同时间高温处理下叶片中的表达分析
3 结论与讨论
本研究首次在花花柴中克隆出KcFabZ基因,通过序列分析发现该基因具有典型FabZ功能结构域和α+β‘hot_dog'折叠,为六聚体,通过Motif分析发现KcFabZ在大部分氨基酸都具有高度保守,这在酶结构稳定化中起重要作用,在幽门螺杆菌中用圆二色光谱测量的酶表征和热诱导解折叠证明了HpFabZ在高温(90℃)下非常稳定,源于HpFabZ六聚体之间的强H-键和疏水相互作用,更好地阐明了HpFabZ结构的高稳定性[4]。在同源比对中发现,KcFabZ与莴苣(Lactuca sativaLinn)、向日葵(Helianthus annuus)、青蒿(Artemisia annua)等物种的β-羟酰基-ACP脱水酶同源性均达到75%以上,且与莴苣亲缘关系最近,可能由于花花柴与莴苣同属于菊科,具有物种同源性。
FabZ作为脂肪酸合成酶的一种,是脂肪酸碳链延长的关键酶,与FabI、FabG构成了脂肪酸碳链延伸的循环体系,在脂肪酸合成途径中发挥重要作用,如Bourgis[13]的研 究中高 油 分含量 的油桐(Vernicia fordii)中β-羟酰基-ACP脱水酶的表达量是椰枣(Phoenix dactylifera)中的8倍;在Tai[14]等的研究中就发现在云杉(Picea asperata Mast)脂肪酸从头合成的脂肪酸合成酶中的FabZ的mRNA第一个内含子存在可变剪接并且随着温度的降低再增加,表明β-羟酰基-ACP脱水酶不仅在脂肪酸合成中发挥重要作用,对温度还具有很高的敏感度。本研究通过qRT-PCR技术,以40℃高温处理不同时间的花花柴培养植株为材料,发现在高温处理下基因的表达模式均不同于常温条件,表现出先增高后降低的变化趋势,推测可能与高温逆境处理相关。
研究表明,植物叶片表皮蜡质在逆境胁迫响应中起到重要作用,Zhu等[15]的研究中发现在干旱下诱导蜡质积累的基因(DWA1)的突变体与野生材料相比对干旱胁迫高度敏感,可以通过调节水稻干旱诱导的表皮蜡沉积来控制抗旱性;吴洪启等[16]发现干旱胁迫能够诱导蜡质合成相关基因β-酮脂酰-辅酶A合成酶表达量上调。花花柴作为一种荒漠植物,叶片较厚,表面附着一层厚厚的蜡质,经预测KcFabZ基因定位于花花柴叶器官的叶绿体中,叶绿体是质体的一种,蜡质合成的第一步是在质体中合成长度为C16~C18的脂肪酸,第二步在内质网中长链脂肪酸进行碳链的延伸,第三部超长链脂肪酸在内质网的修饰下形成醇类、酯类和烷烃等,故推测该基因与其叶表面蜡质积累有关。到目前为止,针对脂肪酸基因抗逆性的研究重点在不饱和脂肪酸的去饱和酶上,对脂肪酸合成酶的碳链延长酶基因与植物抗逆性关系的研究报道较少。例如,在Wolter等[17]的研究中,将拟南芥(Arabidopsis thaliana)GPAT过表达会引起不饱和脂肪酸含量的增加,从而更适应在低温下生长,也有文献表明,在拟南芥中膜脂肪酸的不饱和度与生长温度成反比[18],在低温条件下小麦(Triticum aestivum L)中脂肪酸中α-亚麻酸(18:3)比例由于ω-3去饱和酶TaFAD3基因的作用随着温度的降低而增加[19]。Murakami等[20]克隆了编码叶绿体ω-3脂肪酸去饱和酶的基因(其合成三烯脂肪酸),并在转基因烟草(Nicotianatabacum)中沉默,研究发现转基因材料更能适应高温环境。而关于FabZ基因的研究大部分在原核菌类上,在植物中鲜有报道,本研究通过RNA-seq分析对花花柴脂肪酸生物合成差异表达基因FabZ进行系统发育预测,发现该基因在脂肪酸合成路径中发挥重要作用并能对高温处理有一定的响应,将为探索花花柴耐高温机制和研发耐高温转基因作物奠定了一定的理论基础。

